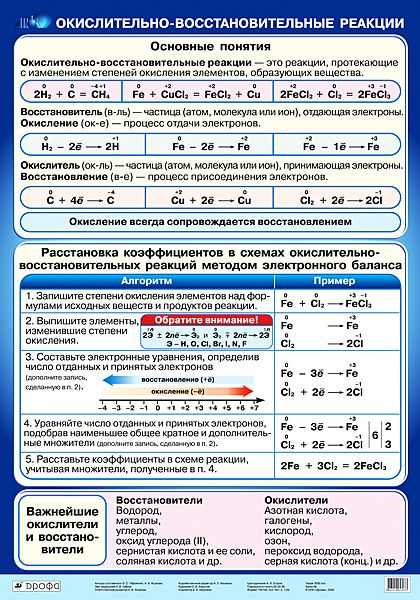
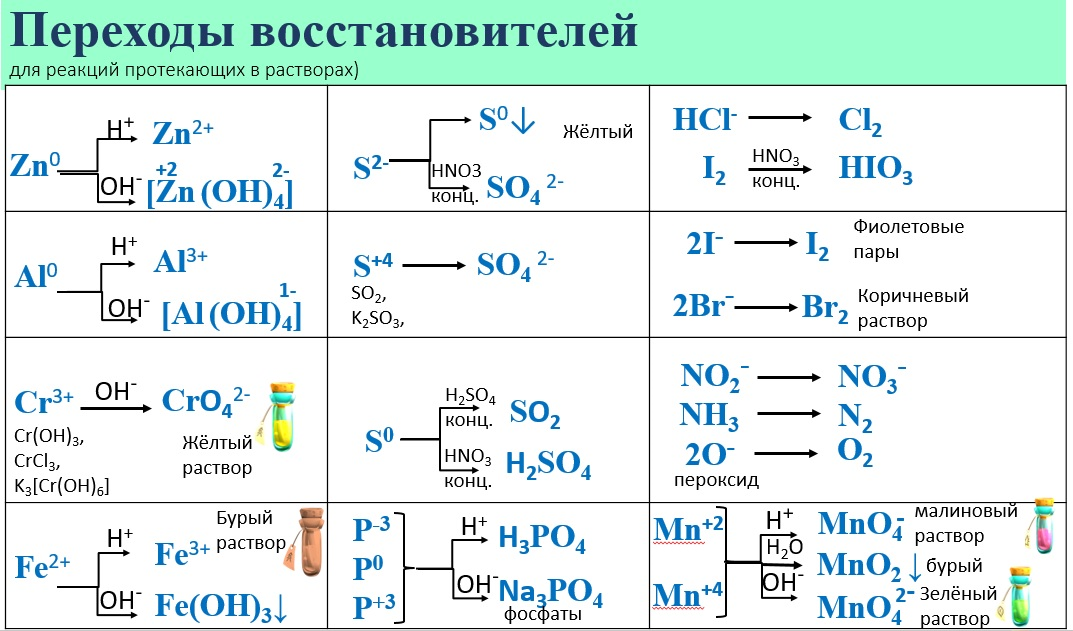
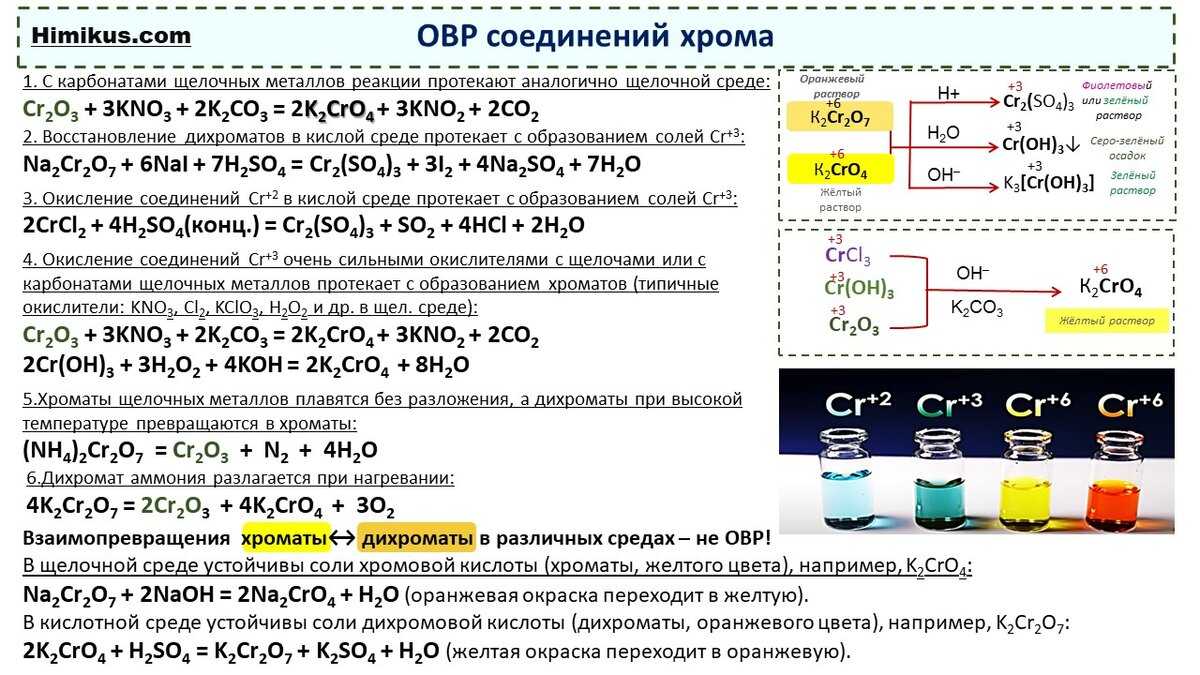
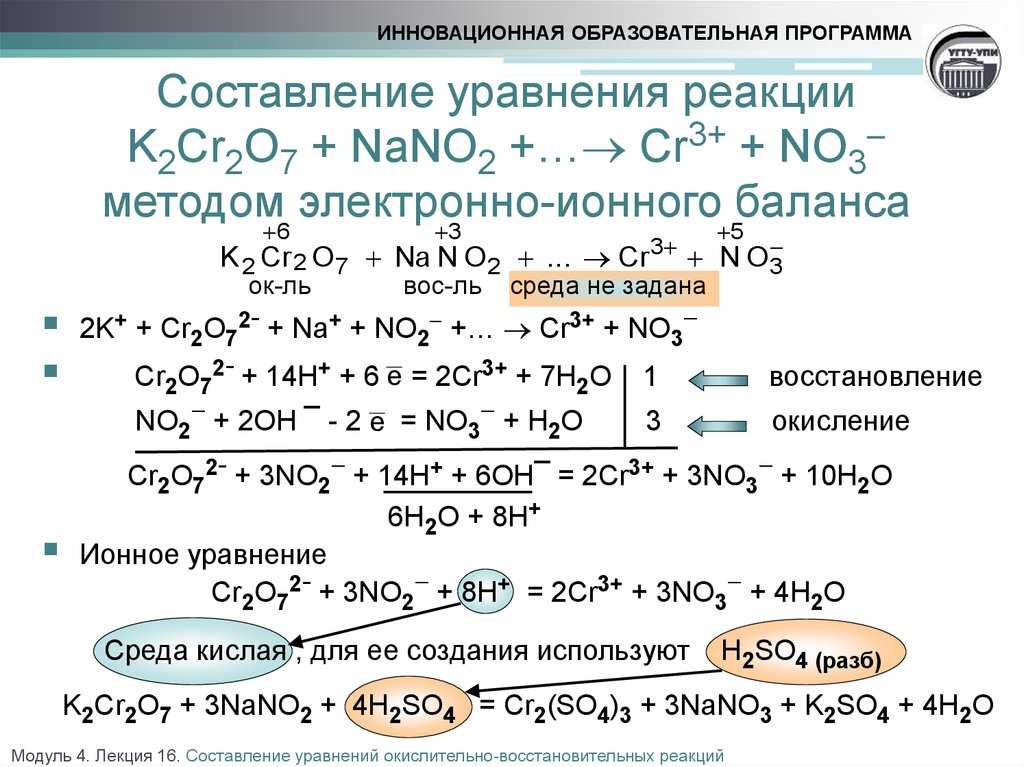
Строение атома и свойства серы
Сера — элемент шестой группы третьего периода периодической системы Менделеева. Поэтому строение атома серы изображается так:
![]()
Строение атома серы указывает на то, что это неметалл, т. е. атом серы способен и к приёму электронов и к отдаче электронов:

Задание 15.1. Составить формулы соединений серы, содержащие атомы серы с данными степенями окисления.
Простое вещество «сера» — твёрдый хрупкий минерал жёлтого цвета, нерастворимый в воде. В природе встречается как самородная сера, так и её соединения: сульфиды, сульфаты. Сера как активный неметалл легко реагирует с водородом, кислородом, почти со всеми металлами и неметаллами:
Задание 15.2. Назовите полученные соединения. Определите, какие свойства (окислителя или восстановителя) проявляет сера в этих реакциях.
Как типичный неметалл простое вещество сера может быть и окислителем, и восстановителем:

Иногда эти свойства проявляются в одной реакции:

Поскольку атом-окислитель и атом-восстановитель одинаковые, их можно «сложить», т. е. на оба процесса нужно три атома серы.
Задание 15.3. Расставьте остальные коэффициенты в этом уравнении.
Сера может реагировать с кислотами — сильными окислителями:
Таким образом, являясь активным неметаллом, сера образует множество соединений. Рассмотрим свойства сероводорода, оксидов серы и их производных.
Соединения серы
Соединения серы имеют различные свойства и применения. Некоторые из них являются окислителями, а другие – восстановителями. В таблице ниже приведены некоторые соединения серы и их окислительно-восстановительные свойства:
| Соединение | Формула | Окислительно-восстановительные свойства |
|---|---|---|
| Диоксид серы | SO2 | Окислитель |
| Триоксид серы | SO3 | Окислитель |
| Сернистый ангидрид | SO2 | Восстановитель |
| Сероводород | H2S | Восстановитель |
| Сульфаты | Множество соединений | Окислитель |
Диоксид серы (SO2) и триоксид серы (SO3) обладают сильными окислительными свойствами. Они могут окислять многие органические и неорганические соединения, такие как алкены, алканы, аммиак, сероводород и многие другие. Кроме того, они могут использоваться в производстве серной кислоты и других серных соединений.
Сернистый ангидрид (SO2) и сероводород (H2S) являются восстановителями. Они могут восстанавливать многие соединения, включая некоторые окислители, такие как хлор и бром. Кроме того, они могут использоваться в производстве серной кислоты, каменного угля и других продуктов.
Сульфаты – это соединения, которые содержат группу SO4. Они также могут действовать как окислители. Некоторые сульфаты, такие как медный сульфат, могут использоваться в качестве катализаторов в окислительных реакциях.
Микробное разнообразие
Окисление восстановленных Соединения серы выполняются исключительно бактериями и архей. Все археи, участвующие в этом процессе, являются аэробными и принадлежат к отряду Sulfolobales, характеризующимся ацидофилами (экстремофилами, которым для роста требуется низкий pH) и термофилы (экстремофилы, которым для роста требуются высокие температуры). Наиболее изученными были роды Sulfolobus, аэробные археи, и Acidianus, факультативный анаэроб (т. Е. Организм, который может получать энергию посредством аэробного или анаэробного дыхания).
Сероокисляющие бактерии (SOB) являются аэробными, анаэробными или факультативными, и большинство из них являются облигатными или факультативными автотрофами, которые могут использовать диоксид углерода или органические соединения в качестве источника углерода (миксотрофы ). Наиболее многочисленные и изученные SOB находятся в семействе Thiobacilliaceae в наземных средах и в семействе Beggiatoaceae в водных средах. Аэробные сероокисляющие бактерии в основном мезофильные, которые растут в умеренных диапазонах температуры и pH, хотя некоторые из них являются термофильными и / или ацидофильными. Вне этих семейств другие описанные SOB принадлежат родам Acidithiobacillus, Aquaspirillum, Aquifex, Bacillus, Methylobacterium, Paracoccus, Pseudomonas Starkeya, Thermithiobacillus и Xanthobacter. С другой стороны, кабельные бактерии принадлежат к семейству Desulfobulbaceae Deltaproteobacteria и в настоящее время представлены двумя родами-кандидатами: Candidatus Electronema и Candidatus Electrothrix.
Анаэробные SOB (AnSOB) — это в основном нейтрофильные / мезофильные фотосинтетические автотрофы, которые получают энергию от солнечного света, но используют восстановленные соединения серы вместо воды в качестве доноров электронов для фотосинтеза. AnSOB включает некоторые пурпурные серные бактерии (Chromatiaceae), такие как Allochromatium, и зеленые серные бактерии (Chlorobiaceae), а также пурпурные несодержащие серы бактерии (Rhodospirillaceae) и некоторые цианобактерии. Цианобактерии AnSOB способны окислять только сульфид до элементарной серы и были идентифицированы как Oscillatoria, Lyngbya, Aphanotece, Microcoleus и Phormidium. Некоторые AnSOB, такие как факультативные анаэробы Thiobacillus spp. И Thermothrix sp., Являются хемолитоавтотрофами, что означает, что они получают энергию от окисления восстановленных соединений серы, которая затем используется для фиксации CO 2. Другие, такие как некоторые скользящие зеленые бактерии (Chloroflexaceae), являются миксотрофами. Из всех SOB единственной группой, которая непосредственно окисляет сульфид до сульфата в избытке кислорода без накопления элементарной серы, являются тиобациллы. В других группах накапливается элементарная сера, которую они могут окислять до сульфата, когда сульфид ограничен или истощен.
Серный ангидрид и серная кислота
Серный ангидрид SO3 — бесцветная жидкость, бурно реагирующая с водой:
Серная кислота H2SO4 — сильная кислота, которая в концентрированном виде активно поглощает влагу из воздуха (это свойство применяется при осушении различных газов) и из некоторых сложных веществ:

Кроме того, концентрированная серная кислота, являясь сильным окислителем, окисляет углерод:
![]()
Поэтому, попадая на кожу, концентрированная серная кислота вызывает тяжёлые ожоги, а попадая на ткани, бумагу и другие вещества, обугливает их.
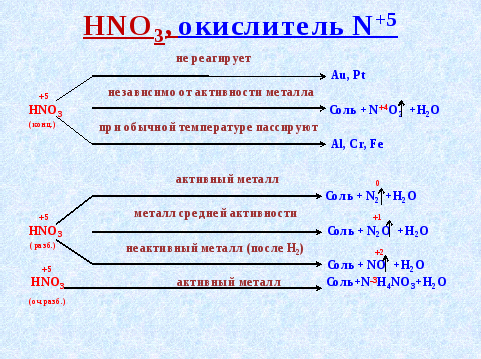
Являясь окислителем (+6 — высшая степень окисления для серы!), концентрированная серная кислота реагирует почти со всеми металлами (кроме железа и благородных металлов) без выделения водорода:

Задание 15.7. Уравняйте эти схемы методом электронного баланса. Укажите, какой атом является окислителем в каждом случае.
Но разбавленная серная кислота и её соли — сульфаты — окислительных свойств (за счёт атома серы) практически не проявляют:

Задание 15.8. Определите, какой атом является окислителем в данной реакции.
Растворы серной кислоты проявляют все свойства сильных кислот.
Задание 15.9. Составьте уравнения реакций, отражающие эти свойства. (При затруднении см. урок 2.2.)
Качественной реакцией на SO42– является образование белого осадка BaSO4, нерастворимого в кислотах:
Серная кислота имеет разнообразное применение: её используют при получении стиральных порошков, лекарств, красителей, удобрений и других необходимых веществ.

Слайды и текст этой презентации
диспропорционирования тиосульфата:S2O32- + H20 → SO42- + HS- + H+Go
= – 21,9 кДж/моль S2O32-Суммарная реакция диспропорционирования сульфита:4SO32- + H+ → 3SO42- + HS-Go = – 58,9 кДж/ моль SO32-

из реакций неорганических соединений серы: S2- → nS2- → S0
→ S2O32- → SO32- → SO42-, так и включать реакции органических форм. Атом серы органических сульфидов обычно окисляется после отделения в виде S2 – по неорганическому пути, хотя возможен и чисто органический путь окисления, когда атом серы окисляется, находясь в составе органических соединений, например цистеин → цистин. Большинство реакций окисления серных соединений может протекать без участия микроорганизмов в присутствии сильных окислителей (H2O2, O3, кислородные радикалы), однако микробное окисление гораздо более эффективно, особенно при низких концентрациях реагента.

Слайд 8Бесцветные серобактерии
По морфологии, характеру движения, способу размножения и строению клеток
Thiothrix, Thiospirillopsis, Thioploca, Achromatium) проявляют большое сходство с синезелеными водорослями. Некоторые исследователи, в частности Прингсхейм (Pringsheim, 1963), рассматривают эти микроорганизмы как бесцветные их варианты. Аналогом Beggiatoa считают сине-зеленую водоросль Oscillatoria, Thiothrix – Rivularia, Thiospirillopsis – Spirulina, a Achromatium похож на Synechococcus.

Слайд 9Большинство так называемых тионовых бактерий – типичные хемоавтотрофы, т.е. они
используют восстановленные соединения серы не только как Н-доноры, но и
в качестве источников энергии и способны расти на чисто минеральных средах, ассимилируя углекислоту. Такие бактерии были впервые выделены из воды Неаполитанского залива (Натансон, 1902) и получили название Thiobacillus (Бейеринк, 1904). К настоящему времени описано много видов автотрофных тиобацилл, выделенных из разных водоемов, почвы, а также из месторождений серы и разных металлов.

Слайд 10К первой группе относятся такие виды, как: Т. thioparus, Т.
denitrificans, Т. novellus, Т. thiocyanoxidans, Т. neapolitanus. Для этих микроорганизмов
оптимальное значение рН приходится на область 6,0–9,0, а зона значений рН, при которых возможен их рост, – от 3,0–6,0 до 10,0–11,0, причем для разных видов и штаммов оптимальные значения рН и. область активной кислотности, в которой наблюдается их рост, могут заметно различаться.Ко второй группе принадлежат Т. thiooxidans, Т. ferroxidans, Т. intermedius. Для этих микроорганизмов оптимальное значение рН 2,0–4,0, а рост возможен при рН от 0,5–2,0 до 5,0–7,0. Наиболее ацидофильными организмами являются два первых вида. Обе эти бактерии растут при значениях рН не более 5,0. В то же время показано, что Т. thiooxidans сохраняет жизнеспособность при значении рН, близком к 0, что соответствует 1,0 н. раствору серной кислоты. Это, пожалуй, самый ацидофильный микроорганизм, который известен исследователям.

различных ее соединений является сульфат. Если процесс идет таким образом,
т.е. происходит полное окисление исходного субстрата, то результаты его отражают следующие уравнения. При окислении сероводорода:


Слайд 15Цикл соединений железа Хлеб ржаной 2.0-2.6 пшеничный
0.9-2.8 Крупа гречневая
8.0 овсяная 3.9 Рис 1.8 Горох 9.4 Фасоль 12.4 Мясо (говядина) 2.6-2.8Печень (говяжья) 9.8 Язык (говяжий) 5.0 Судак 0.4 Молоко коровье 0.1 Масло сливочное 0.2 Картофель 0.9 Творог 0.4 Соль поваренная 10.0 Шоколад 2.7 Лимоны 0.6 Апельсины 0.3 Яблоки 2.2 Земляника 1.2 Редис 1.0 Помидоры 0.5-1.4 Морковь 1.2-1.4
ПРОДУКТЫ и СОДЕРЖАНИЕ в них ЖЕЛЕЗА (в мг . н а 100 г .)

Слайд 10К первой группе относятся такие виды, как: Т. thioparus, Т.
denitrificans, Т. novellus, Т. thiocyanoxidans, Т. neapolitanus. Для этих микроорганизмов
оптимальное значение рН приходится на область 6,0–9,0, а зона значений рН, при которых возможен их рост, – от 3,0–6,0 до 10,0–11,0, причем для разных видов и штаммов оптимальные значения рН и. область активной кислотности, в которой наблюдается их рост, могут заметно различаться.Ко второй группе принадлежат Т. thiooxidans, Т. ferroxidans, Т. intermedius. Для этих микроорганизмов оптимальное значение рН 2,0–4,0, а рост возможен при рН от 0,5–2,0 до 5,0–7,0. Наиболее ацидофильными организмами являются два первых вида. Обе эти бактерии растут при значениях рН не более 5,0. В то же время показано, что Т. thiooxidans сохраняет жизнеспособность при значении рН, близком к 0, что соответствует 1,0 н. раствору серной кислоты. Это, пожалуй, самый ацидофильный микроорганизм, который известен исследователям.