Ультрацентрифугирование белков: что это?
Ультрацентрифугирование, метод разделения и исследования высокомолекулярных соединений, вирусов и субклеточных частиц с помощью ультрацентрифуги.
Идея ультрацентрифугирования была предложена А. В. Думанским в 1913, однако разработка современной теории седиментационного анализа стала возможной только после того, как Т. Сведберг в 1926 сконструировал высокоскоростную ультрацентрифугу, обеспечивавшую ускорение 105 g.
Принято различать 2 типа ультрацентрифугирования: препаративное и аналитическое. Препаративное ультрацентрифугирование применяют для фракционирования и выделения биополимеров в количествах, достаточных для практических целей.
Широко используют ультрацентрифугирование в градиенте плотности растворовсахарозы, глицерина, декстринов; оно позволяет разделять смеси веществ на отдельные компоненты, различающиеся эффективной массой и коэффициентом трения частиц или молекул.
Применение зональных и проточных роторов дало возможность значительно повысить объёмы растворов фракционируемых частиц и использовать их для очистки вируса гриппа при изготовлении вакцин.
Аналитическое ультрацентрифугирование используют для исследования гомогенности (чистоты) препаратов биополимеров (белков, нуклеиновых кислот, полисахаридов), а также для определения константседиментации, молекулярной массы, констант ассоциации и размеров макромолекул.
Ультрацентрифугирование применяется в медицине при клинической диагностике, для приготовления кровезаменителей и т.п.
Физико-химические свойства белков. Молекулярная масса, размеры и форма, растворимость, ионизация и гидратация
Основные физико-химические свойства белков:1. Различия белков по молекулярной массе: белки явл. высокомолекулярныыми соединениями, но могут сильно отличаться по молекулярной массе, которая колеблется от 6000 до 1 000 000 Д и выше. Молекулярная масса белка зависит от количества АК остатков в ППЦ, а для олигомерных белков – и от количества входящих в него протомеров (или субъединиц).2. Различия белков по форме молекул• Глобулярные – имеют более компактную структуру, в третичной стр-ре имеют шарообразную форму, их гидрофобные радикалы в большинстве своём спрятаны в гидрофобное ядро, и они значительно лучше растворимы в жидкостях организма (гемоглобин, инсулин)• Фибриллярные – имеют нитевидн. стр-ру, нерастворимы (коллаген, кератин)3. Растворимость – это способность белка равномерно располагаться (распространяться) между молекулами растворителя, зависит от аминокислотного состава белка и природы растворителя. • Растворимость белка определяется составом растворителя, т.е. наличием в растворе других растворённых веществ. Например, некоторые белки легче растворяются в слабом солевом растворе, чем в дистиллированной воде.• Увеличение конц. нейтральных солей может способствовать выпадению определённых белков в осадок.• Денатурирующие агенты, присутствующие в растворе, также снижают растворимость белков.4. Гидратация – способность белков прочно связывать значительное количество влаги. На поверхности большинства внутриклет. белков преобладают полярные радикалы, однако соотношение полярных и неполярных групп отлично для разных индивидуальных белков. Протомеры олигомерных белков в области контактов друг с другом часто содержат гидрофобные радикалы. Поверхности белков, функционирующих в составе мембран или прикрепляющиеся к ним в процессе функционирования, также обогащены гидрофобными радикалами. Такие белки лучше растворимы в липидах, чем в воде.5. Кислотно основные свойства – белки обладают кислотными и основными свойствами из-за присутствия -СООН и — NН2 групп.6. Ионизация – заряд белковой молекулы обусловлен реакцией среды и соотношением ионогенных групп в белковой молекуле.• Полярные (неионогенные) группы: — ОН (сер, тре, тир) SН (цис), Амидная (глн, асн), Пептидные группировки • Полярные (ионогенные) группы: СОО-(асп, глу), NН3+ (лиз, арг), N – (гис)Суммарный заряд белковой молекулы зависит от соотношения ионизированных анионных радикалов Глу и Асп и катионных радикалов Лиз, Apг и Гис.Степень ионизации функц-х групп этих радикалов зависит от рН среды. • При рН раствора около 7 все ионогенные группы белка находятся в ионизированном состоянии.• В кислой среде увеличение концентрации протонов (Н+) приводит к подавлению диссоциации карбоксильных групп и уменьшению отрицательного заряда белков: -СОО- + Н+ → -СООН. • В щелочной среде связывание избытка ОН» с протонами, образующимися при диссоциации NH3+с образованием воды, приводит к уменьшению положительного заряда белков:-NH3+ +ОН- → -NH2 + H2O.Изоэлектрическая точка (pI) – значение рН, при котором белок приобретает суммарный нулевой заряд. В pI количество «+» и «-» заряженных групп белка одинаково, т.е. белок находится в изоэлектрическом состоянии.• Так как большинство белков в клетке имеет в своём составе больше анионогенных групп (-СОО-), то pI этих белков лежит в слабокислой среде. • pI белков, в составе которых преобладают катионогенные группы, находится в щелочной среде. Наиболее яркий пример таких внутриклеточных белков, содержащих много аргинина и лизина, — гистоны, входящие в состав хроматина.Одноименно заряженные молекулы белка отталкиваются друг от друга, что предотвращает агрегацию молекул белка и образование осадка.Белки, имеющие суммарный положительный или отрицательный заряд, лучше растворимы, чем белки, находящиеся в pIЗаряженные белки могут двигаться в электрическом поле:• Анионные белки («-» заряд) будут двигаться к «+» заряженному аноду• Катионные белки («+» заряд) будут двигаться к «-» заряженному катоду
Похожие материалы:
Биологические свойства белков
Нами были рассмотрены физические свойства белков в химии. Но стоит также обязательно рассказать о том, какое влияние они оказывают на организм и почему без них он не будет полноценно функционировать. Ниже перечислены функции белков:
- ферментативная. Большинство реакций в организме протекает с участием ферментов, которые имеют белковое происхождение;
- транспортная. Данные элементы осуществляют доставку других важных молекул в ткани и органы. Одним из самых значимых транспортных белков является гемоглобин;
- структурная. Белки являются главным строительным материалом для многих тканей (мышечной, покровной, опорной);
- защитная. Антитела и антитоксины представляют собой особый вид белковых соединений, которые составляют основу иммунитета;
- сигнальная. Рецепторы, которые отвечают за работу органов чувств, тоже имеют в своей структуре белки;
- запасающая. Данную функцию выполняют особые белки, которые могут быть строительным материалом и являться источниками дополнительной энергии во время развития новых организмов.
Белки способны превращаться в жиры и углеводы. А вот они не смогут стать белками. Поэтому недостаток именно этих соединений особенно опасен для живого организма. Выделяемая при усвоении белков энергия невелика и уступает в этом отношении жирам и углеводам. Однако именно они являются источником незаменимых аминокислот в организме.
Как понять, что в организме не хватает белка? У человека ухудшается самочувствие, наступает быстрая истощаемость и утомляемость. Прекрасными источниками белка являются различные сорта пшеницы, мясные и рыбные продукты, молочные, яйца и некоторые виды зернобобовых культур.
Важно знать не только физические свойства белков, но и химические, а также то, какое значение они имеют для организма с биологической точки зрения. Белковые соединения уникальны тем, что являются источниками незаменимых аминокислот, которые нужны для нормального функционирования человеческого организма
Белки — высокомолекулярные органические соединения, состоящие из остатков аминокислот, соединённых в длинную цепочку пептидной связью.
В состав белков живых организмов входит всего 20 типов аминокислот, все из которых относятся к альфа-аминокислотами, а аминокислотный состав белков и их порядок соединения друг с другом определяются индивидуальным генетическим кодом живого организма.
Одной из особенностей белков является их способность самопроизвольно формировать пространственные структуры характерные только для данного конкретного белка.
локальное упорядочивание фрагмента полипептидной цепи в спирали
пространственная ориентация полипептидной спирали или способ ее укладки определенном объеме в глобулы (клубки) или фибриллы (нити)
Из-за специфики своего строения белки могут обладать разнообразными свойствами. Например, белки, имеющие глобулярную четвертичную структуру, в частности белок куриного яйца, растворяются в воде с образованием коллоидных растворов. Белки, обладающие фибриллярной четвертичной структурой в воде не растворяются. Фибриллярными белками, в частности, образованы ногти, волосы, хрящи.
Классификация
Существует большое разнообразие классификаций, которые разделяют варианты белков. По составу их делят на простые и сложные. Сложные характеризуются образованием неаминокислотной группы, с различной природой.
Таким образом выделяют следующие группы:
- Гликопротеины;
- Нуклеопротеины;
- Липопротеины;
- Металлопротеиды;
- Хромопротеиды;
- Фосфопротеины.
В зависимости от типа строения различают:
- Фибриллярный белок;
- Глобулярный;
- Мембранный.
Под прокинами следует понимать простой вариант строения, который содержит в себе лишь остаток аминокислот. По возможности растворимости они бывают:
- Альбумины — выпадают в осадок в виде 70 — 100% сульфата аммония;
- Глобулин с большой молекулярной массой, которые сложно растворяются в водной среде, но хорошо — в солевом растворе;
- Гистоны — содержат большое количество лизина и аргинина, что влияет на свойства;
- Про амины — содержат большую концентрацию глутаминовых кислот и пролина, которые растворимы лишь в этаноле и не растворяются в воде.
- Глутелины с глутаминовой кислотой, содержащиеся в белковых злаках.
Денатурация и ренатурация белка: что это, факторы и стадии
Денатурация – нарушение нативной конформации белка. При денатурация изменяются физико-химические свойства и теряется биологическая активность белка.
При денатурации не изменяется первичная структура, но изменяется вторичная, третичная и, если есть, четвертичная структура.
Факторы денатурации:
- 1. Физические (высокая температура, вибрация, радиация, УФО, ультразвук и др.).
- 2. Химические (мочевина, кислоты и щелочи, соли тяжелых металлов, растительные алкалоиды, органические растворители и др.).
Стадии денатурации:
- 1.Рыхлый клубок.
- 2.Стадия нити.
- 3.Случайный клубок.
При денатурации уменьшается растворимость, изменяется электрофоретическая подвижность, изменяется число реакционных групп.
Способность белков к денатурации используется в медицине.
- Пастеризация продуктов.
- Стерилизация шовного материала.
Ренатурация – восстановление нативной конформации денатурированного белка. При ренатурации восстанавливаются физико-химические свойства белков и их активность.
В организме происходит быстрая ренатурация при помощи специфических белков — шаперонов. Шапероны присоединяются к денатурированному белку слабыми связями и создают условия для ренатурации.
Биологическое значение белка
Рис. 4. Структура фермента аланинаминотрансферазы
Благодаря своим физическим и химическим свойствам белки выполняют большое количество биологических функций, в перечень которых входят:
- каталитическая (белки-ферменты);
- транспортная (гемоглобин);
- структурная (кератин, эластин);
- сократительная (актин, миозин);
- защитная (иммуноглобулины);
- сигнальная (рецепторные молекулы);
- гормональная (инсулин);
- энергетическая.
Белки важны для организма человека, поскольку участвуют в образовании клеток, обеспечивают сокращение мышц у животных, вместе с сывороткой крови переносят многие химические соединения. Помимо этого, белковые молекулы являются источником незаменимых аминокислот и осуществляют защитную функцию, участвуя в выработке антител и формировании иммунитета.
Значение белков
За счет физических и химических свойств обеспечивается биологическое значение белков, среди которых:
- Каталитические процессы;
- Транспортная функция;
- Структурные возможности;
- Сократительная способность;
- Защитные свойства;
- Сигнальные возможности;
- Гормональные;
- Энергетические возможности.
Они берут на себя образование новых клеток, влияют на сократительную способность мышечной ткани, а также являются источником транспортировки полезных веществ
Еще одной важной функцией считается защитная, которая связана с образованием антител и формированием иммунного ответа
ТОП-10 малоизвестных фактов о белке
Интересный факт! Первый белок выделили из муки
- Белки начали изучать с 1728 года, именно тогда итальянец Якопо Бартоломео Беккари выделил белок из муки.
- Сейчас широкое распространение получили рекомбинантные белки. Их синтезируют путем модификации генома бактерий. В частности, таким способом получают инсулин, факторы роста и другие белковые соединения, которые используют в медицине.
- У антарктических рыб были обнаружены белковые молекулы, предотвращающие замерзание крови.
- Белок резилин отличается идеальной эластичностью и является основой мест крепления крыльев насекомых.
- В организме есть уникальные белки шапероны, которые способны восстанавливать корректную нативную третичную или четвертичную структуру других белковых соединений.
- В ядре клетки присутствуют гистоны – белки, которые принимают участие в компактизации хроматина.
- Молекулярную природу антител – особых защитных белков (иммуноглобулинов) – начали активно изучать с 1937 года. Тиселиус и Кабат применяли электрофорез и доказали, что у иммунизированных животных увеличена гамма-фракция, а после абсорбции сыворотки провоцирующим антигеном, распределение белков по фракциям возвращалось к картине интактного животного.
- Яичный белок – яркий пример реализации белковыми молекулами резервной функции.
- В молекуле коллагена каждый третий аминокислотный остаток образован глицином.
- В составе гликопротеинов 15-20% составляют углеводы, а в составе протеогликанов их доля – 80-85%.
Биологическое значение
Б. выполняют многочисл. функции. Обмен веществ (пищеварение, дыхание, выделение и др.) и жизнь клетки в целом неразрывно связаны с активностью ферментов – высокоспецифических катализаторов биохимич. реакций, являющихся Б. Защитные системы высших организмов формируются защитными Б., к которым относятся иммуноглобулины, Б. комплемента, цитокины иммунной системы, Б. системы свёртывания крови (в т. ч. плазмин, тромбин, фибрин). Важную группу составляют регуляторные Б., контролирующие биосинтез Б. и нуклеиновых кислот. К их числу относятся также пептидно-белковые гормоны. Информация о состоянии внешней среды, разл. регуляторные сигналы воспринимаются клеткой с помощью рецепторных Б., располагающихся на наружной поверхности плазматич. мембраны. За передачу сигналов внутрь клетки ответственны Б. сигнальных систем ($\ce{G}$-белки, Б.-эффекторы), которые играют важную роль в передаче нервного возбуждения и в ориентированном движении клетки (хемотаксис). В активном транспорте ионов, липидов, сахаров и аминокислот через биологич. мембраны участвуют транспортные Б., или Б.-переносчики. Среди них, напр., гемоглобин и миоглобин, осуществляющие перенос кислорода. Основу костной и соединит. тканей, шерсти, роговых образований составляют структурные Б. (в т. ч. коллаген, кератин, эластин). Они же формируют клеточный скелет и межклеточный матрикс. Расхождение хромосом при делении клетки, движение жгутиков, работа мышц животных и человека осуществляются по единому механизму при посредстве Б. сократительной системы (актина, миозина, тропомиозина, тубулина и др.). Б. – важнейшая составная часть пищи человека и кормов животных. Особое значение при этом имеют запасные Б. растений и животных (напр., казеин, проламины). Преобразование и утилизация энергии, поступающей в организм с пищей, а также энергии солнечного излучения происходят при участии Б. биоэнергетической системы (напр., родопсина, цитохромов). Среди пептидно-белковых веществ имеются антибиотики (в т. ч. грамицидины, полимиксины, энниатины), токсины и др. биологически активные вещества.
1.3. Физико-химические свойства белков
Механизм растворения белков (гидратация)
Сначала сухой белок набухаетнабуханиирастворяются, коллагенидратациейгидратной оболочкиэлектростатическиполярными группами радикалов аминокислотРис. 8. Схема формирования гидратной оболочкистабилизациюдва фактораальбуминыглобулиныпроламиныглютелиныФакторы, влияющие на растворимость белков:
- аминокислотный состав полипептидной цепи белка (генетически обусловленный фактор);
- преимущественное расположение гидрофильных аминокислот и олигосахаридных фрагментов на поверхности белковой глобулы. Большинство белков имеют гидрофильную поверхность. Однако есть и гидрофобные белки, поверхность которых образована гидрофобными радикалами аминокислот. Такие белки растворяются в липидах и встречаются преимущественно в мембранах;
- чем ниже относительная гидрофобность белков (т.е. ниже взаимодействие с липидами), тем выше взаимодействие их с молекулами растворителя, следовательно, выше растворимость;
- наличие спирализованных участков на поверхности белка повышает их растворимость;
- растворимость белков зависит от рН среды (в изоэлектрической точке белки имеют наименьшую растворимость);
- от концентрации солей: невысокая концентрация солей щелочных металлов и аммония (NaCl, Na2SO4, (NH4)2SO4) повышает растворимость, так как ионы соли препятствуют ионному (электростатическому) взаимодействию заряженных боковых радикалов аминокислот. Высокие концентрации солей снижают гидратацию глобулы (снимают гидратную оболочку) и тем самым усиливают белок-белковые взаимодействия (белок коагулирует и выпадает в осадок);
- от размеров и формы молекул: низкомолекулярные глобулярные белки с большим количеством гидрофильных групп лучше растворимы в воде и слабосолевых растворах, а фибриллярные – хуже или совсем не растворяются;
- денатурированные белки теряют способность к растворению, поскольку при денатурации изменяется конформация белковой молекулы, и он теряет гидратную оболочку и заряд.
Кислотно-основные свойства белков (электрические)
3+–Факторы, влияющие на величину и знак заряда белковой молекулыВлияние аминокислотного состава белковой молекулы на ее заряд (при условии нейтральной среды, рН=7)кислые аминокислотыосновные аминокислоты65большекислых величина отрицательного больше в белкевеличина положительногоальбуминагистонысодержат много аргинина и лизина2.Влияние рН среды на заряд белковой молекулысреда щелочная–отрицательный зарядперемещаются к анодусреда кислаяположительный зарядперемещаются к катодуизоэлектрической точкой(рI)данного белкаосновногокислых изоэлектрической точке осаждаютсяэлектрофоретического разделения белков на фракции
Электрофорез
белков имеет свой аминокислотный состав
- величина заряда белковой фракции;
- молекулярная масса (размеры белка);
- поддерживающая среда для электрофореза (хроматографическая бумага, ПААГ, агароза и др.);
–+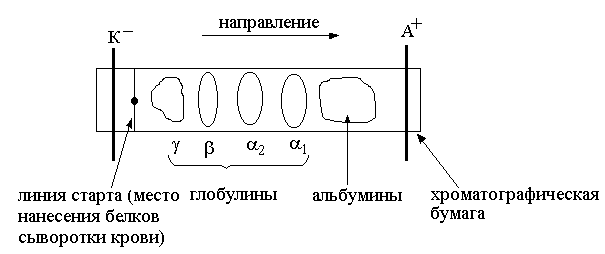 Рис. 9. Электрофореграмма белков сыворотки крови на хроматографической бумаге
Рис. 9. Электрофореграмма белков сыворотки крови на хроматографической бумаге
Коллоидные и осмотические свойства белков
свойства коллоидных систем
1. Оптические свойства белков
рефрактометрически 2. Малая скорость диффузии3. Осмотические свойства белковосмотическое давление+диализа4. Высокая вязкость белковых растворов2+кальциевых мостиков2+5. Способность белков к образованию гелейсвойства геля зависят от концентрации белка2+Физико-химические свойства гелейжелатин2
Высаливание белков 2442442424Осаждение белков органическими водоотнимающими средствамиОсаждение белков в изоэлектрической точке Денатурация белковслабые связиответственные за стабилизацию конформацииразрушаютсяпотере биологической активностифизико-химических свойствБез измененияпервичная структуратеряетгидрофильные свойстваприобретает гидрофобныеДенатурирующие факторыРенатурация белковчастичную
3
Небольшая характеристика белковых соединений
Прежде чем перейти к физическим и химическим свойствам белков, будет полезно дать им небольшую характеристику
Конечно, их свойства имеют важное значение для нормального функционирования живого организма. По своему изначальному состоянию это твердые вещества, которые либо растворяются в различных жидкостях, либо нет
Если говорить кратко о физических свойствах белков, то они обуславливают многие важнейшие биологические процессы в организме. Например, такие как транспортировка веществ, строительная функция и др. Физические свойства белков зависят от того, являются они растворимыми или нет. Вот как раз об этих особенностях и будет написано дальше.
Особенности химических свойств белков
Рассмотреть химические свойства белков можно на примере возможных реакций частиц. К таким реакциям относятся:
- Ксантопротеиновая реакция — связана за счет воздействия азотных кислот с высоким уровнем концентрации. Как результат — образование осадка со специфическим желтым оттенком.
- Биуретовая реакция — вызвана действием слабого раствора сульфата меди. В результате получаются новые соединения из ионов меди и полипептидов, что ведет к окрашиванию в фиолетовый оттенок. В практике такая реакция используется в процессе исследования сыворотки крови.
- Сервер в белковых соединениях. Это связано с процессом нагревания свинца. Как результат — темный осадок с частицами свинца.
Методы исследования белков
- 1.Высаливание.
- 2.Диализ.
- 3.Гель-фильтрация.
- 4.Электрофорез.
Высаливание
Растворимость белков сильно зависит от концентрации солей (от ионной силы). В дистиллированной воде белки чаще всего растворяются плохо, однако их растворимость возрастает по мере увеличения ионной силы.
При этом все большее количество гидратированных неорганических ионов связывается с поверхностью белка и тем самым уменьшается степень его агрегации (засаливание).
При высокой ионной силе молекулы белков лишаются гидратирующих оболочек, что приводит к агрегации и выпадению белка в осадок (высаливание).
Используя различие в растворимости, можно с помощью обычных солей, например (NН4)2SО4, разделить (фракционировать) смесь белков.
Диализ
Для отделения низкомолекулярных примесей или замены состава среды используют диализ.
Метод основан на том, что молекулы белка из-за своих размеров не могут проходить через полупроницаемые мембраны, в то время как низкомолекулярные вещества равномерно распределяются между объемом, ограниченным мембраной, и окружающим раствором.
После многократной замены внешнего раствора состав среды в диализном мешочке (концентрация солей, величина pH и др.) будет тот же, что и в окружающем растворе.
Гель-фильтрация
Гель-проникающая хроматография (гель-фильтрация) позволяет разделять белки по величине и форме молекул. Разделение проводят в хроматографических колонках, заполненных сферическими частицами набухшего геля (размером 10-500 мкм) из полимерных материалов (1а). Частицы геля проницаемы благодаря внутренним каналам, которые характеризуются определенным средним диаметром. Смесь белков вносят в колонку с гелем и элюируют буферным раствором.
Белковые молекулы, не способные проникать в гранулы геля, будут перемещаться с высокой скоростью. Средние и небольшие белки будут в той или иной степени удерживаться гранулами геля. На выходе колонки элюат собирают в виде отдельных фракций. Объем выхода того или иного белка зависит в основном от его молекулярной массы.
Электрофорез
Электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия
В настоящее время электрофорез в полиакриламидном геле (ПААГ) в присутствии додецилсульфата натрия (ДСН) является общепринятым методом определения гомогенности белковых препаратов.
Метод основан на свойстве заряженных частиц (молекул) перемещаться под действием электрического поля. Обычно скорость миграции зависит от трех параметров анализируемых белков: величины молекул, формы молекул и суммарного заряда. Поэтому предварительно белки денатурируют с тем, чтобы скорость миграции зависела только от молекулярной массы.
Для этого анализируемую смесь обрабатывают додецилсульфа-том натрия (C12H25OSO3Na), который представляет собой детергент с сильно выраженными амфифильными свойствами. Под действием ДСН олигомерные белки диссоциируют на субъединицы и денатурируют.
Развернутые полипептидные цепи связывают ДСН (примерно 0,4 г/г белка) и приобретают отрицательный заряд. Для полной денатурации в среду добавляют тиолы, которые расщепляют дисульфидные мостики.
Электрофорез проводят в тонком слое полиакриламида.
После завершения электрофореза, зоны белков выявляют c помощью красителя, В качестве примера на схеме 3 приведена электрофореграмма трех препаратов: клеточного экстракта, содержащего сотни белков; выделенного из экстракта гомогенного белка; контрольной смеси белков с известными молекулярными массами.
Определение, состав и строение белка
Белки являются биополимерами, мономерами которых являются остатки альфа-аминокислот, соединенные между собой посредством пептидных связей. Аминокислотная последовательность каждого белка строго определена, в живых организмах она зашифрована посредством генетического кода, на основе считывания которого и происходит биосинтез белковых молекул. В построении белков участвует 20 аминокислот.
Рис. 1. Схема образования молекулы белка (дипептида).
Различают следующие виды структуры белковых молекул:
- Первичная. Представляет собой аминокислотную последовательность в линейной цепи.
- Вторичная. Это более компактная укладка полипептидных цепей при помощи формирования водородных связей между пептидными группами. Есть два варианта вторичной структуры – альфа-спираль и бета-складчатость.
- Третичная. Представляет собой укладку полипептидной цепочки в глобулу. При этом формируются водородные, дисульфидные связи, также стабилизация молекулы реализуется благодаря гидрофобным и ионным взаимодействиям аминокислотных остатков.
- Четвертичная. Белок состоит из нескольких полипептидных цепей, которые взаимодействуют между собой посредством нековалентных связей.
Таким образом, соединенные в определенной последовательности аминокислоты образуют полипептидную цепь, отдельные части которой сворачиваются в спираль или формируют складки. Такие элементы вторичной структур образуют глобулы, формируя третичную структуру белка. Отдельные глобулы взаимодействуют между собой, образуя сложные белковые комплексы с четвертичной структурой.
Рис. 2. Структурная организация белков.
Изменение белкового состава организма
В процессе развития организма белковый состав значительно меняется. В специализированных тканях появляются специфические белки.
Например, гемоглобин в эритроцитах, родопсин в клетках сетчатки глаза.
Специализированные клетки отличаются и по количеству белков, присутствующих во всех или во многих тканях организма.
Белковый состав организма здорового взрослого человека относительно постоянен.
Вариации количества отдельных белков могут определяться составом пищи, режимом питания, физиологической активностью.
При различных заболеваниях происходит изменение белкового состава тканей. Эти изменения называют протеинопатиями.
Различают наследственные и приобретенные протеинопатии. Пример наследственной протеинопатии – гемоглобинопатии.
В зависимости от роли дефектного белка в жизнедеятельности организма наследственные протеинопатии могут вызывать болезни или летальный исход.
При наследственных протеинопатиях нарушается первичная структура белка.
Приобретенные протеинопатии развиваются в результате болезни.
В этом случае первичная структура белка не нарушается, а происходит
1. количественное изменение белков в пораженном органе или ткани.
2. изменение биологической активности белков из-за нарушения нативной конформации:
- – при сдвигах рН среды в щелочную или кислую сторону;
- – при присоединении низкомолекулярных веществ к белкам, например, при сахарном диабете к белкам крови присоединяется глюкоза;
Изменение белкового состава крови и мочи используется для диагностики ряда заболеваний.
Особенности физико — химических свойств
В зависимости от состава и строения белков определяются и физико — химические свойства. Количество таких частиц может колебаться от нескольких тысяч до миллионов. К списку химических свойств стоит отнести возможность к амфотерности, растворимости и денатурации. Выполнение тех или иных функций зависит от особенностей конфигураций и трехмерной структуре.
Среди основных их свойств можно выделить следующие:
- Образование коллоидного раствора за счет водорастворимых свойств;
- Способность денатурировать;
- Наличие амфотерных свойств;
- Оптические функции.
Особенности амфотерности
В белковом составе находятся кислые и основные наборы аминокислот, что и влияет на состояние амфотерности. Уровень заряда как раз таки и определяется этим соотношением. Именно поэтому заряд «+» связан со снижением pH, а заряд «–» при увеличении. Если уровень pH будет соответствовать изоэлектрическим точкам, заряд молекулы превратится в ноль. Эта функция влияет на поддержание pH в сосудистом русле.
Особенности растворимости
Согласно вышеупомянутой классификации, молекулы различаются по уровню растворимости. Они могут растворяться или не растворяться в воде, что и влияет на их свойства. Это будет зависеть от их структуры, строения, уровня солевых составов, а также температуры окружающей среды. Нерастворимыми можно считать кератины, фиброины, коллагены. На растворимость оказывает влияние и заряженные полярные групп ровки. Они способны притягивать к себе молекулы воды, что приводит к появлению гидратной оболочки.
На уровень растворимости оказывают влияние и нейтральные соли. Если наличие таких солей незначительное, уровень растворимости будет увеличиваться. С высоким уровнем солей растворимость будет ниже, за счет чего происходит разрушение гидратной оболочки.
Различают такие частицы, которые способны растворяться в соли, но не растворяются в воде. Их называют глобулинами. И, наоборот, альбумины — частицы с хорошей растворимостью в воде.
На уровень растворимости будет влиять и уровень pH. Частицы в изоэлектрических точках будут содержать небольшую растворимость, что связано с отсутствием возможности отдаления частиц.
В некоторых условиях белок может переходить в гель. Это обусловлено формированием густой сети с растворителем внутри. Не стоит забывать и о воздействии температуры. За счет высоких температур может выпадать осадок и нарушаться сама структура молекул.
Нет времени решать самому?
Наши эксперты помогут!
Контрольная
| от 300 ₽ |
Реферат
| от 500 ₽ |
Курсовая
| от 1 000 ₽ |
Нужна помощь
Особенности денатурации
Частицы при нагревании могут мутнеть и приобретать новую структуру в виде твердого сгустка. После такого процесса она уже не может растворяться в воде, как это было до нагревания. Такие изменения, которые наблюдаются в результате перегрева, называются денатурацией. В результате этого процесса наблюдается разрыв тесных взаимосвязей, кроме первичных — они остаются в неизмененном виде.
Такой процесс не всегда связывают лишь с высокой температурой. Кислота и щелочь способны активировать такой процесс без температурного влияния. Это связывают с разрывом ионной и водородной связи. Мочевина также способна разрушать частицы и нарушать их нативную структуру. Такому же воздействию подвержены и ионы тяжелых металлов с органическими растворителями.
Существует и прямо противоположный процесс — ренатурация. Это связано с возможностью восстановления нативной структуры. К примеру, под медленным охлаждением до комнатных температур могут восстанавливаться нативные связи.
Иногда денатурация возможна в результате обычной жизнедеятельности клетки. Существуют особенные клетки — шапероны, которые связываются с начальным денатурированным белком и восстанавливают их строение. Они способны распознавать и запущенный процесс распада и приводят к видоизменению этих частиц в лизосомы.






























