Нахождение в природе[]
Большая часть металлов присутствует в природе в виде руд и соединений. Они образуют оксиды, сульфиды, карбонаты и другие химические вещества. Для получения чистых металлов и дальнейшего их применения необходимо выделить их из руд и провести очистку. При необходимости проводят легирование и другую обработку металлов. Изучением этого занимается наука металлургия. Металлургия различает руды чёрных металлов (на основе железа) и цветных (в их состав не входит железо, всего около 70 элементов). Исключением можно назвать около 16 элементов: т. н. благородные металлы (золото, серебро и др.), и некоторые другие (например, ртуть, медь), которые присутствуют без примесей. Золото, серебро и платина относятся также к драгоценным металлам. Кроме того, в малых количествах они присутствуют в морской воде, растениях, живых организмах (играя при этом важную роль).
Микроскопическое строение[]
Характерные свойства металлов можно понять, исходя из их внутреннего строения. Все они имеют слабую связь электронов внешнего энергетического уровня (другими словами, валентных электронов) с ядром. Благодаря этому созданная разность потенциалов в проводнике приводит к лавинообразному движению электронов (называемых электронами проводимости) в кристаллической решётке. Совокупность таких электронов часто называют электронным газом. Вклад в теплопроводность, помимо электронов, дают фононы (колебания решётки). Пластичность обусловлена малым энергетическим барьером для движения дислокаций и сдвига кристаллографических плоскостей. Твёрдость можно объяснить большим числом структурных дефектов (междоузельные атомы, вакансии и др.).
Из-за лёгкой отдачи электронов возможно окисление металлов, что может приводить к коррозии и дальнейшей деградации свойств. Способность к окислению можно узнать по стандартному ряду активности металлов. Этот факт подтверждает необходимость использования металлов в комбинации с другими элементами (сплав, важнейшим из которых является сталь), их легирование и применение различных покрытий.
Для более корректного описания электронных свойств металлов необходимо использовать квантовую механику. Во всех твёрдых телах с достаточной симметрией уровни энергии электронов отдельных атомов перекрываются и образуют разрешённые зоны, причём зона, образованная валентными электронами, называется валентной зоной. Слабая связь валентных электронов в металлах приводит к тому, что валентная зона в металлах получается очень широкой, и всех валентных электронов не хватает для её полного заполнения.
Принципиальная особенность такой частично заполненной зоны состоит в том, что даже при минимальном приложенном напряжении в образце начинается перестройка валентных электронов, т. е. течёт электрический ток.
Та же высокая подвижность электронов приводит и к высокой теплопроводности, а также к способности зеркально отражать электромагнитное излучение (что и придаёт металлам характерный блеск).
Некоторые металлы
- Щелочные:
- Литий
- Натрий
- Калий
- Щёлочноземельные:
- Бериллий
- Магний
- Кальций
- Переходные
- Железо
- Платина
- Другие:
- Алюминий
- Свинец
- Медь
- Цинк
Кальций — необычайно важный элемент для организма человека
Формирование и укрепление костей и зубов
Кальций является основным строительным материалом для костей и зубов, поэтому его достаточное потребление очень важно для укрепления и поддержания их здоровья.
Функционирование мышц и нервной системы. Кальций играет ключевую роль в передаче нервных импульсов и сокращении мышц, поэтому его недостаток может привести к проблемам со скоординированностью движений и нервным расстройствам.
Регулирование работы сердца
Кальций участвует в процессе сокращения сердечной мышцы и поддержании нормального сердечного ритма.
Связывание и активация ферментов. Кальций является необходимым элементом для активации и функционирования определенных ферментов, которые играют важную роль во многих биологических процессах.
Помимо этого, кальций также влияет на уровень кровяного давления, иммунную систему и регулирование гормонов. Он участвует в обмене веществ и поддержании кислотно-щелочного баланса в организме. Недостаток кальция может привести к таким проблемам, как остеопороз, ухудшение зрения, судороги и даже сердечные проблемы.
Для поддержания нормального уровня кальция в организме рекомендуется употреблять пищу, богатую этим микроэлементом. Такие продукты, как молоко, йогурт, сыр, кальциевые добавки, рыба, орехи и зеленые овощи, содержат высокое количество кальция. Рекомендуемая суточная норма кальция для взрослого человека составляет около 1000-1200 мг.
Применение металлов
Железо является одним из самых широко распространенных металлов и находит применение во многих отраслях промышленности. Его основное применение состоит в производстве стальных конструкций, автомобилей, электроники, бытовой техники и многого другого. Железо также используется для производства магнитов, арматуры, труб и других строительных материалов.
Алюминий широко применяется в авиационной, автомобильной и строительной отраслях благодаря своей легкости и прочности. Он используется для производства самолетов, автомобилей, посуды, оконных рам, а также в электропроводке и промышленных упаковочных материалах. Алюминий также используется в производстве сплавов, анодов и конденсаторов в электронной промышленности.
Медь имеет высокую электропроводимость и теплоотдачу, поэтому широко используется в электротехнике и строительстве. Медные провода и кабели применяются для передачи электричества, а медные трубы используются для водоснабжения. Медь также используется для производства монет, украшений, кухонных принадлежностей и других изделий.
Свинец применяется в производстве аккумуляторов, покрытий для защиты от коррозии, охлаждающих систем, пулевых истребителей, карманных грузовиков и других изделий, где требуется высокая плотность и низкая плавкость. Свинец также используется в производстве оружия, косметики, пищевых контейнеров и литьевых форм.
Никель применяется в производстве нержавеющих сталей, а также в аэрокосмической и электронной промышленности. Никелевые сплавы используются для производства монет, ювелирных изделий, хромирования и других покрытий для защиты от коррозии. Никель также применяется в производстве аккумуляторов, медицинского оборудования и радиоэлектроники.
Цинк применяется в гальванической, строительной и химической промышленности. Он используется для защиты от коррозии, в производстве аккумуляторов, кабельных укладок, автомобильных деталей и электрических приборов. Цинк также используется в производстве литьевых сплавов, солнечных панелей и косметических продуктов.
Кроме того, многие другие металлы, такие как аргон, титан, кобальт, золото, серебро и платина, также имеют различные области применения в промышленности, электронике, медицине и других отраслях.
Свойства металлов
Проводимость электричества и тепла. Одним из главных свойств металлов является их способность проводить электричество и тепло. Это обусловлено наличием свободно движущихся электронов в металлической решетке. Благодаря этому свойству, металлы широко используются в электротехнике и теплотехнике, а также в производстве проводов и кабелей.
Пластичность и ударопрочность. Металлы отличаются высокой пластичностью, то есть способностью подвергаться пластической деформации без разрушения. Это позволяет обрабатывать металлы различными способами: ковкой, прокаткой, штамповкой и т.д. Кроме того, металлы обладают высокой ударопрочностью, то есть способностью сохранять свою прочность при воздействии ударных нагрузок.
Химическая активность. Некоторые металлы, например, натрий и калий, проявляют высокую химическую активность и легко реагируют с кислородом и водой. Однако большинство металлов химически стабильны и не подвержены коррозии, особенно если на их поверхности образуется защитная оксидная пленка. Это позволяет использовать металлы в производстве различных конструкций и механизмов, которые должны сохранять свою прочность в течение длительного времени.
Магнитные свойства. Некоторые металлы, такие как железо, никель и кобальт, обладают магнитными свойствами. Эти металлы способны притягиваться магнитом и образовывать постоянные и временные магниты. Благодаря этому, металлы используются в производстве магнитов и электромагнитов, а также в электронике и магнитной записи информации.
Высокая плотность. Металлы характеризуются высокой плотностью, то есть большим массовым содержанием вещества на единицу объема. Это позволяет использовать металлы для создания конструкций с высокой прочностью и устойчивостью к нагрузкам.
2.4. Механические свойства металлов и сплавов
Механическими называют свойства, которые определяются с воздействием силы. К ним относятся: прочность, твёрдость, пластичность, упругость, ударная вязкость и жаропрочность металлов.
Прочность – способность металла сопротивляться разрушению при действии на него внешних сил. Прочность – одно из важных свойств металлов. Для точного определения и измерения прочности из металла или сплава изготовляют образец и подвергают
его испытанию на специальной разрывной машине, которая постепенно, но с возрастающей силой растягивает образец до полного его разрыва. Наибольшее напряжение, которое может выдержать образец металла не разрушаясь, называется пределом прочности
для данного металла или временным сопротивлением разрыву.
Прочность определяется в испытаниях на растяжение, сжатие, изгиб, кручение и срез (Рис.2.1).
Рис.2.1. Определение прочности металла
Твердость – способность металла сопротивляться внедрению в него более твердого тела. Твердость определяют с помощью твердомеров внедрением стального закаленного шарика в металл (на приборе Бринелля) или внедрением алмазной пирамиды в хорошо
подготовленную поверхность образца (на приборе Роквелла). Чем меньше размер отпечатка, тем больше твердость испытуемого металла. Например, углеродистая сталь до закалки имеет твердость 100 . . . 150 НВ (по Бринеллю), а после закалки — 500
. . . 600 НВ (Рис.2.2).
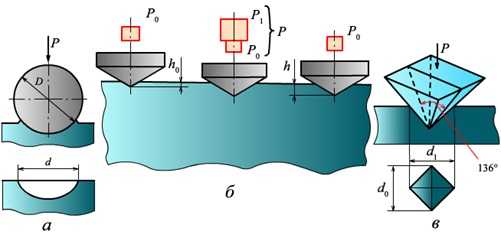
Рис. 2.2. Схема определения твердости: а — по Бринеллю; б — по Рoквеллу; в — по Виккерсу
Ударная вязкость – способность металла сопротивляться действию ударных нагрузок.
Хрупкость – свойство металла разрушаться без заметной пластической деформации.
Вязкость – способность металла оказывать сопротивление ударным внешним силам. Вязкость — свойство обратное хрупкости.
Упругость – способность металла восстанавливать форму и объем после прекращения действий внешних сил. Высокой упругостью должны обладать стали и сплавы для изготовления рессор и пружин.
Пластичность – способность металла необратимо изменять свою форму и размеры под действием внешних и внутренних сил без разрушения.
Необходимость определения пластичности металлов вызывается тем, что пластичные металлы можно подвергать обработке давлением, т. е. ковать, штамповать или на прокатных станах превращать слитки металлов в полосы, листы, прутки, рельсы и многие другие
изделия и заготовки.
В противоположность пластичным хрупкие металлы под действием нагрузки разрушаются без изменения формы. При испытании хрупкие образцы разрушаются без удлинения, внезапно. Хрупкость является отрицательным свойством. Вполне пригодным для изготовления
деталей машин будет не только прочный, но и в определенной мере пластичный металл.
Интересно знать: Испытание строительной арматуры на растяжение
Способность металлов принимать значительную пластическую деформацию в горячем и холодном состоянии широко используется в технике. При этом изменение формы тела осуществляется преимущественно с помощью давящего на металл инструмента. Поэтому полученное
изделие таким способом называют обработкой металлов давлением или пластической обработкой. Обработка металлов давлением представляет собой важный технологический процесс металлургического производства. При этом обеспечивается не только придание
слитку или заготовке необходимой формы и размеров, но совместно с другими видами обработки существенно улучшаются механические и другие свойства металлов.
Прокатка, волочение, прессование, ковка, штамповка представляют собой различные виды обработки металлов давлением в пластическом состоянии. Среди различных методов пластической обработки прокатка занимает особое положение, поскольку данным способом
производят изделия, пригодные для непосредственного (в состоянии поставки) использования в строительстве и машиностроении (шпунт, рельсы, профили сельскохозяйственного машиностроения и пр.).
Физические свойства неметаллов
Неметаллы – химические элементы, атомы которых стремятся принять чужие электроны. Для них характерны атомные и молекулярные кристаллические решетки. Для атомов неметаллов не характерны общие физические свойства. На данный момент существует 22 неметалла.
Для неметаллов характерен ряд свойств:
- хрупкость (неметаллы нельзя ковать);
- отсутствие блеска;
- непроводимость электрического тока и тепла.
Расположение металлов и неметаллов в периодической таблице Д.И. Менделеева
Определить, является простое вещество металлом или неметаллом, можно с помощью периодической таблицы Менделеева. Металлы располагаются ниже диагонали «водород-бор- кремний-мышьяк-теллур-астат», а неметаллы выше.
Красные ячейки – неметаллы, синие – металлы
Элементы, расположенные вблизи диагонали, обладают смешанными свойствами: проявляют как металлические, так и неметаллические свойства. Они называются полуметаллами.
Красные ячейки – полуметаллы
Полуметаллы имеют ковалентную кристаллическую решетку при наличии металлической проводимости (электропроводности). Валентных электронов у них либо недостаточно для образования полноценной ковалентной связи, либо они не удерживаются достаточно прочно из-за больших размеров атома. Поэтому связь в ковалентных кристаллах этих элементов имеет частично металлический характер.
Закономерности в таблице Д.И. Менделеева
Каждый атом состоит из протонов, нейтронов и электронов. Протоны и нейтроны находятся в ядре, который несет положительный заряд. Вокруг ядра движутся отрицательно заряженные электроны. Атомный номер указывает на количество протонов.
Чем больше заряд ядра, тем сильнее к нему притягиваются электроны. Т.о., атому сложнее отдавать электроны. Поэтому в периоде слева направо, с увеличением порядкового номера металлические свойства ослабевают, а неметаллические – усиливаются.
Неметаллы стремятся принять электроны от других атомов. Период в таблице указывает на количество электронных уровней. По мере увеличения числа орбиталей электроны отдаляются от ядра и атому сложнее удерживать электроны на последних уровнях. Т.о., в группе сверху вниз количество орбиталей возрастает, поэтому металлические свойства усиливаются, а неметаллические – уменьшаются.
Биологическая роль металлов и неметаллов
В организмах содержится множество различных металлов и неметаллов. Различных химических элементов в организме может не хватать, поэтому приходится потреблять их извне.Химические элементы можно разделить на две большие группы – макроэлементы и микроэлементы.
К макроэлементам относятся вещества, содержание которых в организме превышает 0,005 %. Эта группа включает водород, углерод, кислород, азот, натрий, магний, фосфор, сера, хлор, калий, кальций.Микроэлементы – элементы, содержание которых не превышает 0,005%. К ним относятся железо, медь, селен, йод, хром, цинк, фтор, марганец, кобальт, молибден, кремний, бром, ванадий, бор. Каждый макро- и микроэлемент в организме выполняет определенную функцию.
Применение металлов[]
Конструкционные материалы
Металлы и их сплавы — один их главных конструкционных материалов современной цивилизации. Это определяется прежде всего их высокой прочностью, однородностью и непроницаемостью для жидкостей и газов. Кроме того, меняя рецептуру сплавов, можно менять их свойства в очень широких пределах.
Электротехнические материалы
Металлы используются как в качестве хороших проводников электричества (медь, алюминий), так и в качестве материалов с повышенным сопротивлением для резисторов и электронагревательных элементов (нихром и т. п.).
Инструментальные материалы
Металлы и их сплавы широко применяются для изготовления инструментов (их рабочей части). В основном это инструментальные стали и твёрдые сплавы. В качестве инструментальных материалов применяются также алмаз, нитрид бора, керамика.
Металлы как ресурсы и применение
Земная кора содержит огромное количество различных металлов, которые играют важную роль в нашей жизни. Одним из самых распространенных металлов в земной коре является калий. Он широко используется в сельском хозяйстве в качестве удобрения для повышения плодородия почвы.
Магний является еще одним важным металлом, находящимся в земной коре. Он используется в различных отраслях промышленности, включая авиацию, автомобильное производство и строительство. Магниевые сплавы обладают легкостью и прочностью, что делает их идеальными для создания легких и прочных конструкций.
Еще одним важным металлом, находящимся в земной коре, является марганец. Он используется в производстве стали, где служит важным компонентом сплавов. Марганцевая сталь обладает высокой прочностью и устойчивостью к износу, поэтому она широко применяется в строительстве, автомобильной и энергетической отраслях.
Железо известно человечеству с древних времен и является одним из самых важных металлов. Оно используется в производстве стали, поэтому это металл-основа промышленности по всему миру. Железо также применяется в производстве различных металлических изделий, машин и оборудования.
Титан, находящийся в земной коре, является легким и прочным металлом. Он широко используется в авиации, космической промышленности и медицине. Титановые сплавы обладают высокой прочностью и устойчивостью к коррозии, что делает их идеальными для создания легких и прочных конструкций, имплантатов и инструментов.
Кальций является не только важным элементом для нашего здоровья, но и одним из самых распространенных металлов в земной коре. Он широко используется в строительстве, производстве цемента, стекла и керамики. Кальций также является необходимым компонентом в производстве железа и стали.
Натрий, находящийся в земной коре, является важным элементом в производстве стекла и щелочей. Он также используется в пищевой промышленности и в реакциях, требующих высокой степени щелочности.
Кремний является одним из самых распространенных элементов в земной коре. Он широко используется в производстве стекла, полупроводников и солнечных батарей. Кремний также является важным компонентом для создания керамики, электродов и литейных форм.
Строительство, энергетика, автомобильная промышленность
В строительстве, энергетике и автомобильной промышленности широко используются различные металлы в производстве и конструкциях. Одним из самых распространенных металлов, которые находят широкое применение, является калий. Калий применяется в строительстве для производства различных материалов, таких как стеклофибробетонные изделия и жидкое стекло, а также для производства гидравлических связующих веществ.
Магний — еще один важный металл, который используется в строительстве, энергетике и автомобильной промышленности. Магний применяется для производства легких сплавов, используемых в автомобильных деталях, а также в производстве алюминиевых литий-магниевых сплавов, которые используются в авиации и ракетостроении.
Титан является одним из самых прочных и легких металлов, поэтому он широко используется в авиации и военной промышленности. Титан также применяется в энергетике для производства теплообменников и турбин, а также в строительстве для производства фасадных систем и каркасов зданий.
Железо — один из самых распространенных металлов, который используется во многих отраслях. Железо применяется в строительстве для производства металлоконструкций, в энергетике для производства трансформаторов и генераторов, а также в автомобильной промышленности для производства кузовных деталей.
Алюминий является одним из самых легких металлов и широко используется в авиации, энергетике и автомобильной промышленности. Алюминий применяется для производства самолетов, электропроводки, а также для производства кузовов автомобилей.
Кремний является основным компонентом стекла и используется в строительстве для производства оконных стекол и зеркал. Кальций применяется в строительстве для изготовления цемента и бетона, а также в энергетике для производства высокоэффективных солнечных батарей.
Марганец используется в автомобильной промышленности для производства аккумуляторных батарей и литий-ионных аккумуляторов. Марганец также применяется в энергетике для производства специальных сплавов, которые используются в производстве электрической энергии.
Свинец
Свинец известен человечеству уже более 6000 лет. Египтяне использовали его для производства косметики, в то время как древнеримляне применяли его для водопроводных труб и аквадуков. Сейчас свинец используется во многих отраслях промышленности, включая производство батарей, строительство, автомобильную промышленность и электронику.
| Свойство | Значение |
|---|---|
| Атомный номер | 82 |
| Атомная масса | 207,2 |
| Плотность | 11,34 г/см³ |
| Температура плавления | 327,5 °C |
| Температура кипения | 1749 °C |
Свинец является токсичным металлом и может накапливаться в организме, вызывая серьезные заболевания. Поэтому использование свинца сегодня регулируется законодательством и строго контролируется.
Однако даже с ограничениями свинец остается важным материалом для многих отраслей промышленности и находит свое применение в различных областях нашей жизни.
2.1. Общие сведения о металлах и сплавах
В ряду материалов, известных с незапамятных времен и повсеместно применяемых во многих сферах человеческой деятельности, металлы всегда занимали особое место. Причина их чрезвычайно высокой популярности легко объяснима: наряду с высокой прочностью
они обладают повышенной тепло- и электропроводностью, пластичностью (ковкостью), особым металлическим блеском (отражательной способностью).
Металлами называются кристаллические вещества с закономерным расположением атомов в узлах пространственной решетки, обладающие непрозрачностью, характерным металлическим блеском и хорошей способностью проводить тепло, электрический ток
и отражать световые лучи. Для металлов характерны также плотная кристаллическая структура, высокая прочность, способность к значительным пластическим деформациям, хорошие литейные свойства, свариваемость .
Бывают чистые металлы и металлические сплавы.
Металлические сплавы – это вещества, образовавшиеся в результате затвердевания жидких расплавов, состоящих из двух или нескольких компонентов. Металлические сплавы могут состоять только из металлов (сплав меди и цинка – латунь) и из металлов
с малым содержанием неметаллов (сплав железа с углеродом – чугун и сталь). Сплавы могут обладать различными физическими, химическими и механическими свойствами путем изменения компонентов и соотношения между ними.
Металлы подразделяются на чёрные и цветные. К чёрным металлам относятся железо и сплавы на его основе. Черные металлы имеют высокую температуру плавления, большую плотность, высокую твердость. К ним относятся железо и сплавы на его основе – сталь
и чугун.
Сталь – это сплав железа с углеродом в количестве 0,02 – 2,14%.
Чугун – это железоуглеродистый сплав с содержанием углерода 2,14 – 6,67%.
Они имеют наибольшее применение в строительстве, так как их стоимость значительно ниже цветных металлов (нежелезных).
Цветные металлы обладают низкой температурой плавления, большой пластичностью, имеют характерную окраску (красную, белую, желтую). К ним относятся медь, цинк, алюминий, никель, олово, свинец, золото, серебро).
Классификация металлов:
- Черные металлы – имеют высокую температуру плавления, большую плотность, высокую твердость. К ним относятся железо и сплавы на его основе – сталь и чугун.
Сталь – это сплав железа с углеродом в количестве 0,02 – 2,14%.
Чугун – это железоуглеродистый сплав с содержанием углерода 2,14 – 6,67%.
Цветные металлы – обладают низкой температурой плавления, большой пластичностью, имеют характерную окраску (красную, белую, желтую). К ним относятся медь, цинк, алюминий, никель, олово, свинец, золото, серебро).
Классификация сплавов:
- по основному компоненту — железные, алюминиевые и т.д.
- по плотности: легкие (магниевые, алюминиевые) с малой плотностью до 5000 кг на м куб.; и тяжелые (на основе вольфрама) с высокой плотностью не менее 15000 кг на м куб.
- по температуре плавления: легкоплавкие (температура плавления до 1539℃ — олово, свинец, цинк, самая низкая температура плавления у ртути 38, 87℃) и тугоплавкие (температура плавления выше 1539℃ — титан, хром, вольфрам).
- по применению:
- антифрикционные;
- коррозионно-стойкие (сплавы на основе железа, меди, алюминия);
- криогенные (сплавы на основе железа, алюминия), характеризуются комплексом тепловых, электрических, механических свойств и предназначены для работы при низких температурах (от -269 до+20);
- магнитные (сплавы, обладающие ферромагнетизмом);
- немагнитные.
Интересно знать: Металлы
Типы кристаллических решеток
Все металлы в твердом состоянии представляют собой кристаллы. Кристалл – это совокупность атомов, расположенных в пространстве не хаотично, а в геометрически правильной последовательности. Пространственное расположение атомов и образует кристаллическую решетку.
В узлах пространственной кристаллической решетки металла правильно расположены положительно заряженные ионы, а между ними перемещаются свободные электроны – электронный газ. Переходя от одного катиона к другому, они осуществляют связь между ионами и превращают кристалл металла в единое целое. Эта связь, называемая металлической, возникает между атомами металлов за счет перекрывания электронных облаков внешних электронов. Металлическая связь отличается от неполярной ковалентной связи своей ненаправленностью. В кристалле металлического типа электроны не закреплены между двумя атомами, а принадлежат всем атомам данного кристалла, т. е. делокализованы. К особенности структуры металлических кристаллов относятся большие координационные числа – 8÷12, которым соответствует высокая плотность упаковки.
Кристаллическая решетка каждого металла состоит из положительно заряженных ионов одинакового размера, расположенных в кристалле по принципу наиболее плотной упаковки шаров одинакового диаметра.
Различают три основных типа упаковки, или кристаллической решетки.
1. Объемноцентрированная кубическая решетка с координационным числом, равным 8 (натрий, калий, барий). Атомы металла расположены в вершинах куба, а один – в центре объема. Плотность упаковки шарообразными ионами в этом случае составляет 68 %.
2. Гранецентрированная кубическая решетка с координационным числом, равным 12 (алюминий, медь, серебро). Атомы металла расположены в вершинах куба и в центре каждой грани. Плотность упаковки – 74 %.
3. Гексагональная решетка с координационным числом 12 (магний, цинк, кадмий). Атомы металла расположены в вершинах и центре шестигранных оснований призмы, а еще три – в ее средней плоскости. Плотность упаковки – 74 %.
Из-за неодинаковой плотности атомов в различных направлениях кристалла наблюдаются разные свойства. Это явление, получившее название анизотропия, характерно для одиночных кристаллов – монокристаллов. Однако большинство металлов в обычных условиях имеют поликристаллическое строение, т. е. состоят из значительного числа кристаллов, или зерен, каждое из которых анизотропно. Разная ориентировка отдельных зерен приводит к усреднению свойств поликристаллического металла.
Особенности кристаллических решеток обусловливают характерные физические свойства металлов.
Химические свойства металлов
Все металлы проявляют восстановительные свойства. Легкость в отдачи внешнего электрона применяется в фотоэлементах. Степень активности определяется рядом активности. У самых активных на внешнем уровне располагается по одному электрону.
Общие химические свойства металлов выражаются в реакциях со следующими соединениями.
С неметаллами
4 Li + O2→ 2 LiO2
3 Mg + N2 → Mg3N2
Активные металлы реагируют с галогенами и кислородом. С азотом взаимодействуют только литий, кальций и магний. Большинство металлов при взаимодействии с кислородом образуют оксиды, а наиболее активные металлы – пероксиды (N2O2).
С оксидами металлов
2 Ca + MnO2 → 2 CaO + Mn(нагревание)
С кислотами
Mg + H2SO4(разб)→MgSO4 + H2
Водород в кислотах вытесняют только те металлы, которые в ряду напряжений стоят до водорода.
С растворами солей
Fe + CuSO4→ Cu + FeSO4
Cu + 2 AgNO3→ 2 Ag + Cu(NO3)2
Более активные металлы вытесняют из соединений менее активные.
Химические свойства щелочных и щелочно-земельных металлов (реакции с водой)
2 Na + 2 H2O → 2 NaOH + H2
Ca + 2 H2O →Ca(OH)2 + H2






























