Биологическое значение белка
Рис. 4. Структура фермента аланинаминотрансферазы
Благодаря своим физическим и химическим свойствам белки выполняют большое количество биологических функций, в перечень которых входят:
- каталитическая (белки-ферменты);
- транспортная (гемоглобин);
- структурная (кератин, эластин);
- сократительная (актин, миозин);
- защитная (иммуноглобулины);
- сигнальная (рецепторные молекулы);
- гормональная (инсулин);
- энергетическая.
Белки важны для организма человека, поскольку участвуют в образовании клеток, обеспечивают сокращение мышц у животных, вместе с сывороткой крови переносят многие химические соединения. Помимо этого, белковые молекулы являются источником незаменимых аминокислот и осуществляют защитную функцию, участвуя в выработке антител и формировании иммунитета.
Функции белков в клетке
Белок в клетке выполняет следующие функции:
- Строительную (называемую также пластической) – одну из наиболее важных функций молекулы белка. Являясь базовым составным компонентом органелл и мембран клеток, белок представляет собой основной «строительный» материал для стенок кровеносных сосудов, хрящей и сухожилий высших животных.
- Двигательную – позволяющую благодаря особым сократительным белкам обеспечивать движения выполняемые ресничками и жгутиками, перемещение хромосом во время клеточного деления, мышечные сокращения, перемещение различных органов растений и т.п., а также изменения пространственного положения разнообразных структур организма.
- Транспортную – обеспечиваемую способностью белков переносить и связывать химические соединения посредством кровотока.
Гемоглобин, являясь белком крови, способен осуществлять перенос кислорода от лёгких к клеткам других тканей и органов (миоглобин в мышцах выполняет сходную функцию).
Находящиеся в сыворотке крови белки осуществляют перенос жирных кислот и липидов, а также разнообразных веществ с биологически активными свойствами.
Белковые молекулы, составляющие плазматическую мембрану, участвуют в транспортировке веществ как во внутрь клетки, так и из неё.
Белкам присуща и защитная функция. Проникновение в клетку чужеродных веществ (вирусов, антигенов – высокомолекулярных полисахаридов или белков бактерий) способствует запуску в ней процесса продуцирования белков особого вида – иммуноглобулинов, по-другому называемых антителами. Они нейтрализуют воздействие чужеродных веществ, обеспечивая тем самым организму иммунологическую защиту.
Характерные участки молекул, являющиеся антигенными детерминантами, осуществляют распознавание антигенов, благодаря чему обеспечивается функционирование системы организма, отвечающей за иммунитет. Так чужеродные вещества специфическим образом связываются и обеззараживаются.
Выполнение функции внешней защиты также могут выполнять белки, обладающие токсичностью по отношению к другим организмам – примером может служить воздействие белка, находящегося в змеином яде.
Ещё одним свойством белков является выполнение ими сигнальной функции, заключающейся в способности молекул белков, встроенных в клеточную мембрану, изменять свою третичную структуру под воздействием внешних факторов. Так осуществляется восприятие клеткой сигналов поступающих от внешней среды и передача в клетку соответствующих команд.
Свойственная белкам-гормонам регуляторная функция оказывает влияние на обмен веществ в организме. Посредством гормонов в крови постоянно поддерживается необходимая концентрация веществ. Они участвуют в процессах размножения, роста и многих других процессах, важных для жизни.
Ярким примером может служить инсулин как наиболее известный гормон, способствующий снижению уровня сахара в крови. Длительный и устойчивый недостаток его в организме приводит к повышению в крови уровня сахара и развитию заболевания, называемого сахарным диабетом. Основными регуляторами протекающих в организме биохимических процессов могут быть разнообразные и многочисленные белки-ферменты, осуществляющие каталитическую функцию.
Помимо всего прочего белки представляют собой энергетический материал. Расщепление до конечных продуктов 1 г белка происходит с выделением 17,6 кДж энергии, требуемой для большого количества клеточных процессов важных для жизни.
Четвертичная структура белка
Последняя, но самая большая! Не пугайтесь, только по размеру. Она есть не у всех белков, некоторые прекрасно работают в виде третичной структуры и не парятся. Но представьте, что мы возьмем несколько третичных структур и как соединим их вместе. Пусть их будет 4 штуки, берем 4 шарика и соединяем их. Получаем четвертичную, но не из-за того, что мы взяли 4 шарика….
Эти шарики комплементарны друг другу в участках связывания — не активный центр, но чем-то похоже. Таких участков связывания много, поэтому ошибиться и не узнать своего товарища очень трудно.
Каждая глобула, которую мы взяли — это отдельная полипептидная цепь. Прочитай это еще раз. До этого все касалось только одной полипептидной цепи, а теперь их несколько. Такая цепь называется мономером (или субъединицей), а при соединении мономеров образуется олигомер. Так что вся большая молекула — это олигомер.
Четвертичная структура белка
Какие связи все это стабилизируют? Чаще всего это водородные, ионные и Ван-дер-Вальсовы, так как каждый мономер прячет свои гидрофобные остатки вглубь молекулы, то они образуются редко. Получается, что четвертичную структуру стабилизируют силы слабого взаимодействия, ковалентных связей здесь почти никогда не бывает — очень редко могут быть дисульфидные. Поэтому можем спокойно забить на них.
В чем отличие четвертичной структуры от третичной? Ну кроме того, что тут объединено несколько полипептидных цепей. А вот какое — у олигомерных белков есть не только активный центр, но и другой — аллостерический центр. К этому замку не подойдут лиганды от активного центра, у него есть свои собственные ключики
Это очень важно, нужно запомнить! Господи, я превращаюсь в препода…
Аллостерические центры в четвертичной структуре
Проведем аналогию с нашим домиком, только теперь их будет несколько. У каждого будет по главному и черному входу! Главный вход — активный центр, а черный ход — это аллостерический центр.
Аллострические центры дают кое-что важное — регуляцию. Маленькая молекула, которая соединится с аллостерическим центром может остановить работу целого огромного белка
Круто? Получается, что размер не важен — не удержался.
Но каким образом одна молекула останавливает работу целого белка? Очень просто — хотел бы я так сказать. Присоединение молекулы к мономеру изменяет его конформацию. А это ведет к тому, что мономер изменяет конформацию других мономеров — происходят конформационные изменения всей структуры белка. В результате этих изменений закрывается активный центр — лиганд не может к нему подойти. У всех этих изменений есть, как и всегда, свое название — кооперативный эффект.
Кооперативный эффект
И опять я про дом, если открыть черный ход, то нельзя открыть главный вход, ну и наоборот. Не всегда регуляция работает в таком ключе: черный ход может, наоборот, открывать парадную дверь. Но сейчас это не суть, главное понять смысол. Кстати, на самом деле чаще одна субъединица несет на себе аллостерический центр, а другая активный. Я решил запихнуть все в одну — думаю, что так будет нагляднее.
Кроме этого, присоединение к активному центру также изменяет конформацию остальных мономеров, что приводит к облегченному присоединению лигандов. Хоть на картинке этого и не видно, но поверьте на слово!
Кооперативный эффект
Давайте заканчивать уже со строением.
Строение
Белки – биополимеры, состоящие из отдельных звеньев – мономеров, которые называются аминокислотами. Аминокислоты состоят из карбоксильной (-СООН), аминной (-NH2) группы и радикала. Аминокислоты в белке связываются между собой с помощью ковалентной пептидной связи, образуя полипептидную цепь. Пептидная связь образуется между карбоксильной и аминогруппой соседних аминокислот.
Обязательные химические элементы аминокислот:
- углерод;
- водород;
- азот;
- кислород.
Рис. 1. Строение белка.
Радикал может включать серу и другие элементы.
В соответствии с возможностью синтезироваться внутри организма выделяют два вида аминокислот:
- заменимые – синтезируются в организме;
- незаменимые – не синтезируются в организме и должны поступать из внешней среды.
Известно около 200 аминокислот. Однако в построении белков участвуют только 20.
Биологическое значение
Б. выполняют многочисл. функции. Обмен веществ (пищеварение, дыхание, выделение и др.) и жизнь клетки в целом неразрывно связаны с активностью ферментов – высокоспецифических катализаторов биохимич. реакций, являющихся Б. Защитные системы высших организмов формируются защитными Б., к которым относятся иммуноглобулины, Б. комплемента, цитокины иммунной системы, Б. системы свёртывания крови (в т. ч. плазмин, тромбин, фибрин). Важную группу составляют регуляторные Б., контролирующие биосинтез Б. и нуклеиновых кислот. К их числу относятся также пептидно-белковые гормоны. Информация о состоянии внешней среды, разл. регуляторные сигналы воспринимаются клеткой с помощью рецепторных Б., располагающихся на наружной поверхности плазматич. мембраны. За передачу сигналов внутрь клетки ответственны Б. сигнальных систем ($\ce{G}$-белки, Б.-эффекторы), которые играют важную роль в передаче нервного возбуждения и в ориентированном движении клетки (хемотаксис). В активном транспорте ионов, липидов, сахаров и аминокислот через биологич. мембраны участвуют транспортные Б., или Б.-переносчики. Среди них, напр., гемоглобин и миоглобин, осуществляющие перенос кислорода. Основу костной и соединит. тканей, шерсти, роговых образований составляют структурные Б. (в т. ч. коллаген, кератин, эластин). Они же формируют клеточный скелет и межклеточный матрикс. Расхождение хромосом при делении клетки, движение жгутиков, работа мышц животных и человека осуществляются по единому механизму при посредстве Б. сократительной системы (актина, миозина, тропомиозина, тубулина и др.). Б. – важнейшая составная часть пищи человека и кормов животных. Особое значение при этом имеют запасные Б. растений и животных (напр., казеин, проламины). Преобразование и утилизация энергии, поступающей в организм с пищей, а также энергии солнечного излучения происходят при участии Б. биоэнергетической системы (напр., родопсина, цитохромов). Среди пептидно-белковых веществ имеются антибиотики (в т. ч. грамицидины, полимиксины, энниатины), токсины и др. биологически активные вещества.
Строение белков
Каждый белок имеет свое специфическое (индивидуальное и постоянное) строение.
Молекулы белков имеют большие размеры, поэтому их называют макромолекулами. Кроме углерода, кислорода, водорода и азота, в состав белков могут входить сера, фосфор и железо.
Белки отличаются друг от друга числом (от ста до нескольких тысяч), составом и последовательностью мономеров. Мономерами белков являются аминокислоты.
Бесконечное разнообразие белков создается за счет различного сочетания всего 20 α-аминокислот. Каждая аминокислота имеет свое название, особое строение и свойства. Их общую формулу можно представить в следующем виде:
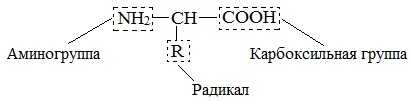
Молекула аминокислоты состоит из двух одинаковых для всех аминокислот частей, одна из которых является аминогруппой (-NH2) с основными свойствами, другая — карбоксильной группой (-COOH) с кислотными свойствами. Часть молекулы, называемая радикалом (R ), у разных аминокислот имеет различное строение.
Наличие в одной молекуле аминокислоты основной и кислотной групп обусловливает их амфотерность и высокую реакционную способность. Через эти группы происходит соединение аминокислот в белки.
В белках α-аминокислоты соединены между собой пептидными (амидными) связями (-NH-CO-) в пептидные цепи. Образование пептидных связей происходит в результате взаимодействия карбоксила одной аминокислоты с аминогруппой другой.
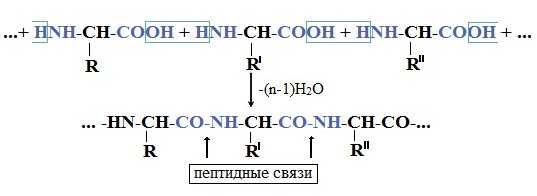
Образование белковой макромолекулы можно представить как реакцию поликонденсации α-аминокислот. При взаимодействии двух молекул a-аминокислот образуется дипептид и выделяется молекула воды.
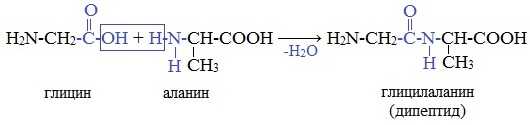
В искусственных условиях (вне организма) две различных аминокислоты могут образовать 4 изомерных дипептида. Например, из глицила и аланина можно получить дипептиды: глицилаланин, аланилглицин, аланилаланин, глицилглицин.
У образовавшегося дипептида на концах молекулы остаются те же функциональные группы, что и в каждой аминокислоте, — карбоксил и аминогруппа. Поэтому дипептид может реагировать с третьей аминокислотой, образуя трипептид.
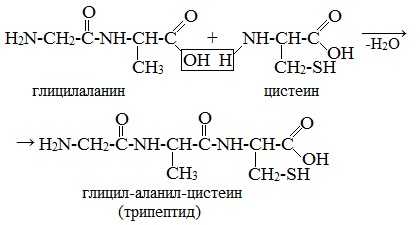
Аналогично происходит образование тетра- , пента- и полипептидов.
Все белки являются полипептидами, но не всякий полипептид является белком. Некоторые белки состоят из нескольких полипептидных цепей.
В составе большинства белков находится в среднем 300-500 остатков аминокислот.
Условно считают, что к белкам относятся полипептиды, содержащие в полипептидной цепи более 100 аминокислотных остатков. Соединения с меньшим числом аминокислотных остатков называются пептидами.
Макромолекулы белков имеют стеререгулярное строение, исключительно важное для проявления ими определенных биологических свойств
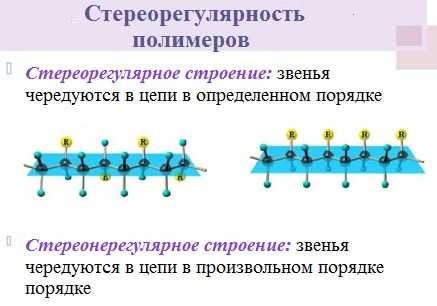
Рубрики: Белки
Синтез
Биосинтез белков происходит в цитоплазме клетки на рибосомах. Это сложный процесс, состоящий из трех стадий:
- транскрипция – образование на участке ДНК информационной (матричной) РНК с информацией о последовательности аминокислот в белковой молекуле;
- трансляция – синтез на основе матричной РНК полипептидной цепи из аминокислот;
- модификация белка.
Синтез полипептидной цепи происходит на рибосоме с помощью матричной и транспортной РНК. Матричная РНК содержит информацию о последовательности аминокислот в белковой молекуле. Транспортные РНК доставляют на рибосому аминокислоты и осуществляют сверку их с информацией на матричной РНК. Этот процесс называется трансляцией. Модификация белка включает «работу над ошибками».
ТОП-2 статьи
которые читают вместе с этой
Рис. 2. Синтез белка.
структура белка
До этого мы разбирали вторичные структуры изолированно, но представьте себе очень длинную полипептидную цепь. Не может же она вся закручиваться в альфа-спираль или становиться бета-складчатой. Хотя иногда и может, но об этом позднее. Чаще всего белок — это комбинация из альфа-спиралей, бета-тяжей и беспорядочных клубков. То есть может это выглядеть примерно вот-так.
Супервторичная структура белка
Поймите, что супервторичная структура белка не стоит выше, чем вторичная. Это просто название, которое неправильно отражает суть, поэтому оно мне не нравится. На западе используют другое название — структурные мотивы, оно намного лучше. Вот в чем его суть: хоть у нас огромное количество самых разных белков, но в них есть определенные повторяющиеся паттерны — это и есть мотивы. Наиболее частые из них: бета-тяж + альфа-спираль + бета-тяж (бета-альфа-бета петля); альфа-спираль + бета-поворот + альфа-спираль; бета-бочонок.
Структурные мотивы
Мотивов очень много, но думаю смысл понятен. Простые мотивы могут объединяться и образовывать мотивы посложнее.
Я использовал в иллюстрациях прошлые картинки, но помните, что эти альфа-спирали и бета-тяжи отличаются друг от друга аминокислотными остатками — они очень разные! Просто перерисовывать все это не хочется.
Классификация белков
Существует несколько критериев, по которым можно классифицировать белковые соединения. По составу различают простые и сложные белки. Сложные белковые вещества содержат в своем составе неаминокислотные группы, химическая природа которых может быть различной. В зависимости от этого выделяют:
- гликопротеины;
- липопротеины;
- нуклеопротеины;
- металлопротеиды;
- фосфопротеины;
- хромопротеиды.
Также существует классификация по общему типу строения:
- фибриллярные;
- глобулярные;
- мембранные.
Протеинами называют простые (однокомпонентные) белки, состоящие лишь из остатков аминокислот. В зависимости от растворимости они делятся на следующие группы:
| Название протеина | Растворимость | Примеры |
| Проламины |
Слабо растворимы в воде, хорошо – в 70-80% этаноле. Содержат большое количество аргинина. |
Белки характерны для семян злаков (гордеин содержится в ячмене, зеин – в кукурузе). |
| Гистоны | Растворяются в слабой соляной кислоте. | Присутствуют в составе хроматина, из которого состоят хромосомы. |
| Склеропротеины (протеноиды) |
Не растворяются в воде, солевых жидкостях, разбавленных кислотах и щелочах. |
Содержатся в опорных тканях (костях, волосах, хрящах, сухожилиях). Включают много пролина, аланина, глицина. |
| Альбумины | Растворяются в воде и растворах солей. | Лактоальбумин – молочный белок, сероальбумин –сыворотки крови. |
| Глобулины | Хорошо растворяются растворах солей слабой концентрации. | Входят в состав бобовых и масленичных растений (фазеолин – семена фасоли, легумин – семена гороха и др.). |
| Протамины | Растворяются в кислотах. | В немалом количестве находятся в половых клетках человека и животных. Например, в сперме рыб (сальмин – семейство лососевых). |
| Глютелины | Растворимы в щелочах. | Содержатся в растениях: плодах и зеленых частях. Глиадин зерновки пшеницы вместе с глютенином образует клейковину, за счет которой тесто становится эластичным. |
Подобная классификация не совсем точна, ведь согласно последним исследованиям многие простые белки связаны с минимальным количеством небелковых соединений. Так, в состав некоторых протеинов входят пигменты, углеводы, иногда липиды, что делает их больше похожими на сложные белковые молекулы.
Ферменты
Стоит сказать кратко о каталитической функции белков. Ферменты или энзимы выделяют в особую группу белков. Они осуществляют катализ – ускорение протекания химической реакции.В соответствии со строением ферменты могут быть:
- простыми – содержат только аминокислотные остатки;
- сложными – помимо белкового остатка включают небелковые структуры, которые называются кофактором (витамины, катионы, анионы).
Молекулы ферментов имеют активную часть (активный центр), связывающую белок с веществом – субстратом. Каждый фермент «узнаёт» определённый субстрат и связывается именно с ним как “ключ с замком”. Активный центр обычно представляет собой «карман», в который попадает субстрат.
Связывание активного центра и субстрата описывается моделью индуцированного соответствия (модель «рука-перчатка»). Модель показывает, что фермент «подстраивается» под субстрат. Благодаря изменению структуры снижается энергия активации реакции.
Рис. 3. Модель «рука-перчатка».
Активность ферментов зависит от нескольких факторов:
- температуры;
- концентрации фермента и субстрата;
- кислотности.
Различают 6 классов ферментов, каждый из которых взаимодействует с определёнными веществами. Например, трансферазы переносят фосфатную группу от одного вещества к другому.
Ферменты могут ускорять реакцию в 1000 раз.
Что мы узнали?
Выяснили, какие функции выполняют белки в клетке, как они устроены и как синтезируются. Белки представляют собой полимерные цепочки, состоящие из аминокислот. Всего известно 200 аминокислот, но белки могут образовывать только 20. Белковые полимеры синтезируются на рибосомах. Белки выполняют важные функции в организме: переносят вещества, ускоряют биохимические реакции, регулируют процессы, происходящие в организме.
-
/10
Вопрос 1 из 10
ТОП-10 малоизвестных фактов о белке
Интересный факт! Первый белок выделили из муки
- Белки начали изучать с 1728 года, именно тогда итальянец Якопо Бартоломео Беккари выделил белок из муки.
- Сейчас широкое распространение получили рекомбинантные белки. Их синтезируют путем модификации генома бактерий. В частности, таким способом получают инсулин, факторы роста и другие белковые соединения, которые используют в медицине.
- У антарктических рыб были обнаружены белковые молекулы, предотвращающие замерзание крови.
- Белок резилин отличается идеальной эластичностью и является основой мест крепления крыльев насекомых.
- В организме есть уникальные белки шапероны, которые способны восстанавливать корректную нативную третичную или четвертичную структуру других белковых соединений.
- В ядре клетки присутствуют гистоны – белки, которые принимают участие в компактизации хроматина.
- Молекулярную природу антител – особых защитных белков (иммуноглобулинов) – начали активно изучать с 1937 года. Тиселиус и Кабат применяли электрофорез и доказали, что у иммунизированных животных увеличена гамма-фракция, а после абсорбции сыворотки провоцирующим антигеном, распределение белков по фракциям возвращалось к картине интактного животного.
- Яичный белок – яркий пример реализации белковыми молекулами резервной функции.
- В молекуле коллагена каждый третий аминокислотный остаток образован глицином.
- В составе гликопротеинов 15-20% составляют углеводы, а в составе протеогликанов их доля – 80-85%.
Определение, состав и строение белка
Белки являются биополимерами, мономерами которых являются остатки альфа-аминокислот, соединенные между собой посредством пептидных связей. Аминокислотная последовательность каждого белка строго определена, в живых организмах она зашифрована посредством генетического кода, на основе считывания которого и происходит биосинтез белковых молекул. В построении белков участвует 20 аминокислот.
Рис. 1. Схема образования молекулы белка (дипептида).
Различают следующие виды структуры белковых молекул:
- Первичная. Представляет собой аминокислотную последовательность в линейной цепи.
- Вторичная. Это более компактная укладка полипептидных цепей при помощи формирования водородных связей между пептидными группами. Есть два варианта вторичной структуры – альфа-спираль и бета-складчатость.
- Третичная. Представляет собой укладку полипептидной цепочки в глобулу. При этом формируются водородные, дисульфидные связи, также стабилизация молекулы реализуется благодаря гидрофобным и ионным взаимодействиям аминокислотных остатков.
- Четвертичная. Белок состоит из нескольких полипептидных цепей, которые взаимодействуют между собой посредством нековалентных связей.
Таким образом, соединенные в определенной последовательности аминокислоты образуют полипептидную цепь, отдельные части которой сворачиваются в спираль или формируют складки. Такие элементы вторичной структур образуют глобулы, формируя третичную структуру белка. Отдельные глобулы взаимодействуют между собой, образуя сложные белковые комплексы с четвертичной структурой.
Рис. 2. Структурная организация белков.
Первичная структура белка
Представляем себе огромную цепь, которая состоит из кучи звеньев. Такой же вид у первичной структуры белка — это просто полипептидная цепь, которая включает в себя аминокислоты. Их всего 20 штук. Но представьте себе сколько комбинаций можно сделать с этими 20 аминокислотами, соединяя их в разных последовательностях? Правильно, бесконечное множество.
Теперь посмотрим на молекулу поближе. Можно увидеть, что у этой большой молекулы есть свободная аминогруппа — N-конец, и свободная карбоксильная группа — C-конец. Молекулу всегда рисуют с N-конца и заканчивают C-концом.
Первичная структура белка
Все остальные аминокислоты связаны друг с другом связью. Сумма всех пептидных связей — это пептидный остов. В него не входят радикалы, N-концы и C-концы. Будет понятнее, если я нарисую всё в одну линию.
Пептидный остов в первичной структуре
Важный момент! Первичная структура определяет какими будет вторичная, третичная и четвертичная (если такая есть) структуры. Это как мини-ДНК для белковой молекулы. Но я об этом еще напомню, даже несколько раз, вот такая я зануда.
Функции
Биологические функции белков представлены в таблице.
|
Функция |
Описание |
Примеры |
|
Транспортная |
Переносят вещества (малые молекулы) через клеточную мембрану, а также участвуют в их транспорте кровью и другими жидкостями по организму. |
Гемоглобин переносит кислород и углекислый газ, транскортин – транспортные белки, встроенные в мембраны клеток, участвуют в поступлении в клетку глюкозы, аминокислот. |
|
Двигательная |
Обеспечивают сокращение мышечных клеток многоклеточных животных, участвуют в движении жгутиков и ресничек |
Актин, миозин |
|
Структурная (строительная) |
Участвуют в образовании цитоскелета, органоидов клетки, межклеточного вещества. Обеспечивают прочность тканей и клеточных структур. |
Коллаген и эластин в хрящевой ткани, кератин волос и ногтей |
|
Сигнальная |
Передают информацию между клетками, тканями, органами |
Цитокины |
|
Ферментативная или каталитическая |
Большинство ферментов в живых организмах имеют белковое происхождение. Они являются катализаторами, ускоряя биохимические реакции |
Пепсин, каталаза, рибонуклеаза |
|
Регуляторная или гормональная |
Гормоны белкового происхождения контролируют и регулируют процессы метаболизма |
Инсулин, тиротропин |
|
Генно-регуляторная |
Регулируют функции нуклеиновых кислот при переносе генетической информации |
Гистоны регулируют репликацию и транскрипцию ДНК |
|
Энергетическая |
Используется как дополнительный источник энергии. При распаде 1 г высвобождается 17,6 кДж |
В качестве источника энергии белки используются организмом после углеводов и липидов. |
|
Защитная |
Специфичные белки – антитела – предохраняют организм, уничтожая чужеродные частицы. Особые белки участвуют в свертывании крови, останавливая кровотечения |
Иммуноглобулины, фибриноген, тромбин |
|
Запасающая |
Запасаются для питания клеток. Удерживают необходимые организму вещества |
Ферритин удерживает железо, казеин, глютен, альбумин запасаются в организме |
|
Рецепторная |
Удерживают различные регуляторы (гормоны, медиаторы) на поверхности или внутри клетки |
Глюкагоновый рецептор, протеинкиназа |
Белки могут оказывать отравляющее и обезвреживающее действие. Например, палочка ботулизма выделяет токсин белкового происхождения, а белок альбумин связывает тяжёлые металлы.






























