Примеры химических реакций с серой
Восстановитель
При реакции известкового камня с серой образуется сернистый ангидрид и гашеная известь:
- CaO + SO2 → CaSO3
- Ca(OH)2 + SO2 → CaSO3 + 2H2O
Также, при взаимодействии серы с хлоридами металлов, сера восстанавливается, а металл окисляется:
2FeCl3 + S → 2FeCl2 + SO2 + Cl2
Окислитель
Сера может действовать как окислитель в реакциях с некоторыми металлами:
- Ag + S → Ag2S
- 2Na + S → Na2S
Также, сера может окисляться при взаимодействии с кислородом:
2S + 3O2 → 2SO3
| Реакция | Окислительность серы |
|---|---|
| CaO + SO2 → CaSO3 | Восстановитель |
| 2FeCl3 + S → 2FeCl2 + SO2 + Cl2 | Восстановитель |
| Ag + S → Ag2S | Окислитель |
| 2S + 3O2 → 2SO3 | Окислитель |
Индивидуальные доказательства
- Winnacker-Küchler: Химическая технология: процессы и продукты. Том 3: Основные неорганические материалы, промежуточные продукты. Wiley-VCH Verlag GmbH & Co. KGaA, 2005. ISBN 3-527-30768-0 .
- Hardison, LC; Рэмшоу, Германия: H 2 S к S: Улучшение процесса. Обработка углеводородов, Том 71, январь 1992 г., стр. 89-90.
- Пьер-Ив Ле Стра, Матильда Кот, Жан-Пьер Баллаге, Жан-Луи Амброзино, Кристиан Штрайхер, Жан-Поль Кузен: новый окислительно-восстановительный процесс, успешный в газовых потоках высокого давления . В кн . : Нефтегазовый журнал
- Коль, А .; Нильсен, Р .: Очистка газов. Gulf Pub Co, 1997. ISBN 0-88415-220-0 .
- Рейнский нефтеперерабатывающий завод Shell Deutschland Oil GmbH.
- Нефтеперерабатывающие заводы BP Gelsenkirchen .
Месторождения серы
Сера встречается на Земле в различных формах. Хотя большая часть серы содержится в угле (около 80%), большая часть серы получается при десульфуризации природного газа и нефти .
В основном сжигается уголь, при этом сера окисляется до SO 2 . Для защиты окружающей среды используются процессы десульфуризации дымовых газов , при которых сера превращается в гипс . Переход на элементарную серу обычно экономически невыгоден.
Природные газы с низким содержанием серы очищаются от сероводорода (H 2 S) с помощью оксида цинка (ZnO) , при этом элементарная сера не образуется, а оксид цинка превращается в сульфид цинка (ZnS).
Только H 2 S, образующийся в процессе газификации угля, превращается в элементарную серу путем извлечения серы. В противном случае около 97% серы поступает из природного газа и нефти.
Существующие установки
В настоящее время основными производителями серы являются газоперерабатывающие заводы (ГПЗ), нефтеперерабатывающие заводы (НПЗ) и нефтегазохимические комплексы (НГХК). Сера на этих предприятиях производится из кислых газов, образующихся при аминовой очистке высокосернистого углеводородного сырья. Подавляющее количество газовой серы выпускается по известному методу Клауса.
 Установка производства серы. Орский НПЗ
Установка производства серы. Орский НПЗ
Из данных, представленных в табл.1–3, видно, какие виды товарной серы выпускают сегодня российские предприятия, производящие серу.
Таблица 1 – Нефтеперерабатывающие заводы России, производящие серу
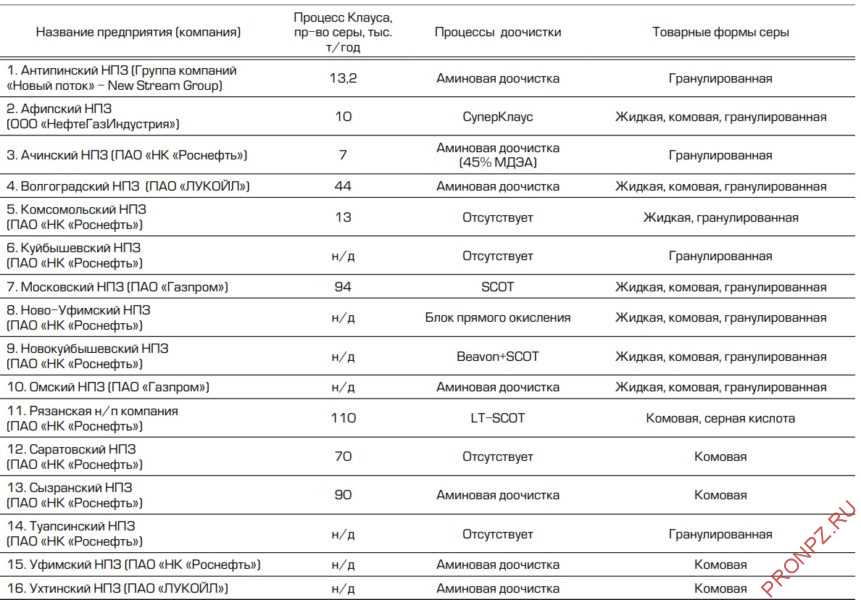
Таблица 2 – Нефтегазохимические комплексы России, производящие серу
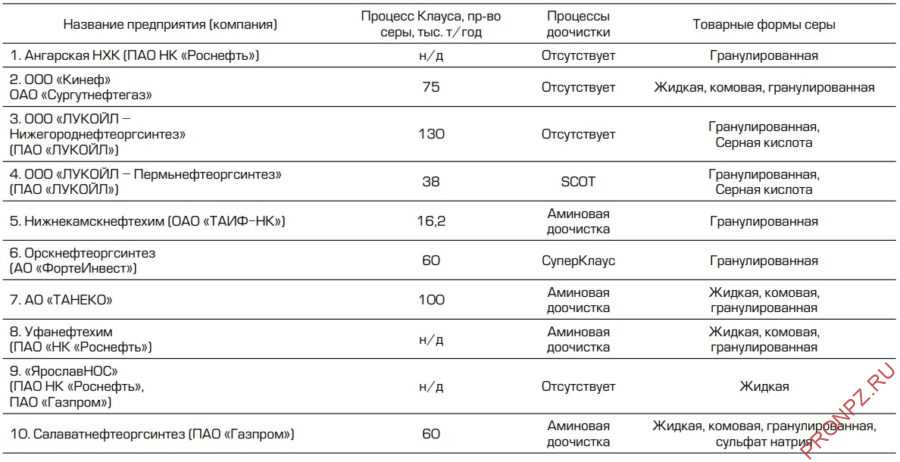
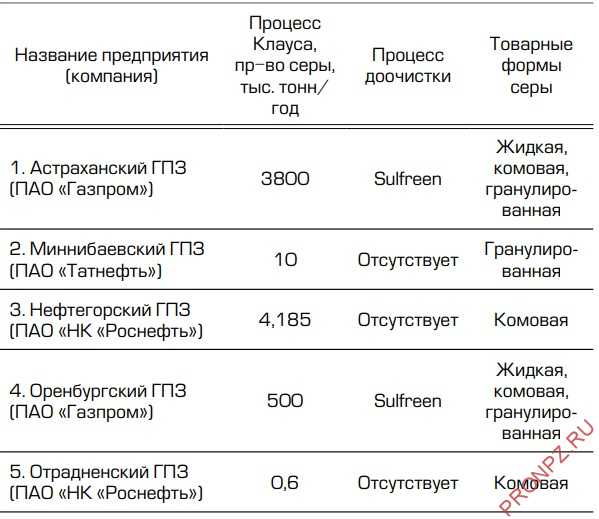
Таблица 3 – Газоперерабатывающие заводы России, производящие серу
Строение атома и свойства серы
Сера — элемент шестой группы третьего периода периодической системы Менделеева. Поэтому строение атома серы изображается так:
Строение атома серы указывает на то, что это неметалл, т. е. атом серы способен и к приёму электронов и к отдаче электронов:
Задание 15.1. Составить формулы соединений серы, содержащие атомы серы с данными степенями окисления.
Простое вещество «сера» — твёрдый хрупкий минерал жёлтого цвета, нерастворимый в воде. В природе встречается как самородная сера, так и её соединения: сульфиды, сульфаты. Сера как активный неметалл легко реагирует с водородом, кислородом, почти со всеми металлами и неметаллами:
Задание 15.2. Назовите полученные соединения. Определите, какие свойства (окислителя или восстановителя) проявляет сера в этих реакциях.
Как типичный неметалл простое вещество сера может быть и окислителем, и восстановителем:
Иногда эти свойства проявляются в одной реакции:
Поскольку атом-окислитель и атом-восстановитель одинаковые, их можно «сложить», т. е. на оба процесса нужно три атома серы.
Задание 15.3. Расставьте остальные коэффициенты в этом уравнении.
Сера может реагировать с кислотами — сильными окислителями:
Таким образом, являясь активным неметаллом, сера образует множество соединений. Рассмотрим свойства сероводорода, оксидов серы и их производных.
Окисление и восстановление серы
Сера — это элемент, который играет важную роль в различных химических процессах. Сера может выступать как восстановителем, так и окислителем, что зависит от в условий реакции.
Окисление серы — это реакция, в которой серный соединение теряет электроны, которые переходят на другие элементы. Например, при сжигании серы при высокой температуре, она окисляется до сернистого ангидрида:
S + O2 → SO2
Восстановление серы — это процесс, в котором серный соединение получает электроны. Например, при выделении серы из серной кислоты металлом, таким как железо:
Fe + H2SO4 → FeSO4 + H2
Таким образом, сера может как окисляться, так и восстанавливаться в химических реакциях, что делает ее важным компонентом в многих процессах.
Дегазация серы
Сера, полученная на установке по извлечению серы, все еще содержит большую долю связанного H 2 S. Существует множество способов удаления этого H 2 S. Поскольку большая часть H 2 S связана физически (а не химически), H 2 S можно удалить, перемещая жидкую серу с помощью продувочного воздуха .
В процессе дегазации серы Shell воздух вводится непосредственно в серу через две или три колонны пузырьков . Процесс SNEA Aquisulf работает с помощью распылителя, при котором сера сначала распыляется через мелкие форсунки, а затем почти полностью дегазируется с помощью катализатора. Процесс дегазации серы Exxon работает исключительно с катализатором, который помещается непосредственно в резервуар для хранения серы. Общим для всех процессов дегазации серы является то, что они снижают концентрацию H 2 S в жидкой сере до уровня ниже 10 мг / м³.
Сероводород
H2S — сероводород, сильно ядовитый газ с противным запахом тухлых яиц. Правильнее сказать, белки яиц при гниении разлагаются, выделяя сероводород.
Задание 15.4. Исходя из степени окисления атома серы в сероводороде, предcкажите, какие свойства будет проявлять этот атом в окислительно-восстановительных реакциях.
Поскольку сероводород — восстановитель (атом серы имеет низшую степень окисления), он легко окисляется. Кислород воздуха окисляет сероводород даже при комнатной температуре:
Сероводород горит:
Сероводород немного растворим в воде, причём его раствор проявляет свойства очень слабой кислоты (сероводородной H2S). Она образует соли сульфиды:
Вопрос. Как, имея сульфид, получить сероводород?
Сероводород в лабораториях получают, действуя на сульфиды более сильными (чем H2S) кислотами, например:
Назначение
Установки производства серы преобразуют H2S, содержащийся в потоках кислых газов из установок регенерации аминов и установок нейтрализации сернисто-щелочных стоков, в жидкую серу. Обычно двух или трехступенчатый процесс Клауса восстанавливает более 92% H2S в виде элементарной серы.
Большинство нефтеперерабатывающих заводов требуют извлечения серы более чем на 98,5%, поэтому третья ступень Клауса работает ниже точки росы серы. Третья ступень может содержать катализатор селективного окисления, иначе в состав установки производства серы необходимо предусматривать установку дожигания хвостовых газов. Становится все более популярным дегазировать полученную расплавленную серу. Крупные компании предлагают запатентованные процессы, которые дегазируют расплавленную серу до 10-20 мас. ppm H2S.

Ссылки
- Шнуг, Э. (1998), Сера в агроэкосистемах. Университетские издательства Kluwer, Dordrecht, стр. 221.
- Гриль Д., Таус М. и Де Кок Л. Дж. (2001), Значение глутатиона для адаптации растений к окружающей среде, Дордрехт.
- Аброл Ю.П. и Ахмад А. (2003), Сера в растениях. Издательство Kluwer University Publishers, Дордрехт.
- Сайто К., Де Кок Л.Дж., Стулен И., Хоуксфорд М.Дж., Шнуг Э., Сирко А. и Ренненберг Х. (2005), Транспорт и поглощение серы растениями в постгеномном периоде. эпоха. Издательство Backhuys, Лейден.
- Хоуксфорд, М.Дж., Де Кок, Л.Дж. (2006), Управление метаболизмом серы в растениях. Клетки растений и окружающая среда 29: 382-395.
Сравнение роли серы в реакциях
Восстановительная роль серы
Сера может выступать в качестве восстановителя в реакциях. В частности, присутствие серы позволяет восстановить железо из оксида железа(III). Также, сера может восстановить медь, выделяя элементарный металл из его солей.
В некоторых биохимических процессах, сера участвует в выработке электронов, участвующих в окислительно-восстановительных реакциях.
Окислительная роль серы
Алкил-арилсульфонаты — соединения серы — являются окислителями в электрохимических процессах. Также, сера может участвовать в окислительных реакциях в присутствии кислорода, как, например, при окислении серосодержащих газов при производстве серной кислоты.
В свою очередь, в случае окисления серы, некоторые органические соединения могут служить в качестве восстановителей.
Общие выводы
- Роль серы в химических реакциях может быть как восстановительной, так и окислительной;
- В некоторых случаях сера может участвовать и в тех, и в других ролях;
- Реакции, в которых сера выступает в качестве восстановителя или окислителя, обычно сопровождаются изменением ее окислительного состояния.
Восстановление сульфатов в растениях
Несмотря на то, что корневые пластиды содержат все ферменты , восстанавливающие сульфат, восстановление сульфата в основном происходит в хлоропластах листьев. Восстановление сульфата до сульфида происходит в три стадии. Сульфат необходимо активировать до аденозин-5′-фосфосульфата (APS), прежде чем он превратится в сульфит .
Активация сульфата катализируется АТФ- сульфурилазой, которая имеет довольно низкое сродство к сульфату (Km примерно 1 мМ), и концентрация сульфата in situ в хлоропласте, скорее всего, является одной из ограничивающих / регулирующих стадий восстановления серы. Впоследствии APS восстанавливается до сульфита, катализируемого APS-редуктазой, возможно, с глутатионом в качестве восстанавливающего агента .
Эта последняя реакция, как полагают, является одним из основных пунктов регуляции восстановления сульфата, поскольку активность APS-редуктазы является самым слабым из ферментов в пути восстановления сульфата и имеет быструю скорость оборота. Сульфит имеет высокое сродство, восстанавливаемое сульфитредуктазой к сульфиду с ферредоксином в качестве восстановителя. Сульфат, оставшийся в растительной ткани, переносится в вакуоль . Ремобилизация и перераспределение запасов вакуолярного сульфата, по-видимому, происходит довольно медленно, и растения с дефицитом серы могут все еще содержать определяемые уровни сульфата.
Достоинства и недостатки
Достоинства
- Простота технологического оформления установки.
- Удаление H2S из газов сжигания, что позволяет соблюдать экологические стандарты предприятия.
 Коррозия трубопровода на установке производства серы
Коррозия трубопровода на установке производства серы
Недостатки
- Непреднамеренная конденсация и накопление серы может привести к таким проблемам, как затруднение прохода потока технологического газа, закупорка твердой серой, пожар и повреждение оборудования.
- Превышение предложения серы на рынке над ее спросом.
- Коррозия и загрязнение оборудования вследствие присутствия аммиака, H2S, CO2 возможного образования серной кислоты.
Поглощение сульфатов растениями
Сульфат всасывается корнями, имеющими сильное сродство. Максимальная скорость поглощения сульфата обычно достигается уже при уровне сульфата 0,1 мМ и ниже. Поглощение сульфата корнями и его транспортировка к побегам строго контролируются и, по-видимому, являются одним из основных регулирующих участков поглощения серы.
Сульфат активно всасываются через плазматическую мембрану клеток корней , а затем загружают в сосуды в ксилеме и транспортируются к всходу текущим потоотделения . Поглощение и транспорт сульфата зависят от энергии (управляемой протонным градиентом, генерируемым АТФазами ) посредством совместного транспорта протона / сульфата. В побегах сульфат высвобождается и транспортируется в хлоропласты, где восстанавливается. Сульфат, остающийся в растительной ткани, в основном присутствует в вакуоли , так как концентрация сульфата в цитоплазме поддерживается довольно постоянной.
Определенные белки транспорта сульфата опосредуют захват, транспорт и субклеточное распределение сульфата. На основании экспрессии их клеточных и субклеточных генов и возможной функции семейство генов- переносчиков сульфатов подразделяется на 5 различных групп. Некоторые группы выражаются исключительно в корнях или побегах или выражаются как в корнях, так и в побегах.
- Группа 1 включает «переносчики сульфата с высоким сродством», которые участвуют в поглощении сульфата корнями.
- Группа 2 — это сосудистые переносчики и «переносчики сульфатов с низким сродством».
- Группа 3 — это так называемая «группа листьев», однако о характеристиках этой группы еще мало что известно.
- Транспортеры группы 4 участвуют в оттоке сульфата из вакуолей , в то время как функция транспортеров сульфата группы 5 еще не известна и, вероятно, функционирует только как переносчики молибдата.
Регуляция и экспрессия большинства переносчиков сульфатов контролируются содержанием серы в питательных веществах растений. Во время сульфатной депривации быстрое уменьшение содержания сульфата в корнях постоянно сопровождается значительным улучшением экспрессии большинства генов-переносчиков сульфатов (до 100 раз), что сопровождается значительным улучшением способности захвата сульфата. Природа этих переносчиков еще полностью не выяснена, будь то сам сульфат или продукты метаболизма поглощения серы ( O-ацетилсерин , цистеин , глутатион ), действуют как сигналы в регуляции поглощения сульфата корнем и его транспорта в в побеге и в экспрессии задействованных переносчиков сульфатов.
Серный ангидрид и серная кислота
Серный ангидрид SO3 — бесцветная жидкость, бурно реагирующая с водой:
Серная кислота H2SO4 — сильная кислота, которая в концентрированном виде активно поглощает влагу из воздуха (это свойство применяется при осушении различных газов) и из некоторых сложных веществ:
Кроме того, концентрированная серная кислота, являясь сильным окислителем, окисляет углерод:
Поэтому, попадая на кожу, концентрированная серная кислота вызывает тяжёлые ожоги, а попадая на ткани, бумагу и другие вещества, обугливает их.
Являясь окислителем (+6 — высшая степень окисления для серы!), концентрированная серная кислота реагирует почти со всеми металлами (кроме железа и благородных металлов) без выделения водорода:
Задание 15.7. Уравняйте эти схемы методом электронного баланса. Укажите, какой атом является окислителем в каждом случае.
Но разбавленная серная кислота и её соли — сульфаты — окислительных свойств (за счёт атома серы) практически не проявляют:
Задание 15.8. Определите, какой атом является окислителем в данной реакции.
Растворы серной кислоты проявляют все свойства сильных кислот.
Задание 15.9. Составьте уравнения реакций, отражающие эти свойства. (При затруднении см. урок 2.2.)
Качественной реакцией на SO42– является образование белого осадка BaSO4, нерастворимого в кислотах:
Серная кислота имеет разнообразное применение: её используют при получении стиральных порошков, лекарств, красителей, удобрений и других необходимых веществ.
Слайды и текст этой презентации
диспропорционирования тиосульфата:S2O32- + H20 → SO42- + HS- + H+Go
= – 21,9 кДж/моль S2O32-Суммарная реакция диспропорционирования сульфита:4SO32- + H+ → 3SO42- + HS-Go = – 58,9 кДж/ моль SO32-
из реакций неорганических соединений серы: S2- → nS2- → S0
→ S2O32- → SO32- → SO42-, так и включать реакции органических форм. Атом серы органических сульфидов обычно окисляется после отделения в виде S2 – по неорганическому пути, хотя возможен и чисто органический путь окисления, когда атом серы окисляется, находясь в составе органических соединений, например цистеин → цистин. Большинство реакций окисления серных соединений может протекать без участия микроорганизмов в присутствии сильных окислителей (H2O2, O3, кислородные радикалы), однако микробное окисление гораздо более эффективно, особенно при низких концентрациях реагента.
Слайд 8Бесцветные серобактерии
По морфологии, характеру движения, способу размножения и строению клеток
Thiothrix, Thiospirillopsis, Thioploca, Achromatium) проявляют большое сходство с синезелеными водорослями. Некоторые исследователи, в частности Прингсхейм (Pringsheim, 1963), рассматривают эти микроорганизмы как бесцветные их варианты. Аналогом Beggiatoa считают сине-зеленую водоросль Oscillatoria, Thiothrix – Rivularia, Thiospirillopsis – Spirulina, a Achromatium похож на Synechococcus.
Слайд 9Большинство так называемых тионовых бактерий – типичные хемоавтотрофы, т.е. они
используют восстановленные соединения серы не только как Н-доноры, но и
в качестве источников энергии и способны расти на чисто минеральных средах, ассимилируя углекислоту. Такие бактерии были впервые выделены из воды Неаполитанского залива (Натансон, 1902) и получили название Thiobacillus (Бейеринк, 1904). К настоящему времени описано много видов автотрофных тиобацилл, выделенных из разных водоемов, почвы, а также из месторождений серы и разных металлов.
Слайд 10К первой группе относятся такие виды, как: Т. thioparus, Т.
denitrificans, Т. novellus, Т. thiocyanoxidans, Т. neapolitanus. Для этих микроорганизмов
оптимальное значение рН приходится на область 6,0–9,0, а зона значений рН, при которых возможен их рост, – от 3,0–6,0 до 10,0–11,0, причем для разных видов и штаммов оптимальные значения рН и. область активной кислотности, в которой наблюдается их рост, могут заметно различаться.Ко второй группе принадлежат Т. thiooxidans, Т. ferroxidans, Т. intermedius. Для этих микроорганизмов оптимальное значение рН 2,0–4,0, а рост возможен при рН от 0,5–2,0 до 5,0–7,0. Наиболее ацидофильными организмами являются два первых вида. Обе эти бактерии растут при значениях рН не более 5,0. В то же время показано, что Т. thiooxidans сохраняет жизнеспособность при значении рН, близком к 0, что соответствует 1,0 н. раствору серной кислоты. Это, пожалуй, самый ацидофильный микроорганизм, который известен исследователям.
различных ее соединений является сульфат. Если процесс идет таким образом,
т.е. происходит полное окисление исходного субстрата, то результаты его отражают следующие уравнения. При окислении сероводорода:
Слайд 15Цикл соединений железа Хлеб ржаной 2.0-2.6 пшеничный
0.9-2.8 Крупа гречневая
8.0 овсяная 3.9 Рис 1.8 Горох 9.4 Фасоль 12.4 Мясо (говядина) 2.6-2.8Печень (говяжья) 9.8 Язык (говяжий) 5.0 Судак 0.4 Молоко коровье 0.1 Масло сливочное 0.2 Картофель 0.9 Творог 0.4 Соль поваренная 10.0 Шоколад 2.7 Лимоны 0.6 Апельсины 0.3 Яблоки 2.2 Земляника 1.2 Редис 1.0 Помидоры 0.5-1.4 Морковь 1.2-1.4
ПРОДУКТЫ и СОДЕРЖАНИЕ в них ЖЕЛЕЗА (в мг . н а 100 г .)
Роль серы в химических реакциях: восстановитель или окислитель?
Что такое восстановитель и окислитель?
В химии восстановителями называют вещества, которые способны передавать электроны и при этом сами становятся окисленными. Другими словами, восстановитель — это вещество, которое само подвергается окислению, тем самым, осуществляя процесс восстановления другого вещества.
Окислители, наоборот, выступают в роли веществ, принимающих электроны от других веществ и при этом сами подвергаются восстановлению. Другими словами, окислитель — это вещество, которое само происходит в результате окисления и в процессе превращает другое вещество в оксид.
Важно понимать, что в каждой химической реакции могут участвовать как восстановитель, так и окислитель. Их роль зависит от конкретных условий реакции
Также стоит отметить, что восстановитель и окислитель могут быть связанными понятиями. Например, вещество может выступать одновременно и в роли восстановителя, и в роли окислителя в зависимости от того, с какими веществами оно взаимодействует.
Уравнения окислительно-восстановительных реакций серы
1. Уравнение реакции серы с кислородом (S+O2) — получение сернистого ангидрида (SO2):
S+O2 → S+4O2-2 1| S-4e- → S+4 1| O2+4e- → 2O-2 --------------- S+O2 = SO2
2. Уравнение реакции получения серной кислоты H2SO4:
S+O2+H2O → H2S+6O4 2| S-6e- → S+6 3| O2+4e- → 2O-2 --------------- 2S+3O2+2H2O = 2H2SO4
3. Уравнение реакции серы с водородом (S+H2) — получение сероводорода (H2S):
S+H2 → H2+1S-2 1| S+2e- → S-2 1| H2-2e- → 2H+1 --------------- S+H2 = H2S
4. Уравнение реакции серы с алюминием (S+Al) — получение сульфида алюминия Al2S3:
S+Al → Al2+3S3-2 3| S+2e- → S-2 2| Al-3e- → Al+3 --------------- 3S+2Al = Al2S3
5. Уравнение реакции серы с натрием (S+Na) — получение сульфида натрия Na2S:
S+Na → Na2+1S-2 1| S+2e- → S-2 2| Na-1e- → Na+1 --------------- S+2Na = Na2S
6. Уравнение реакции серы с железом (S+Fe) — получение сульфида железа FeS:
S+Na → Fe+2S-2 1| S+2e- → S-2 1| Fe-2e- → Fe+2 --------------- S+Fe = FeS
7. Уравнение реакции серы с хлоратом калия:
S+KCl+5O3 → KCl-1+S+4O2↑ 3| S-4e- → S+4 2| Cl+5+6e- → Cl-1 --------------- 3S+2KClO3 = 2KCl+3SO2↑
8. Уравнение реакции серы с серной кислотой:
S0+H2S+6O4 → S+4O2↑+H2O 1| S-4e- → S+4 2| S+6+2e- → S+4 --------------- S+2H2SO4 = 3SO2↑+2H2O
Три молекулы оксида серы получаются в результате суммирования катионов серы из первой и второй схем электронного баланса: S+4+2S+4=3S+4.
9. Уравнение реакции серы с оксидом азота:
S+N+4O2 → N2↑+S+4O2↑ 2| S-4e- → S+4 1| 2N+4+8e- → N2 --------------- 2S+2NO2 = N2↑+2SO2↑
10. Уравнение термической реакции серы с концентрироанной азотной кислотой:
S+HN+5O3(конц) → H2S+6O4+N+4O2↑+H2O 1| S-6e- → S+6 6| N+5+1e- → N+4 --------------- S+6HNO3(конц) = H2SO4+6NO2↑+2H2O
11. Уравнение реакции серы с нитратом калия:
S+KN+5O3 → KN+3O2+S+4O2↑ 1| S-4e- → S+4 2| N+5+2e- → N+3 --------------- S+2KNO3 = 2KNO2+SO2↑
12. Уравнение реакции серы с оксидом хрома (III):
S+Cr2O3 → Cr2S3-2+S+4O2↑ 3| S-4e- → S+4 2| 3S+6e- → 3S-2 --------------- 9S+2Cr2O3 = 2Cr2S3+3SO2↑
13. Уравнение реакции серы с дихроматом калия:
S+K2Cr2+6O7 → Cr2+3O3+K2S+6O4 1| S-6e- → S+6 1| 2Cr+6+6e- → 2Cr+3 --------------- S+K2Cr2O7 = Cr2O3+K2SO4
14. Уравнение реакции серы с перманганатом калия:
S+KMn+7O4 → K2S+6O4+Mn+4O2 1| S-6e- → S+6 2| Mn+7+3e- → Mn+4 --------------- S+2KMnO4 = K2SO4+2MnO2
15. Уравнение реакции серы с надпероксидом калия:
S+KOO-1 → K2S+6O4 3| 1| 3S-6e- → S+5 6| 2| 6O-1+1e- → O-2 6| 2| 6O+2e- → O-2 --------------- S+2KO2 = K2SO4 или 2| 1KO2+3e- → K+1+2O-2 1| 1S-6e- → 1S+6
16. Уравнение реакции серы с пероксидом натрия:
S+Na2O2-1 → Na2S+4O3-2+Na2O-2 1| S-4e- → S-4 2| 2O-1+2e- → 2O-2 --------------- S+2Na2O2 = Na2SO3+Na2O
17. Уравнение термической реакции серы с гидроксидом натрия:
S+NaOH(конц) → Na2SO3S+2+Na2S-2+H2O 1| 2S-4e- → 2S-4 2| S+2e- → S-2 --------------- 4S+6NaOH = Na2S2O3+2Na2S+3H2O
18. Уравнение реакции оксида серы (IV) с хлорной кислотой:
S+4O2+HCl+7O4+H2O → H2S+6O4+HCl-1 4| S+4-2e- → S+6 1| Cl+7+8e- → Cl-1 --------------- 4SO2+HClO4+4H2O = 4H2SO4+HCl
19. Уравнение реакции оксида серы (IV) с перманганатом калия в щелочной среде:
S+4O2+KMn+7O4+KOH → K2Mn+6O4+K2S+6O4+H2O 1| S+4-2e- → S+6 2| Mn+7+1e- → Mn+6 --------------- SO2+2KMnO4+4KOH = 2K2MnO4+K2SO4+2H2O
20. Уравнение реакции оксида серы (IV) с перманганатом калия в нейтральной среде:
S+4O2+KMn+7O4+H2O → Mn+2S+6O4+K2SO4+H2SO4 5| S+4-2e- → S+6 2| Mn+7+5e- → Mn+2 --------------- 5SO2+2KMnO4+2H2O = 2MnSO4+K2SO4+2H2SO4
21. Уравнение реакции оксида серы (IV) с диоксидом селена:
S+4O2+Se+4O2 → Se+S+6O3 2| S+4-2e- → S+6 1| Se+4+4e- → Se --------------- 2SO2+SeO2 = Se+2SO3
Обмен серы в растениях и загрязнение воздуха
Быстрый экономический рост, индустриализация и урбанизация связаны с резким увеличением спроса на энергию и выбросами загрязнителей воздуха , особенно диоксида серы (см. Также кислотные дожди ) и сероводорода , которые могут повлиять на метаболизм растений. Серные газы потенциально фитотоксичны , однако они также могут метаболизироваться и использоваться в качестве источника серы и даже приносить пользу, если удобрения корней серой недостаточно.
Побеги растений образуют колодец для в газовой серы воздух, который может быть непосредственно поглощенной листвы (сухого осаждения). Поглощение диоксида серы листьями обычно напрямую зависит от степени раскрытия устьиц , поскольку внутреннее сопротивление этому газу невелико. Сера очень хорошо растворим в апопластической воды из мезофилла , где он диссоциирует при образовании бисульфита и сульфита .
Сульфит может непосредственно вступать в путь восстановления серы и восстанавливаться до сульфида , включаться в цистеин, а затем в другие соединения серы. Сульфит также может окисляться до сульфата вне- и внутриклеточно пероксидазами или катализироваться неферментативно ионами металлов или супероксидными радикалами , а затем восстанавливаться и снова ассимилироваться. Избыток сульфата переносится в вакуоль; повышенные уровни сульфата листьев характерны для подвергшихся воздействию растений. Поглощение сероводорода листвой, по-видимому, напрямую зависит от скорости его метаболизма в цистеине, а затем и в других соединениях серы. Существуют убедительные доказательства того, что O-ацетил-серин (тиол) лиаза непосредственно отвечает за активное поглощение атмосферного сероводорода растениями.
Растения способны превращать сульфат в атмосферную серу, поглощаемую листвой в качестве источника серы, и концентрации 60 частей на миллиард или более кажутся достаточными для удовлетворения потребностей растений в сере. Существует взаимодействие между использованием атмосферной и педосферной серы. Например, воздействие сероводорода может привести к снижению активности редуктазы ПСА и снижению абсорбции сульфатов.
Комбинации разных процедур
Возможное сочетание разных процедур
Система восстановления серы всегда состоит из нескольких подсистем, которые объединены друг с другом в зависимости от различных требований. Решающим фактором здесь является содержание H 2 S в неочищенном газе, побочные продукты в неочищенном газе (например, CO, CO 2 , HCN, HC) и количество произведенного сырого газа. В то же время необходимо учитывать законодательные требования к чистому газу и уровню выбросов серы. Чистый газ всегда нужно обрабатывать, часто несколько раз, чтобы соответствовать требованиям законодательства.
На иллюстрации показана обычная конфигурация установки для извлечения серы на нефтеперерабатывающем заводе.
Химизм процесса
Основные реакции
Процесс состоит из многостадийного каталитического окисления сероводорода по следующей общей реакции:
2H2S+ O2 → 2S +2H2O
Процесс Клауса включает сжигание одной трети H2S с воздухом в реакторной печи с образованием диоксида серы (SO2) в соответствии со следующей реакцией:
2H2S+3O2 → 2SO2+2H2O
Оставшиеся несгоревшие две трети сероводорода подвергаются реакции Клауса (реакция с SO2) с образованием элементарной серы следующим образом:
2H2S + SO2 ←→ 3S + 2H2O
Побочные реакции
Образование газообразного водорода:
2H2S → S2 + 2H2
CH4 + 2H2O → CO2 + 4H2
Образование карбонилсульфида:
H2S + CO2 → S=C=O + H2O
Образование сероуглерода:
CH4 + 2S2 → S=C=S + 2H2S
Соединения серы
Соединения серы имеют различные свойства и применения. Некоторые из них являются окислителями, а другие – восстановителями. В таблице ниже приведены некоторые соединения серы и их окислительно-восстановительные свойства:
| Соединение | Формула | Окислительно-восстановительные свойства |
|---|---|---|
| Диоксид серы | SO2 | Окислитель |
| Триоксид серы | SO3 | Окислитель |
| Сернистый ангидрид | SO2 | Восстановитель |
| Сероводород | H2S | Восстановитель |
| Сульфаты | Множество соединений | Окислитель |
Диоксид серы (SO2) и триоксид серы (SO3) обладают сильными окислительными свойствами. Они могут окислять многие органические и неорганические соединения, такие как алкены, алканы, аммиак, сероводород и многие другие. Кроме того, они могут использоваться в производстве серной кислоты и других серных соединений.
Сернистый ангидрид (SO2) и сероводород (H2S) являются восстановителями. Они могут восстанавливать многие соединения, включая некоторые окислители, такие как хлор и бром. Кроме того, они могут использоваться в производстве серной кислоты, каменного угля и других продуктов.
Сульфаты – это соединения, которые содержат группу SO4. Они также могут действовать как окислители. Некоторые сульфаты, такие как медный сульфат, могут использоваться в качестве катализаторов в окислительных реакциях.























![Восстановление элементов из их окислов [1969 щербаков в.п. - основы доменного производства]](http://lesniepolyani.ru/wp-content/uploads/4/4/8/448f7c3b4b17439c55d14e4269245679.jpeg)






