Протокол/процедура двумерного иммуноэлектрофореза
Процедура двумерного иммуноэлектрофореза включает следующие этапы:
- Растворите 1% агарозы в буфере для электрофореза, как описано в предыдущем разделе. Поместите колбу с агарозой на водяную баню с температурой 55°C и дайте ей остыть до 55°C.
- Нагрейте пробирку на той же водяной бане в течение нескольких минут. Затем быстро перенесите 5.5 мл 1% раствора агарозы из колбы в пробирку. Кратковременно перемешайте содержимое и верните пробирку на водяную баню.
- Тщательно очистите стеклянную пластину размером 5 x 5 см денатуратом и поместите ее на выравнивающую пластину или ровную поверхность.
- Снимите пробирку с водяной бани и налейте раствор агарозы на середину стеклянной пластины. Держите горлышко пробирки близко к тарелке, чтобы облегчить заливку. Поверхностное натяжение будет удерживать жидкость на пластине. Кроме того, вы можете использовать ленту, чтобы создать окантовку вокруг пластины.
- Дайте гелю застыть в течение 5 минут. Тем временем налейте 0.03 М буфера барбитона в каждый резервуар резервуара для электрофореза и смочите фитили электрода буфером. Фитили должны быть изготовлены из шести слоев фильтровальной бумаги Whatman № 1 и обрезаны по ширине геля.
- Создайте два отверстия (диаметром 1 мм) в геле, 0.8 см от одного края пластины и примерно 1.5 см от стороны. Вы можете использовать пипетку Пастера или кусок металлической трубки, присоединенный к источнику слабого вакуума.
- Поместите 0.5 мкл бычьей сыворотки в одну лунку и 0.5 мкл эталонной сыворотки (содержащей бромфеноловый синий) в другую лунку. «Долейте» лунки электродным буфером (приблизительно 1 мкл).
- Поместите гелевую пластину на охлаждающую пластину резервуара для электрофореза и поместите фитили электродов по краям геля, стараясь не перекрывать лунки для образцов. Убедитесь, что скважины ближе всего к катоду.
- Немедленно подайте ток 20 мА (~ 250 В), пока синий маркерный краситель в эталонном образце не достигнет фитиля анода или не войдет в него. Обычно это занимает около 40 минут и обеспечивает разделение в первом измерении.
- Ближе к концу этого запуска повторите шаг 2, используя новую пробирку, но на этот раз используйте только 4.4 мл агарозы, чтобы покрыть меньшую площадь поверхности стеклянной пластины.
- После завершения работы пластины перенесите кусочек геля, содержащий испытуемый образец (без эталонного образца), на вторую чистую стеклянную пластину.
- В пробирку, содержащую оставшуюся агарозу, добавьте 150 мкл кроличьей анти-бычьей сыворотки и быстро перемешайте, чтобы обеспечить равномерное распределение антител. Позвольте пузырькам осесть, ненадолго вернув пробирку в водяную баню.
- Вылейте смесь агарозы и антител на вторую пластину рядом с полоской геля и оставьте на 5 минут.
- Поместите пластину в аппарат для электрофореза, как и раньше, и запустите ее при 3.0 мА/пластина на ночь (1 В/см). Убедитесь, что полоска образца находится на конце катода, так как белки, разделенные в первом измерении, теперь будут двигаться к аноду во втором измерении.
- В конце ночного анализа в геле будут видны пики осаждения. Эти пики можно наблюдать более отчетливо при косом освещении на темном фоне. Кроме того, вы можете окрасить пики осаждения белковым красителем для лучшей визуализации.
Протокол/процедура двумерного иммуноэлектрофореза
Важно отметить, что конкретные параметры и время, указанные в процедуре, могут варьироваться в зависимости от экспериментальной установки и требований. Следование инструкциям, приведенным в первоисточнике, или любым конкретным используемым протоколам имеет решающее значение для получения точных результатов
Двумерный перекрестный иммуноэлектрофорез хлорофилл-белковых комплексов и полипептидов тилакоидных мембран P. sativum с антисыворотками против полипептидов 5 и 6 C. reinhardtii. В первом измерении тилакоидные мембраны (10 мкг хлорофилла) P. sativum анализировали с помощью LiDodSO4. /электрофорез в полиакриламидном геле при 4VC. (A) Гель антител содержал 0.272 мг см-2 IgG против полипептида 5 C. reinhardtii. (B) Гель антител содержал 0.375 мг см-2 IgG против полипептида 6 C. reinhardtii.
Двумерный перекрестный иммуноэлектрофорез
FAQ
Что такое двумерный иммуноэлектрофорез (2D-IEP)?
Двумерный иммуноэлектрофорез — это метод, используемый для разделения и анализа белков на основе их заряда и молекулярной массы. Он включает комбинацию двумерного гель-электрофореза и иммунопреципитации с использованием специфических антител.
Как работает 2D-IEP?
В первом измерении белки разделяются на основе их заряда с помощью изоэлектрического фокусирования (ИЭФ) в геле. Затем гель подвергают разделению во втором измерении на основе молекулярной массы с использованием электрофореза в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE). Затем разделенные белки можно исследовать с помощью специфических антител для идентификации и характеристики белков-мишеней.
Каковы преимущества использования 2D-IEP?
Преимущества 2D-IEP включают высокое разрешение, специфичность, количественный анализ, всестороннее профилирование белков и его полезность в исследованиях открытия биомаркеров.
Каковы ограничения 2D-IEP?
Некоторые ограничения 2D-IEP включают его трудоемкий характер, ограниченную пропускную способность образца, субъективность в интерпретации, ограничения чувствительности для белков с низким содержанием и технические проблемы при оптимизации.
Какие типы образцов можно анализировать с помощью 2D-IEP?
2D-IEP можно использовать для анализа различных типов проб, в том числе ячейка лизаты, экстракты тканей, образцы сыворотки или плазмы и образцы очищенного белка.
Можно ли использовать 2D-IEP для количественного анализа?
Да, 2D-IEP можно использовать для количественного анализа путем сравнения интенсивности белковых пятен или полос. Он позволяет определять относительные концентрации белков и идентифицировать дифференциально экспрессируемые белки.
Какова роль антител в 2D-IEP?
Антитела используются в 2D-IEP для специфического обнаружения и характеристики белков-мишеней. Они связываются со своими соответствующими антигенами в геле, что позволяет идентифицировать взаимодействия антиген-антитело и анализировать антигенные свойства.
Сколько времени занимает типичный эксперимент 2D-IEP?
Продолжительность эксперимента 2D-IEP может варьироваться в зависимости от нескольких факторов, включая количество образцов, сложность анализируемых белков и используемый конкретный протокол. Как правило, он может варьироваться от нескольких часов до суток.
Существуют ли альтернативные методы 2D-IEP?
Да, существуют альтернативные методы анализа белков, такие как одномерный гель-электрофорез, двумерный гель-электрофорез без иммунопреципитации и протеомные подходы на основе масс-спектрометрии. Выбор метода зависит от целей исследования и конкретных требований исследования.
Каковы некоторые общие приложения 2D-IEP?
2D-IEP имеет различные применения, включая характеристику белков, обнаружение биомаркеров, иммунологические исследования, диагностику заболеваний и мониторинг ответа на лечение. Он использовался в исследованиях, связанных с раком, аутоиммунными заболеваниями, инфекционными заболеваниями и профилированием экспрессии белков.
Встречный электрофорез. Методика
Материалы и оборудование. Для работы можно использовать любое
электрофоретическое устройство с регулируемым напряжением (до 300 В), например,
камеру FK66 (Росток) или Цейссовский прибор для электрофореза; предметные стекла
или стеклянные диапозитивные пластины 5х5 см, агар (например, Difco Agar Noble)
или агарозу, или смесь агар — агароза; ацетат-целлюлозная мембрана (Sar-torius,
Геттинген); трубки для вырезания лунок в геле, водоструйный насос для удаления
вырезанных гелевых цилиндров; влажную камеру, фильтровальную бумагу для
замыкания контактов геля с буфером. Антисыворотки (например, лошадиная анти-HBsAg
сыворотка, анти-АФП сыворотка, Institut fiir Imf-stoffe (Дессау), Behringwerke
(Марбург), буферные растворы, состав которых приводится ниже.
Буферные растворы:
А
или
Б
Барбитал-натрий
9,75 г
8,142 г
CH3C00Na-3H20
6,47 г
0,476 г
0,1 М HCl
60,0 мл
90,0 мл
Дистиллированная вода до
2000 м
до 1000 мл
рН 8,6; µ = 0,05
рН 8,3—8,4; µ = 0,1
Приготовление геля
Расплавляют 1,5 г агара, агарозы или смеси обоих веществ в 100 мл
барбитал-ацетатного буфера на кипящей водяной бане. В качестве консерванта можно
добавить 2 мл 0,1% раствора тиомерсала (мертиолята). Стеклянные пластины
обезжиривают, слегка подогревают и наносят на них равномерным слоем агар из
расчета 0,15 мл на 1 см2. После застывания геля на расстоянии около 7
мм друг от друга вырезают лунки диаметром 3 мм, гелевые цилиндры удаляют с
помощью водоструйного насоса. Если одновременно хотят обнаружить антитела, то
лунки вырезают триадами.
Схема расположения лунок при проведении встречного
иммуноэлектрофореза
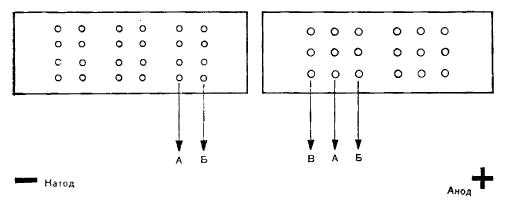
А — место нанесения антигена, Б — место нанесения антисыворотки,
В — место нанесения охарактеризованного антигена для выявления антител.
В зависимости от цели исследования расположение лунок может быть и таким, как
показано на рисунке;
Схема расположения лунок для реагентов прн постановке ВИЭФ
по Kohn
особое внимание следует обращать на точное соблюдение расстояний между
лунками. Если лунки расположены так, как это показано на рисунке то, варьируя
соотношение антиген—антитело и заполняя исследуемым образцом оба резервуара (без
положительного контроля), можно наблюдать (соответственно избегать) феномен
прозоны вследствие избытка антиген или антитело
При помощи пипетки в лунки с катодной
стороны вносят антиген, с анодной — антисыворотку.
Проведение электрофореза
Оба отделения камеры для электрофореза заполняют барбитал-ацетатным буфером.
Пластины с гелем укладывают в соответствии с расположением полюсов и замыкают
электрическую цепь полосками бумаги, смоченной буферным раствором. При
напряжении 150—200 В (3—4 мА на 1 см ширины агарового геля) продолжительность
электрофореза составляет от 1 до 3 ч. Увеличивая напряжение до 300 В, можно
сократить продолжительность электрофореза до 30 мин, но для этого необходимо
обеспечить охлаждение камеры. В геле агара преципитаты HBsAg— анти-НВs-антитела
образуются возле лунки с антисывороткой, в геле агарозы — посередине между
лунками с антигеном и с антителом.
Прецнпнтат НВз-антнген/анти-НВв-антитела в геле агарозы
(большое увеличение)
АФП/анти-АФП преципитат в геле агара

а — антнсыворотка, б — исследуемая сыворотка, в —
позитивная контрольная сыворотка
Встречный иммуноэлектрофорез на ацетат-целлюлозных
мембранах
Смоченные в буферном растворе мембраны из ацетат-целлюлозы слегка высушивают
фильтровальной бумагой, кладут их на три слоя фильтровальной бумаги и
специальным штампом делают углубления, вмещающие 5 мкл жидкости. Эти углубления
хорошо сохраняются при последующей обработке мембран и помогают точно определять
положение полос преципитации. Напряжение 100 В позволяет завершить электрофорез
за 20 мин. Линии преципитации на мембране не видны, для их визуализации
необходимо окрашивание. Мембраны отмывают проточной водопроводной водой,
окрашивают амидо черным 10 В или нигрозином и обесцвечивают водой. Весь процесс
занимает не более 15 мин. ВИЭФ на ацетат-целлюлозных мембранах имеет несомненные
преимущества при массовых обследованиях, так как расход антисыворотки составляет
всего лишь 5 мкл на один анализ.
Применение двумерного иммуноэлектрофореза
Двумерный иммуноэлектрофорез (2D-IEP) имеет несколько применений в области иммунологии и анализа белков. Вот некоторые из его известных применений:
- Обнаружение антител: 2D-IEP обычно используется для обнаружения и характеристики антител в биологических образцах. Это позволяет разделить и идентифицировать различные классы и подклассы антител на основе их электрофоретической подвижности и антигенной специфичности.
- Диагностика аутоиммунного заболевания: Этот метод играет решающую роль в диагностике аутоиммунных заболеваний путем обнаружения аутоантител, присутствующих в сыворотке пациентов. Используя специфические антигены, 2D-IEP может идентифицировать аутоантитела, связанные с такими состояниями, как системная красная волчанка, ревматоидный артрит и аутоиммунный гепатит.
- Иммунопротеиновый анализ: 2D-IEP позволяет проводить подробный анализ иммунопротеинов, таких как иммуноглобулины, компоненты комплемента и острофазовые реагенты. Это помогает в изучении их распределения, концентрации и закономерностей, что может быть полезно для клинической диагностики и мониторинга различных заболеваний.
- Профилирование иммунного ответа: Комбинируя два измерения разделения, 2D-IEP обеспечивает всесторонний анализ иммунных реакций. Он позволяет идентифицировать и сравнивать профили антиген-специфических антител, помогая понять иммунный статус людей и оценить эффективность вакцин.
- Исследования экспрессии белков: 2D-IEP используется для анализа паттернов экспрессии белков в различных образцах, таких как клетки, ткани и биологические жидкости. Он позволяет разделять и идентифицировать белки на основе их заряда и молекулярной массы, обеспечивая ценную информацию о профилях белков, посттрансляционных модификациях и дифференциальной экспрессии.
- Открытие биомаркеров: этот метод использовался в исследованиях открытия биомаркеров. Сравнивая профили иммунопротеинов у здоровых и больных людей, можно определить потенциальные биомаркеры, связанные с конкретными состояниями. Эти биомаркеры могут служить диагностическими или прогностическими индикаторами или помогать в мониторинге прогрессирования заболевания и ответа на лечение.
- Анализ аллергенов: 2D-IEP используется для идентификации и характеристики аллергенных белков в сложных смесях. Это помогает в изучении иммунного ответа на определенные аллергены и помогает в разработке диагностических тестов и иммунотерапии аллергии.
- Контроль качества в биофармацевтике: 2D-IEP используется для контроля качества биофармацевтических продуктов, включая моноклональные антитела и вакцины. Это помогает в оценке чистоты, идентичности и стабильности этих продуктов, обеспечивая их безопасность и эффективность.
В целом двумерный иммуноэлектрофорез представляет собой универсальный метод с разнообразными применениями в иммунологии, клинической диагностике, анализе белков и биомедицинских исследованиях. Его способность разделять и характеризовать иммунопротеины на основе антигенной специфичности и электрофоретической подвижности делает его ценным инструментом в различных областях.
Иммуноэлектрофорез — характеристика, виды реакции, оценка результатов.
Метод иммуноэлектрофореза, с помощью которого какой-либо антиген, например образец сыворотки, подвергается электрофоретическому разделению на составляющие его компоненты перед взаимодействием с антителами в геле для получения полос преципитации.
Иммуноэлектрофоретический анализ представляет собой сочетание электрофореза в агаровом геле с иммунодиффузией. Существуют различные варианты иммуноэлектрофореза.
Виды:
Встречный иммуноэлектрофорез может примен для опред антигенов, мигрирующих в агаре к положительнозаряж электроду. Его применяют для идентификации антигенов вируса гепатита В и соответствующих антител, антител к ДНК при системной красной волчанке, аутоантител к растворимым ядерным антигенам при коллагенозах, а также антител (преципитинов) к Aspergillus при аллергическом бронхолегочном аспергиллезе.
Ракетный электрофорез-это колич метод, предусматривающий внесение антигена в гель, содерж антитела. Линия преципитации имеет форму ракеты , длина которой определяется концентрацией антигена. Как и встречный электрофорез, это-быстрый метод, но и здесь антиген должен перемещаться к положительно заряженному электроду. Таким образом, ракетный электрофорез подходит для белков, например альбумина, трансферрина и церулоплазмина, в то время как концентрацию иммуноглобулинов обычно определяют методом простой радиальной иммунодиффузии.
Один из наиболее удачных вариантов ракетного электрофореза — двухмерный или перекрестный иммуноэлектрофорез Лорелла. При этом на первом этапе смесь антигенов электрофоретически разделяют в геле агарозы.Затем разделенные белки вновь заставляют диффундировать в геле под влиянием электрического поля в другом
Методы иммуноэлектрофореза для проведения количественного определения антигенов. Принцип метода и его назначение.
· Метод, основанный на принципе простой иммунодиффузии, при которой углубления для антигенов и антител примыкают непосредственно друг к другу. Антиген, находящийся в одной части геля, диффундирует в другую, содержащую антитела, и на границе этих двух частей образуется линия преципитации. Первичная зона преципитации растворяется затем в избытке антигена, продолжающего поступать благодаря диффузии в ту часть геля, где находятся антитела. Растворимые комплексы антигенантитело вновь преципитируют при реакции с антителами в прилежащей зоне геля. Описанная последовательность событий — преципитация, растворение и повторная преципитация — создает впечатление, что преципитат движется. Путь, пройденный передним краем преципитата за тот или иной период времени, может служить мерой для определения концентрации антигенов. При этом в качестве стандартов необходимо использовать образцы с известной концентрацией антигена. При количественном иммуноэлектрофорезе для проведения простой иммунодиффузии разделенных компонентов в геле вырезают широкую канавку, непосредственно примыкающую к лунке с антигеном и заполняют ее агаровым золем, содержащим антитела в относительно низкой концентрации. После того как в геле, содержащем антитела, образуются преципитаты, измеряют расстояние, на которое переместился их передний край.
· По методу, предложенному Альфонсо, точно измеренный объем раствора антигена подвергают электрофорезу. Затем пластинки оставляют на некоторое время, чтобы дать материалу, разделившемуся при электрофорезе, диффундировать, после чего гель дважды в течение 1 ч покрывают антисывороткой (4—5 мкл/см2 ). Образуются зоны преципитации круглой или овальной формы. Количество антигена рассчитывают по величине поперечного диаметра этих зон.
-
Оценка глубины поражения кожи
-
КТ, МРТ оссификации желтой связки
-
Ошибки и осложнения лечения заболеваний стопы у танцоров
-
Резекция левой верхней доли. Техника верхней лобэктомии слева
- Внутрижелудочковые блокады у детей.
Важные замечания
Вот некоторые примечания, которые следует учитывать при проведении двумерного иммуноэлектрофореза:
Альтернативным вариантом буфера для описанного буфера для электрофореза является 0.1 М трис-борат с рН 7.4.
рН барбитонового буфера был тщательно выбран равным 8.4, что близко к изоэлектрической точке IgG.
Неиспользованный раствор агарозы можно хранить при 4°C и повторно использовать позднее
Однако важно проверять наличие признаков микробного загрязнения каждый раз при повторном использовании агарозы.
Тонкие гелевые пластины следует использовать для максимизации охлаждающего эффекта охлаждающей пластины, особенно во время прогона первого измерения, когда выделяется значительное количество тепла.
В качестве фитиля электрода можно использовать любой сильно абсорбирующий и инертный материал, например, фильтровальную бумагу, ворс или вату. Эти фитили должны иметь низкое сопротивление и быть в состоянии поглощать большое количество буфера.
Чтобы предотвратить соскальзывание фитилей электродов во время электрофореза, можно поместить толстые стеклянные блоки поверх фитилей, где они соприкасаются с гелем, или можно поместить тяжелый стеклянный лист поперек обоих фитилей.
Поддержание равномерной напряженности поля по всему гелю имеет решающее значение, поэтому фитили должны быть точно такой же ширины, как и гель.
При установке фитилей для электрофореза убедитесь, что они находятся на достаточном расстоянии от электродов.
Рабочая температура агарозного геля составляет 55°C, что немного выше температуры застывания агарозы
Гель следует заливать сразу же после добавления антисыворотки, чтобы свести к минимуму вероятность денатурации антисыворотки.
При вырезании полоски геля в первом измерении убедитесь, что рядом с дорожкой образца осталось достаточно геля, чтобы разместить фитиль во втором измерении. Фитиль не должен покрывать образец во время анализа второго измерения.
Количество антисыворотки, используемой в геле, зависит от титра антител и количества белка в первом измерении. Лучше всего определить методом проб и ошибок.
Указанное время электрофореза подходит для большинства образцов, но может потребоваться корректировка в зависимости от конкретных требований.
Если результаты не получены, дважды проверьте, мигрируют ли анализируемые белки к аноду при выбранных условиях электрофореза.
Не забудьте обратиться к первоисточнику или любым конкретным протоколам для получения дополнительных указаний и корректировок, чтобы обеспечить точные и успешные результаты.
Что такое двумерный (перекрестный) иммуноэлектрофорез?
- Двумерный иммуноэлектрофорез (2-D IEP), также известный как перекрестный иммуноэлектрофорез, представляет собой мощный метод, используемый для количественного определения и анализа белковых смесей. Этот метод включает два последовательных этапа электрофореза для разделения и идентификации белков.
- В первом измерении 2-D IEP исследуемая белковая смесь подвергается электрофорезу в агарозном геле. На этом этапе белки разделяются в зависимости от их заряда и размера, в результате чего образуются отдельные полосы или пятна, представляющие отдельные белки.
- Второе измерение метода — это то, где в игру вступает аспект иммуноэлектрофореза. Отделенные белки из первого измерения затем подвергают электрофорезу под прямым углом в свежий слой агарозного геля. Этот гель содержит определенное количество антител, заранее определенное для интересующего белка-мишени.
- Во время второй стадии электрофореза белки мигрируют в гель и вступают в контакт с антителом, присутствующим в геле. Затем белки и антитела образуют комплексы антиген-антитело, что приводит к пикам преципитации. Каждый белок образует отдельный пик осадка, что позволяет проводить их индивидуальную идентификацию и количественный анализ.
- Миграции белков в этом методе способствует pH геля, установленный на уровне 8.4. При этом рН гамма-глобулины, класс белков, мигрируют к катоду. В результате и антитела, и антигены мигрируют навстречу друг другу, образуя пики преципитации в соответствующих местах. Площадь под каждым пиком прямо коррелирует с концентрацией белка в образце и обратно пропорциональна концентрации специфического антитела в геле.
- Первоначально разработанный для измерения изменений в структуре белков сыворотки при заболеваниях человека, 2-D IEP оказался очень успешным в этом отношении. Он может количественно определять до 40 различных белков сыворотки в одном эксперименте, обеспечивая ценную информацию о болезненных состояниях.
- Хотя анализ сыворотки является распространенным применением, этот метод можно адаптировать для различных задач молекулярной биологии. Выбор белков для количественного определения зависит от конкретной антисыворотки, используемой во втором измерении. Например, изоферменты можно разделить в первом измерении, а использование соответствующей антисыворотки во втором измерении приведет к перекрывающимся пикам, соответствующим каждому изоферменту, при этом площадь под каждым пиком будет пропорциональна его концентрации.
- Универсальность 2-D IEP распространяется на такие приложения, как изучение образования белковых комплексов, дифференциация морфологически сходных видов, определение антигенного состава, измерение экспрессии белков в различных тканях, обнаружение вариантов форм белков, количественная оценка комплексов фермент-ингибитор, скрининг специфических белков в различных тканях. виды, изучение взаимодействия лиганд-белок, изучение структуры и морфогенеза вируса, а также количественная оценка синтеза белка во время развития личинок.
- Таким образом, двухмерный иммуноэлектрофорез (2-D IEP) или перекрестный иммуноэлектрофорез является мощным методом, используемым для количественного определения и анализа белковых смесей. Он включает два последовательных этапа электрофореза и использует антитела для образования комплексов антиген-антитело, что позволяет идентифицировать и количественно определять отдельные белки. Этот метод нашел применение в различных областях исследований и оказался очень универсальным и ценным при анализе белков.
Встречный электрофорез
Принцип
встречного электрофореза применил в
1969 г. Бедарида для обнаружения преципитатов
АГ-АТ. Иммунопреципитация происходит
в слое носителя, причем в отличие от
метода Ухтерлони контакт антигена с
антителом происходит не вследствие
свободной диффузии, а под влиянием
постоянного электрического поля. Белки
представляют собой амфолиты; ввиду
различий аминокислотного состава они
могут мигрировать в щелочной среде с
разной скоростью и в разных направлениях
(анодном, катодном). Если антиген и
соответствующая преципитирующая
антисыворотка мигрируют в разных
направлениях, становится возможным их
движение друг навстречу другу в слое
геля или на ацетатцеллюлозной пленке.
Преципитация наблюдается между стартовыми
лунками обоих компонентов в течение
30-180 мин в зависимости от приложенного
напряжения. Встречный иммуноэлектрофорез
(ВИЭФ) предназаначен для обнаружения и
индентификации преципитирующих систем
АГ-АТ при условии, что антиген обладает
электрофоретической подвижностью,
отличной от той, которой обладают
иммуноглобулины. ВИЭФ используют для
индентификации антигенов вирусного
гепатита В, антител к Aspergillus
при бронхолегочном аспергилизе, антител
к N.meningitidis,
антител к ДНК при СКВ.
Принцип встречного иммуноэлектрофореза
(ВИЭФ) заключается в одновременном движении в геле навстречу друг другу антигенов и антител под действием электрического тока.
В результате их специфического взаимодействия образуется линия преципитата. Метод сочетает простоту реакции диффузной преципитации в геле с высокой разрешающей способностью электрофореза. Хотя по чувствительности этот метод уступает методу флюоресцирующих антител и реакции непрямой гемагглютинации, однако для него не требуется люминесцирующих антител, люминесцентного микроскопа и эритроцитарного диагностикума.
ВИЭФ — качественный метод. Он отличается высокой специфичностью, прост в выполнении. Его можно применять для обнаружения бактериальных или вирусных антигенов в патологическом материале, органах лабораторных (биопробных) животных или объектах окружающей среды.
Материалы и оборудование
. 1. Агароза А и В. 2. 0,05 М мединал- HCl буфер (pH 8,6). 3. Хлорид натрия. 4. Фосфат натрия двузамещенный. 5. Фосфат калия однозамещенный. 6. Хлорид калия. 7. Оксалат аммония. 8. Специфический бактериальный или вирусный антиген. 9. Камера для электрофореза. 10. Выпрямитель постоянного тока на 50 мА. 11. Термостат электрический суховоздушный. 12. Центрифуга лабораторная настольная.
Техника постановки
. На стеклянную пластинку, установленную горизонтально, наливают 30 мл расплавленной 1%-й агарозы, приготовленной на мединал — HCl буфере (pH 8,6). После того как гель застынет, в нем пробойником вырезают два двойных ряда лунок диаметром 5 мм (по 8 лунок в каждом ряду); расстояние между двойными рядами составляет 30 мм. Из лунок удаляют гель, собирают в пробирку, растапливают над пламенем горелки и с помощью пастеровской пипетки вносят на дно лунок.
Со стороны катода помещают исследуемый материал, а со стороны анода — моноспецифическую сыворотку, но лучше моноклональные антитела (МКА) в объеме 0,035 мл. Например, для обнаружения пневмококка — антапневмококковую сыворотку, для выявления антигена вируса гриппа — противогриппозную и т. д.
Пластинку помещают в камеру для электрофореза таким образом, чтобы поролон, применяемый в качестве соединительного мостика между буферной системой и гелем-носителем, касался последнего. Электрофорез проводят при комнатной температуре при напряжении 140…150 В и силе тока 35 мА в течение 18…35 мин.
Контроль
. Исследование материала в ВИЭФ на присутствие специфического антигена должно сопровождаться контролем с заведомо положительным материалом.
Обнаружение возбудителя при сочетании ВИЭФ с подращиванием
. Для посева загрязненного материала следует использовать селективные среды.
После 36-часовой инкубации при 37 °С в чашку вносят 0,3 мл 0,85%-го раствора NaCl с 4 % формалина, делают смыв, который отсасывают в пробирку и после экспозиции в течение 1 ч исследуют в ВИЭФ.
Учет результатов
. При положительном результате появляется линия прещшитата между лункой с исследуемым материалом и лункой со специфической сывороткой. Линия преципитата в зависимости от количества антигена в исследуемом материале может располагаться либо посередине расстояния между лунками, либо ближе к резервуару с сывороткой.
Обычно линии преципитата формируются через 18…35 мин после начала электрофореза.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter
.




























