Содержание
- 1 Источники образования АФК
- 1.1 Эндогенные источники
- 1.2 Экзогенные источники
- 2 Антиоксидантные ферменты
- 2.1 Супероксиддисмутаза
- 2.2 Синглетный кислород
- 3 Повреждающее воздействие
- 3.1 Реакция патогена
- 3.2 Окислительное повреждение
- 3.3 Нарушение когнитивной функции
- 4 Причина старения
- 5 Мужское бесплодие
- 6 Рак
- 6.1 Канцерогенез
- 6.2 Клеточная пролиферация
- 6.3 Смерть клетки
- 6.4 Инвазия опухолевых клеток, ангиогенез и метастазирование
- 6.5 Хроническое воспаление и рак
- 6.6 Лечение рака
- 7 Положительная роль ROS в памяти
- 8 См. также
- 9 Ссылки
- 10 Дополнительная литература
- 11 Внешние ссылки
Источники продукции ROS
Эндогенные источники
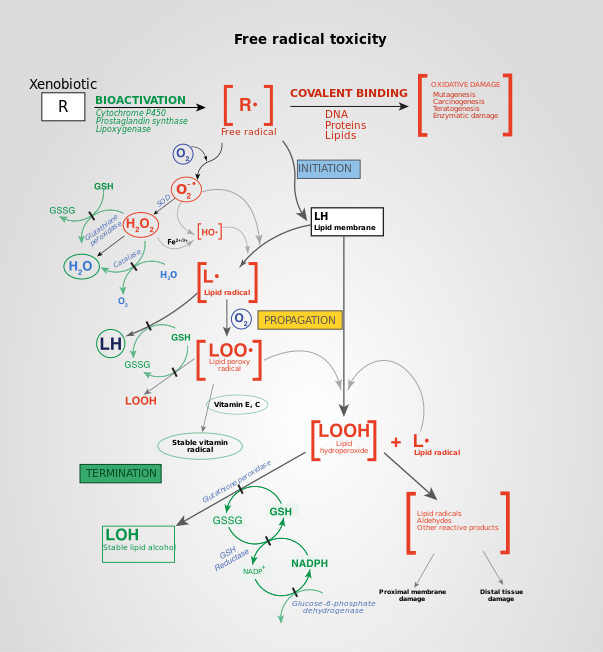
АФК образуются во время различных биохимических факторов внутри клетки и внутри органелл таких как митохондрии, пероксисомы и др. эндоплазматический ретикулум. Митохондрии преобразуют клетки в пригодную для использования формулу, аденозинтрифосфат (АТФ). Процесс производства АТФ в митохондриях, называемый окислительным фосфорилированием, включает транспорт протонов (водорода водорода) через внутреннюю митохондриальную мембрану посредством цепи переноса электронов. В цепи переноса электронов электроны происходят через серию белков посредством окислительно-восстановительных сил, при этом каждый акцепторный белок в цепи имеет больший восстановительный потенциал, чем предыдущий. Последним назначением электрона в этой цепочке является молекула кислорода. В нормальных условиях кислород восстанавливается с образования воды; однако примерно в 0,1–2% электронов, проходящих через цепь (это число получено из исследований в митохондриях, хотя точная скорость в живых организмх еще не полностью согласована), кислород вместо этого преждевременно и не полностью восстановится, чтобы дать супероксидный радикал (O. 2), наиболее хорошо задокументированный для Комплекса I и Комплекса III.
Другим созданием АФК создания реакции переноса электрона, катализируемыми митохондриальными системами P450 в стероидогенные ткани. Эти системы P450 зависят от переноса электронов от NADPH к P450. Во время этого процесса некоторые электроны «утекают» и реагируют с O 2 с образованием супероксида. Чтобы справиться с этим естественным ROS, стероидогенные ткани, яичники и яички имеют большую концентрацию антиоксидантов, таких как витамин C (аскорбат) и β-каротин и антиоксидант. ферменты.
Если в митохондриях присутствует слишком много повреждений, клетка подвергается апоптозу или запрограммированной гибели клеток.
АФК продуцируются в передаче сигналов иммунной клетки через путь NOX. Фагоцитарные клетки, такие как нейтрофилы, эозинофилы и мононуклеарные фагоциты, при стимуляции продуцируют АФК.
Экзогенные источники
Образование АФК может быть стимулировано различными агентами, такими как загрязнители, тяжелые металлы, табак, дым, наркотики, ксенобиотики или радиация.
Ионизирующее излучение может генерировать повреждающие промежуточные соединения при взаимодействии с водой, процесс, называемый радиолизом. Вероятность радиолиза в присутствии ионизирующего излучения высока составляет 55–60%. При этом вода теряет электрон и становится очень реактивной. Затем посредством трехступенчатой цепной реакции вода превращается в гидроксильный радикал (OH), пероксид водорода (H2O2), супероксидный радикал (O. 2) и, в конечном итоге, кислород (O2).
Гидроксильный радикал радикал реактивен и немедленно удаляет электроны из любого молекулы на своем пути, развивая цепную реакцию. Однако перекись водорода на самом деле более разрушительна для ДНК, чем более низкая реакционная способность перекиси водорода дает молекуле достаточно времени, чтобы проникнуть в ядро клетки, вступить в реакцию с макромолекулами, такими как ДНК.
Окислительный стресс и болезни
В здоровом организме показатели производства и очистки ROS хорошо сбалансированы. Экзогенные источники окислителей и некоторые болезненные состояния могут сместить этот баланс за счет увеличения количества АФК, образующихся без адекватной детоксикации. Например, неконтролируемый окислительный стресс способствует патогенезу диабета и его осложнений (60–62). Нейродегенеративные заболевания, рак и старение — все это связано с повышением скорости образования АФК. Заболевания, при которых острое или хроническое воспаление является значительным компонентом, приводит к избыточной продукции внеклеточных АФК, которая может склонить окислительно-антиоксидантный баланс к острому и / или прогрессирующему повреждению органов, а неспецифическая продукция АФК мешает нормальным сигналам, генерируемым АФК. С другой стороны, избыточное продуцирование АФК в фагоцитирующих клетках имеет решающее значение для защиты от микроорганизмов. Нейтрофил убивает бактерии посредством индукции NADPH оксидазы, которая производит взрыв супероксида (окислительный взрыв). Недавние работы также показали, что градиент H 2 O 2 необходим для адекватного заживления ран (например, у рыбок данио), но степень, в которой такие градиенты необходимы для заживления ран млекопитающих, все еще изучается (63).
Использование кислорода и обмен веществ
Приблизительно 90-95% O 2, потребляемого организмом, используется митохондриями для снабжения клеточной энергии через дыхание и окислительное фосфорилирование (2, 3)
Окислительное фосфорилирование сохраняет энергию от расщепления углеродных субстратов в продуктах, которые мы принимаем в виде АТФ, что жизненно важно для функционирования клеток. Чтобы генерировать АТФ посредством аэробного дыхания, О 2 восстанавливается до воды в четырехэлектронном процессе без образования АФК
Затем АТФ гидролизуется до АДФ, обеспечивая энергию для выполнения основных клеточных функций, таких как поддержание ионных градиентов и открытие ионных каналов для нервной проводимости, для сокращения мышц, а также для роста, восстановления и пролиферации клеток.
Энергия в форме АТФ происходит от окисления пищевых углеводов, липидов и белков. Соотношение углеводов, липидов и белков, используемых для производства АТФ, зависит от клеток и органов. Например, клетки взрослого мозга (в состоянии сытости) и эритроциты используют углеводы, тогда как энергия для сокращения сердца происходит главным образом от окисления жирных кислот (4–6). Хотя O 2 необходим для аэробной генерации АТФ, АФК может быть получена как побочный продукт неспецифического переноса электронов в O 2 либо митохондриальными белками транспорта электронов, либо неферментативными экстрамитохондриальными реакциями. Кроме того, многочисленные эндогенные ROS-продуцирующие ферменты используют молекулярный O 2 для своих реакций. Продукция ROS некоторыми нормальными и большинством патологических механизмов увеличивается в зависимости от концентрации кислорода в ткани, что может привести как к прямому молекулярному повреждению, так и к вмешательству в основные редокс-регуляторные события, как описано ниже. Диаграмма использования молекулярного O 2 этими ферментными системами и последующими последствиями — хорошими и плохими — показана на рисунке 1.
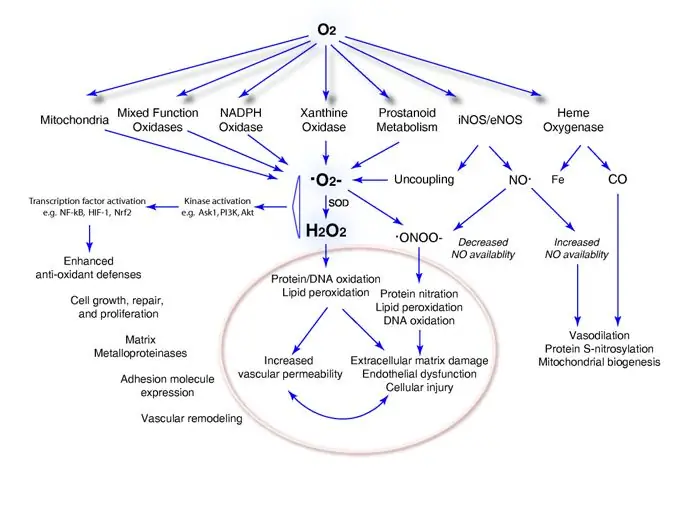 фигура 1
фигура 1
Молекулярное использование кислорода ферментными системами, приводящее к образованию активных форм кислорода и последующим последствиям. Кислород (O 2) не только приводит к образованию супероксидных анионов (· O 2-) митохондриями и монооксигеназами, но также необходим для ферментативного производства важных сигнальных молекул оксида азота (NO) и оксида углерода (CO). Некоторые полученные из кислорода реакционноспособные интермедиаты кислорода, такие как перекись водорода (H 2 O 2), оказывают плюрипотентные эффекты в клетке, которые не только вредны, такие как окисление белков и ДНК и перекисное окисление липидов, но являются полезными и адаптивными, например, путем усиления антиоксидантная защита. Ask1, апоптоз-сигнальная киназа 1; Fe, железо; HIF-1, индуцируемый гипоксией фактор 1; iNOS / eNOS, индуцибельная синтаза оксида азота / эндогенная синтаза оксида азота; ONOO -, пероксинитритный анион; PI3K, фосфоинозитид-3-киназа; СОД, супероксиддисмутаза.
Изображение в полном размере
Поскольку O 2 и его промежуточные продукты являются высокореактивными, элегантные, но сложные системы эволюционировали, чтобы обеспечить непрерывное производство АТФ при минимизации продукции АФК нормальным метаболизмом. Например, белки дыхательных комплексов позволяют только от 1 до 2% O 2, потребляемого митохондриальной системой транспорта электронов, генерировать АФК. Эта последовательность окислительно-восстановительных реакций генерирует поток электронов через Комплексы I-IV системы переноса электронов, который производит электродвижущую силу через внутреннюю митохондриальную мембрану, используемую АТФазой, также известной как Комплекс V, для синтеза АТФ. При этом небольшие количества синглетного кислорода и супероксидного аниона (· O 2-) образуются главным образом в комплексе I и комплексе III пропорционально локальной концентрации O 2 и восстановительному состоянию носителя. Хотя такие АФК могут явно повреждать митохондрии и соседние органеллы путем окисления ДНК, белков и липидов или стимулирования образования аддуктов с ДНК, митохондрии защищены супероксиддисмутазой (SOD2) и их собственными системами глутатиона и пероксидазы. Небольшое количество · O 2-, которое производят митохондрии, быстро превращается в пероксид водорода (H 2 O 2), часть которого уходит в цитоплазму и участвует во внутриклеточной трансдукции сигнала. Фактически, большинство исследований передачи сигналов клетками, вызванных АФК, было сосредоточено на каталитических изменениях, вызванных окислением белков, сигнализирующих клетки, H 2 O 2, что является основной темой настоящего обзора.
Транскрипционные факторы
H 2 O 2 не только регулирует определенные пути внутриклеточной киназы и фосфатазы, но также взаимодействует со специфическими редокс-чувствительными факторами ядерной транскрипции, коактиваторами и репрессорами. Транскрипционные факторы обычно становятся активированными в ответ на сигнальные каскады, активируемые как мембраносвязанными рецепторами, так и внутриклеточными механизмами. Активация транскрипции широкого спектра семейств генов участвует в выживании клеток, пролиферации клеток, усилении антиоксидантной защиты, механизмах репарации ДНК, контроле синтеза белка и регуляции митохондриального биогенеза. Среди факторов транскрипции, которые, как известно, активируются окислительно-восстановительным способом, являются Sp1, глюкокортикоидный рецептор, Egr1, p53, NF-κB, NF-E2-связанный фактор 2 (Nfe2l2 или Nrf2), фактор, индуцируемый гипоксией-1α, и ядерный дыхательный фактор-1. Фактор-1α, индуцируемый гипоксией, является редокс-чувствительным фактором транскрипции, который обеспечивает экстренную реакцию выживания при тяжелых гипоксических и воспалительных состояниях
В нескольких превосходных обзорах обсуждается важность этих транскрипционных факторов и их нижестоящих генов-мишеней (44, 45). Активация NF-κB и активация Nrf2 (Nfe2l2) также имеют особое значение при заболеваниях, поражающих критически больных пациентов
NF-κB связан в цитоплазме с IκB в неактивном состоянии (46). Стимулы, которые активируют NF-κB, индуцируют протеосомную деградацию IκB, позволяя NF-κB транслоцироваться в ядро и связываться с мотивами κB в области промотора многих генов, включая TNFα и индуцибельную синтазу оксида азота (NOS2). H 2 O 2 четко модулирует функцию NF-κB; однако, являются ли его эффекты ингибирующими или активирующими, по-видимому, зависит от типа клеток (47). Сообщалось, что H 2 O 2 увеличивает ядерную транслокацию NF-κB (48, 49), но другие исследования показали противоположный эффект (50). Хотя регуляция NF-κB с помощью АФК имеет большое значение при воспалительных состояниях, недавняя работа над другими редокс-регулируемыми факторами транскрипции, такими как Nrf2, предполагает, что H 2 O 2 обладает плюрипотентными эффектами.
Nrf2-зависимые гены имеют решающее значение для поддержания клеточного окислительно-восстановительного гомеостаза. Этот транскрипционный фактор конститутивно экспрессируется в цитоплазме и регулируется убиквитинилированием под динамическим контролем kelch-подобного ECH-ассоциирующего белка-1 (44, 51, 52). В ответ на окислительный или электрофильный стресс kelch-подобный ECH-ассоциированный белок-1 окисляется H 2 O 2. Это событие мешает убиквитинилированию Nrf2 и его удалению протеасомой, что позволяет Nrf2 накапливаться в ядре. Ядерный Nrf2 связывается с промоторами генов, содержащих консенсусную последовательность антиоксидантного элемента ответа (53). Эти гены включают печеночные метаболизирующие ферменты (изоформы цитохрома P450) и многие индуцибельные антиоксидантные ферменты, такие как глутатионпероксидаза, тиоредоксинредуктаза и пероксиредоксин-1. Nrf2 также индуцирует HO-1, NAD (P) H-хинонредуктазу-1 и γ-глутамилцистеинлигазу, которые помогают регулировать внутриклеточное окислительно-восстановительное состояние (54–57). Простая схема ответа Nrf2 на митохондриальную продукцию H 2 O 2 представлена на рисунке 3. Недавняя работа предполагает, что транскрипционный контроль Nrf2 играет значительную роль при заболеваниях, связанных с воспалительным стрессом (58, 59).
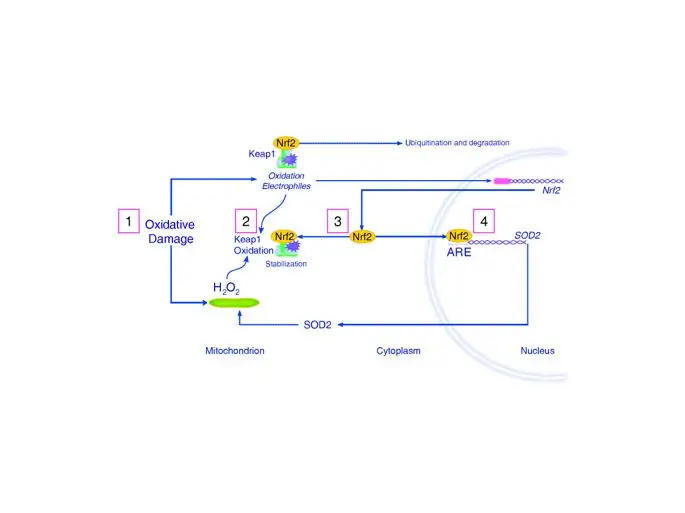 Рисунок 3
Рисунок 3
Схема ответа Nrf2 на митохондриальную продукцию перекиси водорода. Передача молекулярного сигнала на основе пероксида водорода (H 2 O 2) с участием конститутивного фактора транскрипции Nrf2, который обычно нацелен на убиквитинирование и деградацию (этап 1). Различные окислительные и электрофильные стрессы могут стабилизировать Nrf2 путем окисления адаптивной молекулы kelch-подобного ECH-ассоциированного белка-1 (Keap1), что позволяет свободному Nrf2 транслоцироваться в ядро. Диаграмма показывает роль окислительного повреждения и увеличения митохондриальной продукции H 2 O 2 (этап 2) в стабилизации Nrf2 (этап 3) и активации генов, которые содержат консенсусную последовательность антиоксидантного элемента ответа (ARE) — в этом случае супероксиддисмутаза (SOD2) (стадия 4).
Изображение в полном размере
Внутриклеточные сигнальные механизмы от кислорода и активных форм кислорода (перекись водорода)
Недавняя работа показала, что H 2 O 2 важен как сигнальная молекула, несмотря на короткий биологический период полураспада молекулы, хотя многие вопросы остаются без ответа о том, как она функционирует. Основные нерешенные проблемы включают в себя то, как градиенты или каналы H 2 O 2 формируются и поддерживаются в клетках и органах для регулирования функции белка. H 2 O 2 также генерируется на плазматической мембране — например, при дисмутации супероксида, генерируемого NADPH-оксидазами, — где он играет важную роль в пролиферации клеток и других жизненно важных процессах. Поскольку H 2 O 2 легко проникает через мембраны, некоторые исследователи предположили, что эритроциты, которые богаты каталазой, защищают клетки, выполняя функции приемника внеклеточного H 2 O 2 (27).
Потому что ROS-индуцированная внутриклеточная передача сигналов является сложной; исследователи использовали первичные и трансформированные клеточные линии, которыми легко манипулировать, чтобы исследовать вклад H 2 O 2 в специфические физиологические функции. Количество H 2 O 2, необходимое для функционирования в качестве сигнальной молекулы в различных клеточных линиях, является областью неопределенности, но обычно она очень низкая. Низкие уровни H 2 O 2, генерируемые активацией многих рецепторов клеточной поверхности, включая трансформирующий фактор роста-1β, TNFα, колониестимулирующий фактор гранулоцитов-макрофагов, тромбоцитарный фактор роста и рецепторы, связанные с G-белком, способствуют окислительно-восстановительная регуляция и трансдукция сигнала (28–30). Внутриклеточный H 2 O 2 нацелен на специфические белки и меняет их состояния активации. Многие белки, которые содержат депротонированный остаток цистеина, могут быть окислительно-восстановительными и подвержены окислению H 2 O 2; однако большинство остатков цистеина во многих цитозольных белках протонируются из-за низкого pH в цитозоле и поэтому не вступают в реакцию с H 2 O 2 (31, 32). Этот эффект может, однако, придать некоторую специфичность, и некоторые белки непосредственно окислительно-восстановительные, такие как ионные каналы, р53 и аконитазы, либо по тиоловому механизму, либо по изменению окислительно-восстановительного состояния железа или других переходных металлов (33), Воздействие ROS приводит к обратимому окислению тиоловых групп ключевых остатков цистеина во многих нижестоящих белках, включая регуляторы транскрипции, киназы, Rho и RAS GTPases, фосфатазы, структурные белки, метаболические ферменты и лигазы SUMO.
Кислород друг и враг
 Воздух вокруг нас содержит 21% по объему кислорода (O2), газа, необходимого для жизни. Восемьдесят процентов или больше 02 расходуется на процессы аэробного дыхания, которое обеспечивает эффективную генерацию энергии в форме аденозинтрифосфата (АТФ) в митохондриях. Некоторая часть 02 используется ферментами, которые катализируют реакции синтеза гормона адреналина, кортикостероидов, нейтропередатчика допамина, гидроксилирование аминокислотных остатков при синтезе коллагена, необходимого для построения соединительной ткани. Для обезвреживания и выведения ксенобиотиков («чужеродных для живых организмов соединений) в том числе лекарства, промышленных химических вещества. пестицидов, токсинов системе цитохрома Р450 так же нужен 02.
Воздух вокруг нас содержит 21% по объему кислорода (O2), газа, необходимого для жизни. Восемьдесят процентов или больше 02 расходуется на процессы аэробного дыхания, которое обеспечивает эффективную генерацию энергии в форме аденозинтрифосфата (АТФ) в митохондриях. Некоторая часть 02 используется ферментами, которые катализируют реакции синтеза гормона адреналина, кортикостероидов, нейтропередатчика допамина, гидроксилирование аминокислотных остатков при синтезе коллагена, необходимого для построения соединительной ткани. Для обезвреживания и выведения ксенобиотиков («чужеродных для живых организмов соединений) в том числе лекарства, промышленных химических вещества. пестицидов, токсинов системе цитохрома Р450 так же нужен 02.
Нашу потребность в 02 омрачает тот факт, что это токсичный, мутагенный газ; мы выживаем в его присутствии только потому, что от его вредного воздействия имеем широкий спектр антиоксидантной защиты, которая и позволяют нам его безопасное использование. В дополнение к антиоксидантам, которые мы синтезируем сами ( «эндогенные антиоксиданты «), мы получаем их с пищей. Рацион человека богат антиоксидантами. В основном это растительная пища. Растения синтезируют много антиоксидантов, чтобы защитить себя от высокого уровня 02,который они образуют в процессе фотосинтеза
Некоторые из антиоксидантов нашего рациона имеют для нас важное значение (например, витамин Е), тогда как другие не существенны, но полезны (например, каротиноиды, флавоноиды)
Что делать
Даже несмотря на то, что свободные радикалы постоянно производятся организмом и попадают извне, существует много способов ограничить их повреждение и окислительный стресс.
Во-первых, надо снизить количество ежедневного стресса. Физиологический стресс, такой как тот, который испытывают в школе, на работе и в воспитании детей, увеличивает маркеры окислительного стресса и может укорачивать теломеры. Теломеры – это защитные последовательности на концах наших хромосом.
Во-вторых, нужно уделять приоритетное внимание сну. Во время сна организм восстанавливается, приводит в норму уровень гормонов и нейротрансмиттеров
Именно поэтому необходимо хорошо высыпаться.
В-третьих, необходимо улучшить питание и выбирать продукты, которые богаты антиоксидантами. Это поможет поддерживать правильный баланс между свободными радикалами и антиоксидантами. Вот список самых самых:
- Фиолетовый, красный и синий виноград.
- Черника.
- Малина и клубника.
- Орехи.
- Темно-зеленые овощи.
- Зеленый чай.
- Бобы.
- Рыба и морепродукты.
В-четвертых, занимайтесь спортом. Физические нагрузки снижают окислительный стресс, приводят организм в тонус и вообще, делают вас умнее. О том, как спорт влияет на ваш мозг, можно прочить в данной статье.
Откуда берутся свободные радикалы и другие АФК
Часть АФК образуется в организме под влиянием внутренних процессов — дыхании клетки, иммунного ответа, чрезмерной физической нагрузки. Другие АФК образуются из-за внешних факторов. Вот примеры таких факторов:
Табачный дым. Содержит супероксид и оксид азота. Вдыхание дыма в лёгкие активирует производство воспалительных цитокинов, которые выделяют ферменты, разрушающие соединительную ткань легких.
Процессы приготовления. При копчении мяса, приготовлении еды на масле с низкой устойчивостью к нагреванию образуются АФК.
Ионы металлов. Железо, медь, кадмий, ртуть, никель, свинец и мышьяк могут провоцировать производство свободных радикалов и окислять компоненты клетки напрямую.
Загрязнители окружающей среды. Оксид азота способствует производству АФК, переходные металлы окисляют компоненты клетки, озон окисляет жиры и запускает поток нейтрофилов в дыхательные пути, твердые частицы катализируют восстановление кислорода.
Лекарственные препараты. Циклоспорин и такролимус — иммунодепрессанты, применяются при пересадке органов для снижения риска отторжения, гентамицин — антибиотик широкого действия, блеомицин — используется при терапии рака приводят к повышенному производству АФК.
Промышленные растворители. Вдыхание паров растворителей провоцирует окислительный стресс сразу несколькими механизмами — некоторые компоненты метаболизируются в организме с образованием АФК, некоторые провоцируют воспаление, которое приводит к образованию АФК, некоторые компоненты содержат АФК и окисляют компоненты клеток напрямую.
Киназы и фосфатазы
Киназы фосфорилируют нижестоящие белки в активных внутриклеточных каскадах сигнальной трансдукции, обычно после стимуляции рецептора. Киназы могут быть активированы или ингибированы путем фосфорилирования, и известно, что некоторые из них являются редокс-регулируемыми, включая просурвивающие и проапоптотические киназы. Например, H 2 O 2 косвенно активирует просурвивальную киназу Akt / PKB (34). Акт, по-видимому, необходим для защиты хозяина от полиорганной дисфункции от сепсиса. Другая киназа — апоптоз-сигнальная киназа-1, член семейства митоген-активированных протеинкиназ киназ — киназ — активирует пути p38 и JNK путем прямого фосфорилирования и активации SEK1 (MKK4) / MKK7) и MKK3 / MKK6 (35, 36). Апоптоз-сигнальная киназа-1 активируется в ответ на цитотоксический стресс и в присутствии H 2 O 2, индуцированного TNFα в клетках HEK293 (37, 38). Эта киназа, вероятно, также играет роль во время сепсиса, но то, как H 2 O 2 удается стимулировать одну киназу, которая выживает, по сравнению с той, которая приводит к гибели клеток, является областью активного исследования. Хотя понимание природы окислительно-восстановительного контроля киназной активности находится на ранних стадиях, и как эти элементы управления затрагиваются в периоды серьезных мультисистемных стрессов, таких как сепсис или травма, только начинают появляться, ясно, что чрезмерное и неспецифическое производство H 2 O 2 в периоды окислительного стресса мешает специфичности окислительно-восстановительной регуляции. Не только редокс-регулируемые киназы регулируются, но и их дефосфорилирующие белковые аналоги (фосфатазы) могут стать инактивированными в ответ на повышенную внутриклеточную H 2 O 2. Фосфатазы часто дезактивируют специфические фосфопротеины, на которые воздействует киназа. Например, протеин тирозин фосфатазы-1B становится инактивированным в клетках эпидермоидной карциномы человека A431 в ответ на индуцированную эпидермальным фактором роста продукцию H 2 O 2 (39). Инсулин-индуцированная продукция H 2 O 2 также инактивирует протеинтирозинфосфатазу-1B (40). Было показано, что тромбоцитарный фактор роста индуцирует окисление внутриклеточной H 2 O 2 и ингибирует SH2-содержащую домен SH2-белок SH2-домен, содержащий домен SH2, в клетках Rat-1 (41). Гомолог фосфатазы и тензина также регулируется H 2 O 2 (42, 43). Как правило, инактивация фосфатазы приводит к неопосредованной активности реципрокной киназы; например, фосфоинозитид-3-киназа, которая активирует Akt / PKB, повсеместно распространенную киназу просурвивания. Функциональные требования к этим белкам во время критических заболеваний являются областью активного исследования.
Окислительная репарация (защита и пролиферация клеток): адаптация, кондиционирование и гормезис
Как упомянуто ранее, не весь окислительный стресс вреден для выживания клетки; на самом деле для оптимального здоровья может потребоваться определенное количество окислительного стресса. Наилучшим примером является, пожалуй, упражнение, которое вызывает выработку АФК с последующей скоординированной активацией специфических антиоксидантных ферментов, таких как SOD2. В течение многих лет было известно, что физические упражнения вызывают выработку АФК за пределами базальных уровней, хотя точные показатели, виды и количества неизвестны. Кроме того, производство АФК скелетных мышц во время упражнений влияет на другие органы, кроме мышц, включая печень, с помощью неизвестных, но, вероятно, косвенных механизмов (64).
Идея, что воздействие небольшой дозы опасного вещества может вызвать благоприятный биологический ответ, давно известный как гормезис, была применена к предполагаемым положительным эффектам H 2 O 2, генерируемым при физической нагрузке. Было показано, что усиление сократительной активности скелетных мышц приводит к образованию супероксида, оксида азота, пероксида водорода, гидроксильного радикала и пероксинитрита (65–69). Когда-то считалось, что митохондрии скелетных мышц являются единственным источником внутриклеточных АФК во время тренировок (70, 71); однако другие источники могут происходить из саркоплазматического ретикулума, плазматической мембраны или поперечных канальцев (72, 73). Стрессы мышечного сокращения во время упражнений, которые генерируют АФК, сопровождаются активацией каталазы, тиолов защитного белка и СОД (74). Диффузия H 2 O 2 через мембраны может привести к окислению белков / липидов в соседних клетках во время упражнений (75), но активная регуляция антиоксидантных ферментов, а также окислительно-восстановительная регуляция митохондриального биогенеза, вероятно, ответственны за многие преимущества, наблюдаемые при физической нагрузке. тренировка (76–78). Действительно, введение больших доз низкомолекулярных антиоксидантов перед тренировкой мешает митохондриальному биогенезу у людей (79).
Эти и аналогичные наблюдения в других модельных системах дают объяснение того, почему комплексные антиоксидантные добавки не являются терапевтической панацеей, на которую когда-то надеялись. Надеемся, что лучшее понимание того, как регулируются эти молекулярные пути, приведет к появлению новых мишеней для индукции внутриклеточной защиты и путей восстановления во время соответствующих критических болезненных состояний.




























