Техника взятия крови у КРС
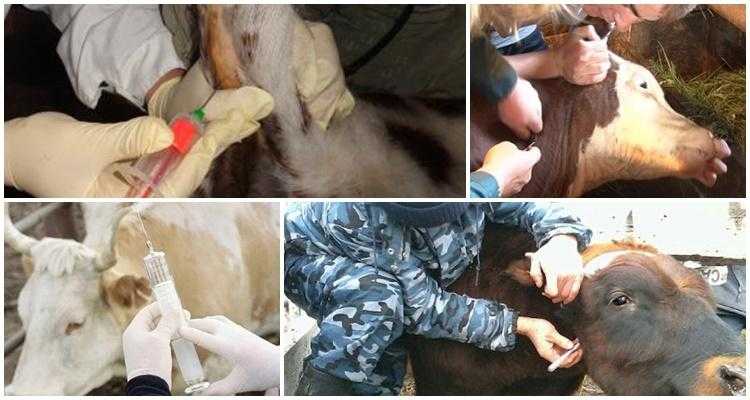
Забор крови у коров проводят из яремной, хвостовой или молочной вен. Работа в каждой зоне имеет свои особенности, обусловленные различным местоположением и скоростью кровотока.
Из яремной вены
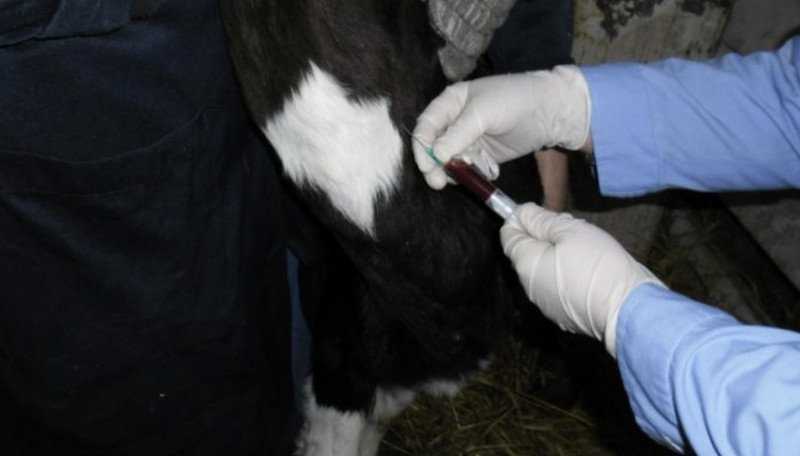
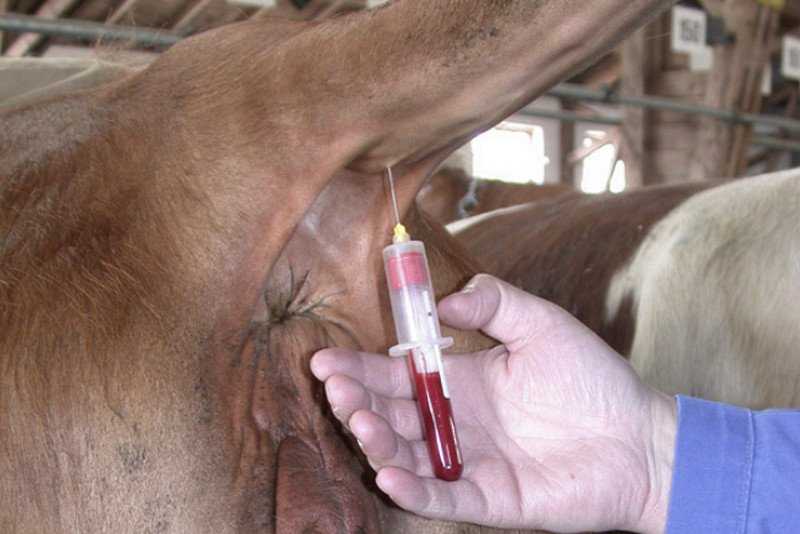
В соответствии с распространенной и устоявшейся методикой взятия крови у коров из яремной вены, используют кровопускательную иглу и стерильную пробирку, в которую набирают жидкость по стенке. Сосуд располагается в нижней трети шеи животного. Голову необходимо зафиксировать, что становится для коровы стрессовым фактором.
Техника забора крови из яремной вены:
- Фиксируют голову животного в неподвижном положении.
- Подготавливают нижнюю треть шейной зоны, удаляя излишки волос, дезинфицируют поверхность кожи спиртовым раствором.
- Зажимают большим пальцем руки сосуд.
- Вводят иглу в вену под острым углом к поверхности в направлении к голове. Глубина введения составляет 1 сантиметр.
- Собирают кровь в пробирку.
Материал, собранный таким способом, не стерилен, жидкость может разбрызгиваться.
Из молочной вены
Молочная вена располагается на животе коровы с двух сторон, сбоку от вымени. Она хорошо заметна у взрослых самок, но процесс забора осложняет высокая чувствительность данного участка тела и более глубокое залегание вены, чем кажется визуально.
Техника забора крови из молочной вены:
- Фиксируют и удерживают животное.
- Удаляют волосяной покров с прилегающей к вене области.
- Обрабатывают участок спиртовым раствором.
- Прощупывают пальцами руки венозный бугорок.
- Вводят иглу внутрь сосуда параллельно поверхности кожи.
- Набирают биоматериал.
Процедура для коровы неприятна и может стать причиной снижения удоев в результате полученного стресса. Сложный и травматичный для животного метод в современных условиях применяется редко.

Из хвостовой вены
Взятие крови из хвостовой вены проходит быстро, не требует принудительной фиксации животного и обычно легко им переносится. Современные методики нацелены на разработку приспособлений для забора материала именно с данного участка тела коровы.
Правила взятия крови из хвостовой вены:
- Берут рукой хвост коровы на середине длины и поднимают его вверх.
- Дезинфицируют спиртовым раствором область 2-5 позвонка и прилегающие участки.
- Берут стерильную иглу или готовую специальную систему в одну руку, другой – держат хвост.
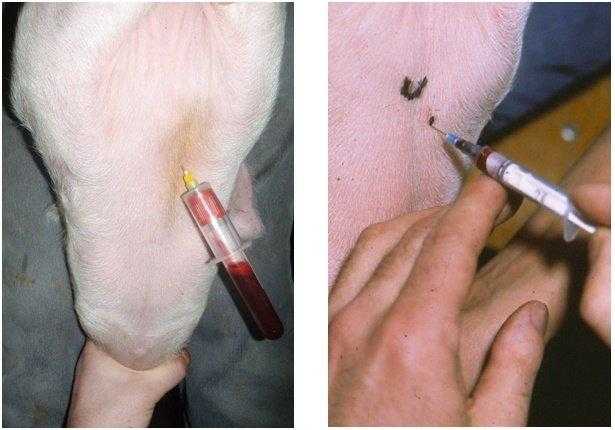
- Вводят иглу перпендикулярно по центру ширины хвоста на расстоянии около 10 сантиметров от его основания. Глубина введения составляет 0,5-1 сантиметр.
- Набирают материал.
Процедура исключает контакт человека с биологическими жидкостями скота, что считают одним из главных достоинств. Трудности при заборе создает медленный кровоток в сосуде, но современные вакуумные системы решают эту проблему, делая процедуру безопасной и эффективной.
Особенности вакуумного забора крови
Использование современных вакуумных систем для забора крови позволяет проводить процедуру КРС быстро и безопасно. Вакуумный способ хорошо работает на хвостовой вене. Процесс не травмирует корову, исключает прямой контакт человека и других животных с биоматериалом.
Система состоит из иглы и шприца-контейнера. Игла, имеющая оптимальный диаметр (обычно 0,9 миллиметра), снабжена клапаном, который исключает вытекание жидкости, что уменьшает вероятность возможных осложнений. Шприц, одновременно выполняющий функцию транспортного контейнера, сделан из прочного пластика. В нем же можно выделить сыворотку или добавить антикоагулянт.
Достоинства вакуумного метода:
- отсутствие необходимости фиксации животного;
- минимизация стрессового фактора для коровы;
- исключение прямого контакта человека с материалом;
- получение стерильной пробы;
- исключение непредвиденного риска распространения инфекции;
- удобство в использовании без переливаний образца в транспортную тару.
Маркировка вакуум-систем включает удобное на практике цветовое кодирование, что позволяет сортировать взятые пробы.
Способы взятия крови у коровы
Способов взять кровь у скота существует три. Они заключаются в получении образцов из яремной, молочной, хвостовой вены. Их нужно брать исключительно новой и стерильной иглой. Животное обязательно следует фиксировать в неподвижном положении, чтобы оно не травмировало само себя, не перевернуло пробирку. Перед процедурой нужно выстригать шерсть в области, где будет сделан укол, дезинфицировать поверхность раствором фенола, йодом или спиртом.
На пробирке с образцом должен присутствовать порядковый номер коровы. Ёмкость ни в коем случае нельзя трясти.
Важно!
Образцы, в которых можно увидеть сгустки, не подходят для проведения анализов.
Из яремной вены
Взятие крови из яремной вены является самым распространённым способом. Рекомендуется проводить процедуру рано утром, перед первой кормлением. Чтобы провести анализ нужно привязать голову бурёнки, зафиксировать её в неподвижном состоянии. Далее следует зажать вену в нижней трети шеи, потом вводить иглу под острым углом. Кончик иглы должен быть направлен к голове животного.
Плюсами такого способа являются:
- животное почти не травмируется;
- лёгкость произведения операции;
- быстрота проведения процедуры.
 Среди недостатков можно выделить:
Среди недостатков можно выделить:
- сильное разбрызгивание крови;
- появление риска распространения инфекций, которые опасны не только для животных, но и для человека;
- сложность фиксации коровы в определённом положении;
- частое возникновение осложнений, которые проявляются в виде абсцессов, гематом;
- стресс у коровы, который может привести к снижению удоя.
Знаете ли вы?
Одно из племён Эфиопии до сих пор проводит необычный ритуал с использованием коровьей крови — они добавляют её в молоко и пьют. Аборигены верят, что благодаря невероятной силе напитка, выпившие становятся больше и толще.
Из молочной вены
Забор образца из молочной вены происходит только у взрослых коров. Упомянутые вены находятся сбоку от вымени, тянутся по брюху снизу. Они снабжают молочную железу кровью и необходимыми питательными веществами. Чем лучше развиты вены, тем больше молока даёт бурёнка.
Животное необходимо зафиксировать. Чтобы провести процедуру правильно потребуется несколько человек. Для начала нужно сбрить или максимально состричь волосяной покров в месте укола и обработать участок спиртом или йодом. Перед вами должен быть виден своеобразный небольшой бугорок — это именно то место, куда следует делать укол
Иглу нужно вводить очень осторожно, чтобы не нанести вред животному. Она должна проходить немного под углом, до момента, пока не потечёт тёмная венозная кровь
Положительными сторонами данного метода являются:
- доступная цена материалов, необходимых для проведения процедуры;
- высокая скорость сбора образца;
- меньшее разбрызгивание, чем при взятии образца из яремной вены.
Минусов у такого способа значительно больше, чем плюсов:
- высокий риск травмировать животное;
- контакт с кровью коровы;
- во время процедуры тёлка испытывает огромный стресс, потому что забор образца проводится в очень нежной зоне, которую животное постоянно оберегает;
- сложность проведения процедуры.
Из хвостовой вены
Из хвостовой вены брать образец наиболее безопасно. Сейчас всё более популярным становится использование вакуумных систем — это специально сконструированные пробирки, в которых уже присутствует нужный антикоагулянт и снижено давление, чтобы кровь плавно вытекала в ёмкость.
Для осуществления забора образца из хвостовой вены необходимо продезинфицировать место укола. Далее медленно приподнять хвост, удерживая его за среднюю треть. Чтобы процедура прошла наиболее гладко, следует выбрать место на уровне от двух до пяти позвонков, которое делит хвост вдоль на две равные части. Укол должен быть плавным, под углом в 90 градусов. Иглу вводят до упора.
Из явных положительных сторон этого метода можно выделить:
- полученный образец стерилен;
- риск образования сгустков в пробирке значительно снижен;
- не требуется фиксировать животное;
- очень высокая скорость проведения процедуры. Один ветеринар может за час взять до двух сотен образцов;
- крайне малый шанс возникновения побочных эффектов или травм у коровы;
- исключение непосредственного контакта с кровью;
- корова не испытывает стресса и привычный удой сохраняется.
 Минусами упомянутого способа забора крови являются:
Минусами упомянутого способа забора крови являются:
- более высокая стоимость оборудования;
- низкая популярность упомянутого метода.
Знаете ли вы?
Коровы вырабатывают до 150 литров слюны в день.
Биохимические показатели крови у коров в норме
При проведении биохимического анализа крови выделяют несколько основных показателей, которые являются наиболее важными при ведении молочного и мясного хозяйства. Чтобы лучше понимать, как должны выглядеть идеальные анализы, следует знать таблицу норм.
1. ПОЛУЧЕНИЕ КРОВИ У ЖИВОТНЫХ Для взятия крови у животных производят обработку операционного поля (выстригание или выбривание волосяного покрова, протирание кожи спиртом и эфиром), а затем надрезают (прокалывают) кровеносный сосуд или вводят в него иглу, предварительно подвергнутую стерилизации (рис.1). Принудительной фиксации животных при взятии крови следует, по возможности, избегать. Для получения крови у мелких животных и птиц иногда прибегают к пункции желудочков сердца.
Лошади, крупный и мелкий рогатый скот.
Небольшие количества крови для анализа у лошадей и рогатого скота получают из ушной вены путем ее надреза или прокола инъекционной иглой. Выступившую кровь насасывают в пипетку или собирают по каплям на часовое стекло, предварительно промытое антикоагулянтом. У овец можно производить, кроме того, пункцию кожной вены, расположенной под внутренним углом глаза.
Для получения больших количеств крови производят пункцию яремной вены на границе верхней и средней трети шеи. После фиксации животного большим пальцем левой руки сдавливают вену ниже места пункции (у крупного и мелкого рогатого скота накладывают резиновый жгут), а затем прокалывают кровопускательной или инфузионной иглой кожу и стенку вены. Иглу вводят против тока крови под углом 45° (рис. 2). Кровь собирают в стерильный сосуд. Для получения крови из глубоко расположенных сосудов (воротной, печеночной, задней полой, общей брыжеечной, рубцовой и др. вен) производят их катетеризацию с помощью нейлоновых или тефлоновых катетеров.
Для взятия крови у крупных животных используют приборы-автоматы. Они имеют разную конструкцию, но в состав их обязательно входят корпус, иглодержатель, держатели для пробирок, ударный механизм с пружиной. (рис. 3).
Свиньи.
У свиней малые количества крови получают путем надреза скальпелем большой ушной вены. Центральный конец сосуда у корня уха зажимают при этом пальцами. Для получения больших количеств крови отсекают ножницами или скальпелем отрезок хвоста длиной 1 – 1,5 см. По окончании кровопускания рану дезинфицируют, а кончик хвоста сдавливают резиновым кольцом или перетягивают бинтом на 1-2 суток. У поросят рекомендуют получать кровь путем прокола иглой или микропипеткой орбитального венозного синуса. Животное при этом фиксируют лежа, в спинном положении. За один раз берут от 5 до 30 мл крови.
Рис. 1. Иглы для взятия крови. А-Г –
из уха и пальца; Д-Ж –
из вены.
1 — съемное лезвие иглы Франка, 2 –
головка, 3 –подвижная гайка, 4 –
курок
Собаки.
Небольшие количества крови у собак (кошек) получают путем надреза края уха или прокола мягкой части ступни. Для получения больших порций крови производят пункцию передненаружной плюсневой вены, расположенной на наружной поверхности голени. Животное кладут на бок или фиксируют в станке; конечности сдавливают руками или жгутом ниже коленного сустава. Иглой прокалывают сначала кожу, затем стенку вены. Кровь насасывают в шприц.
Для чего делают биохимический анализ крови у КРС
Анализ проводится для того, чтобы выявить у животного нарушения обмена веществ, недостаток каких-либо полезных веществ в организме. С помощью этой процедуры можно вовремя заметить развитие лейкоза, определить, каким именно инфекционным заболеванием заразилось животное.
Кровь разносит по организму все полезные вещества, витамины и минералы. От того, насколько правильно и быстро осуществляется кровоток, зависит не только общее состояние животного, но и количество получаемого молока.

Если результат анализа показал нехватку нутриентов, фермер может предпринять определённые действия, такие как изменение рациона, добавление в него витаминных смесей, лекарств и прочего.
Переработка крови для кормовых целей
ПРЕДВАРИТЕЛЬНАЯ ОБРАБОТКА КРОВИ ДЛЯ КОРМОВЫХ И ТЕХНИЧЕСКИХ ЦЕЛЕЙ
На выработку кормовых и технических продуктов используют кровь, допущенную на эти цели органами ветеринарного надзора. Применение крови больных животных для выработки кормовых и технических продуктов допускается только с разрешения органов ветеринарного надзора в соответствии с ветеринарно-санитарными правилами.
Кровь передают на переработку по массе. Количество крови определяют расчетно, умножая объем передаваемой крови из емкости на плотность крови.
Дефибринирование свернувшейся крови — часть 1
Дефибринирование свернувшейся крови предусматривает ее измельчение и фильтрацию для отделения сгустков. В отдельных случаях фильтрацию не производят, так как свернувшуюся кровь подвергают тонкому измельчению и направляют на последующие операции.
Измельчение. Для осуществления процесса дефибринирования кровь из сборника самотеком или с помощью насосов подают на измельчение. Для измельчения свернувшейся крови используют мельницы П-47-1 или МИК-1.
Мельница П-47-1 (рис. 16) состоит из чугунного корпуса с двумя торцевыми крышками — задней и,передней. В задней крышке на двух радиально-сферических подшипниках установлен вал, приво-димый во вращение шкивом от ременной передачи. На приводном валу внутри корпуса консольно установлен стальной ротор. На роторе кон-центрично в 3 ряда закреплены кулачковые пальцы для измельчения сгустков, наружный ряд пальцев Т-образной формы измельчает сгустки и продавливает их вместе с кровью через установленный в корпусе мельницы сетчатый барабан с отверстиями диаметром 2 мм. Между барабаном и кромками наружного края пальцев ротора имеется минимальный зазор, позволяющий осуществлять перетирание и вдавливание крови в отверстия барабана.
На передней откидной крышке имеются загрузочная воронка с отверстием для поступления крови, расположенным против центра вращающегося ротора, и 2 ряда неподвижных пальцев, расположенных между кулачковыми пальцами. При попадании сгустка крови между вращающимися пальцами ротора и неподвижными пальцами передней крышки фибриновые нити разрываются и измельчаются до размеров, позволяющих им пройти через отверстия сетчатого барабана.
В процессе работы мельницы кровь из сборной емкости равномерно подается в загрузочную воронку и после измельчения сгустков выливается через разгрузочный люк, расположенный в нижней части корпуса машины. Выходящая жидкость представляет собой дефибриниро-ванную кровь с примесью измельченного фибрина, который в дальнейшем удаляют.
Достоинство машины заключается в том, что она обеспечивает непрерывный прием и отвод крови. К^недостаткам можно отнести то, что при дефибринировании происходит значительный гемолиз, в результате чего кровь уже нельзя разделить на фракции (что осуществляют при сепарировании пищевой крови).
Рис. 16. Мельница П-47-1: 1 — корпус; 2 — неподвижные пальцы; 3 — загрузочная воронка; 4 — отверстие; 5 — разгрузочный люк; 6 — пальцы; 7 — наружные пальцы; 8 — ротор; 9 — шкив; 10 — задняя крышка; 11 — передняя крышка; 12 — вал; 13 — подшипник; 14 -сетчатый барабан
Техническая характеристика мельницы П-47-1
КРОВИ И ФИБРИНА
Если выделить из крови фибриноген механическим путем, то такая кровь теряет способность к свертыванию. Она содержит все составные части, за исключением
фибриногена, и называется дефибринированной
кровью.
Цель опыта:
1) изучить соотношение и взаимосвязь составных частей крови, 2) получить плазму, сыворотку, дефибринированную кровь и фибрин.
Подготовка опыта:
Лошадь зафиксировать в станке. Подготовить операционное поле для пункции яремной вены: Заготовить иглы или автомат для взятия крови, стеклянные цилиндры на 10 – 20 мл, пробирки химические и центрифужные в штативе, колбочку на 50 – 100 мл, стеклянные шарики и антикоагулянты.
В качестве антикоагулянтов можно использовать порошок лимоннокислого или щавелевокислого натрия (20–30 мг на 10 мл крови), раствор щавелевокислого калия и щавелевокислого аммония (7,0г оксалата калия, 4,5г оксалата аммония, 100мл воды) в дозе 0,2 мл на 10 мл крови, этилендиамин тетраусусную кислоту – ЭДТУ в дозе 0,2 мл 0,01% раствора на 10 мл крови. Na-ЭДТУ в дозе 0,5–1 мг на 5 мл крови. Одним из естес твенных антикоагулянтов является полисаха рид гепарин, содержащийся почти во всех тканях организма. Его используют в колич естве 100 ед на 1 мл крови (примерно 2 капли неразведенного гепарина на 10 мл крови).
Рис. 5. Схема основных
Составных частей крови
Ход опыта:
1. В пробирку и цилиндр с антикоагулянтом выпустить по 10 мл крови из яремной вены животного. Закрыв сосуд пальцем или пробкой несколько раз перевернуть его для перемешивания крови. Цилиндр поставить в термостат (кровь лошади – на 1 ч, крупного рогатого скота – на 24-48 ч), пробирку – в центрифугу. Центрифугировать при 3000 об/мин в течение 20-30 мин. Убедиться, что при стоянии или центрифугировании кровь расслаивается на плазму и форменные элементы.
2. В пробирку или цилиндр без антикоагулянта выпустить 10 мл крови животного и поставить ее в термостат при 38°С на несколько часов. Образование кровяного сгустка и частичная ретракция, т.е. его стягивание и самопроизвольное отделение сыворотки, наступает у лошади через 1-3 ч, а полное отделение сгустка – через 12-18 ч. У крупного рогатого скота ретракция протекает значительно медленнее. Из пробирки с полной ретракцией сгустка слить или отсосать сыворотку и сравнить ее с плазмой. Сыворотка имеет желтовато-соломенный цвет и более прозрачна, чем плазма.
3. Положить в стеклянную колбочку 10–12 стеклянных бусинок и выпустить в нее из сосуда животного 20-30 мл крови. Взбалтывать кровь вращательными движениями в течение 10-15 мин. Фибриноген, выпадающий в осадок в виде волокнистых нитей фибрина, оседает на шариках. Профильтровать содержимое колбы через 2 слоя марли. Фильтрат представляет собой дефибринированную кровь, содержащую сыворотку и форменные элементы.
4. Осевшие на шариках нити фибрина отмыть от форменных элементов теплой водой. Он имеет вид белого волокнистого вещества.
5. Определить содержание фибриногена в крови. С этой целы сначала необходимо получить цитратную плазму. В пробирку налить 1 мл 3,8% раствора лимоннокислого натрия и прилить 9 мл крови. Перемешать и отцентрифугировать в течение 20-30 мин при 3000 об/мин. Из полученного слоя плазмы отмерить 1 мл, перенести в другую пробирку, прибавить 0,4 мл 5% раствора CaCl 2 и встряхнуть. После свертывания плазмы образовавшийся сгусток фибрина намотать на стеклянную палочку и, вынув из пробирки, поместить на беззольный фильтр. Сжимая фильтр, получить воздушно-сухой остаток фибрина, который взвесить на торзионных весах. В норме в 1 мл цитратной крови содержится 6-9 мг воздушно-сухого фибрина. При пониженном содержании фибриногена может нарушаться свертываемость крови.






























