Значение размера молекулы
Размер молекулы – это один из ключевых параметров, определяющих ее свойства и взаимодействия с другими молекулами.
Размер молекулы имеет важное значение в различных областях науки и технологии:
- В биологии и медицине размер молекулы играет роль в определении структуры белков и генетического материала, в формировании лекарственных препаратов и в процессах обмена веществ в организмах.
- В химии размер молекулы влияет на ее реакционную способность, степень растворимости, возможность образования связей с другими молекулами.
- В физике размер молекулы определяет ее массу, объем и отражает структуру вещества.
- В материаловедении размер молекулы влияет на прочность, упругость и другие механические свойства материалов.
Для описания размера молекул используется несколько понятий и показателей:
- Радиус молекулы – расстояние от ее центра до самой дальней точки на поверхности. Обычно измеряется в ангстремах (Å).
- Диаметр молекулы – двойная величина радиуса, измеряемая также в ангстремах (Å).
- Масса молекулы – сумма масс атомов, из которых она состоит, измеряется в атомных единицах массы (а.е.м).
Знание размера молекулы позволяет улучшить понимание химических и физических процессов, контролировать качество и свойства материалов, а также разрабатывать новые технологии и препараты.
Структура атома
Атомы состоят из еще меньших, чем они сами, частиц, называемых элементарными. Центром атома является его ядро. Оно состоит из элементарных частиц двух видов — протонов и нейтронов. Есть в атоме также другие элементарные частицы — электроны; они вращаются вокруг ядра. Существует множество разных элементарных частиц. Ученые считают, что протоны и нейтроны состоят из кварков. Элементарные частицы, входящие в состав атома, удерживаются вместе благодаря своим электрическим зарядам. Протоны заряжены положительно, а электроны — отрицательно. Нейтроны заряда не имеют, т.е. являются электрически нейтральными. Частицы, несущие противоположные электрические заряды, притягиваются друг к другу. Притяжение отрицательно заряженных электронов к положительно заряженным протонам, находящимся в атомном ядре, удерживает электроны на орбитах около этого ядра. В состав атома входит одинаковое число положительно заряженных протонов и отрицательно заряженных электронов, и атом электрически нейтрален.
Электроны в атоме находятся на разных энергетических уровнях, или оболочках. Каждая оболочка состоит из определенного числа электронов. Когда очередная оболочка заполняется, новые электроны попадают на следующую оболочку. Большую часть объема атома занимает пустое пространство между элементарными частицами. Отрицательно заряженные электроны удерживаются на своих энергетических уровнях силой притяжения к положительно заряженным протонам ядра.
Строение атома часто описывают строгой диаграммой, однако сегодня ученые полагают, что электроны существуют на своих орбитах в размытом состоянии. Это представление отражено на рисунке, где электронные орбиты представлены в виде «облаков». Так вы бы увидели молекулу под электронным микроскопом. Равными цветами показаны разные уровни плотности электронов. Бирюзовым цветом отмечена область наибольшей плотности.
Особенности строения, масса молекулы
Особенности строения молекулы
Центральным положением классической теории является положение о химической связи. Природа химической связи в классической теории не рассматривается — учитываются лишь такие характеристики, как валентные углы, углы между плоскостями, образованными тройками ядер, длины связей и их энергии.
Таким образом, молекула в классической теории представляется динамической системой, в которой атомы рассматриваются как материальные точки. В данной системе атомы и связанные группы атомов могут совершать механические вращательные и колебательные движения.
Молекула состоит из атомов, а если точнее — из атомных ядер, окруженных определенным числом внутренних электронов, и из внешних валентных электронов, образующих химические связи. Внутренние электроны атомов обычно не участвуют в образовании химических связей. Состав и строение молекул вещества не зависят от способа его получения.
Атомы объединяются в молекуле в большинстве случаев с помощью химических связей. Как правило, такая связь образуется одной, двумя или тремя парами электронов, находящихся в совместном владении двух атомов, образуя общее электронное облако, форма которого описывается типом гибридизации. Молекула может иметь положительно и отрицательно заряженные атомы (ионы).
Состав молекулы передается химическими формулами — краткой записью, которая устанавливается на основе атомного соотношения элементов вещества и молекулярной массы.
Каждому атому в определенном валентном состоянии в молекуле можно приписать определенный атомный, или ковалентный радиус (в случае ионной связи — ионный радиус), характеризующий размеры электронной оболочки атома (иона), образующего химическую связь в молекуле. Размер электронной оболочки молекулы является условной величиной.
Молекулы состоят из электронов и атомных ядер. Расположение последних в молекуле передает структурная формула (для передачи состава используется брутто-формула).
К веществам, сохраняющим молекулярную структуру в твердом состоянии, относятся: вода, оксид углерода (IV), многие органические вещества. Они характеризуются низкими температурами плавления и кипения. Большинство же твердых (кристаллических) неорганических веществ состоят не из молекул, а из других частиц (ионов, атомов) и существуют в виде макротел (кристалл хлорида натрия, кусок меди и т. д.).
Рис.1. Модель молекулы воды.
Масса молекулы
Молекулы относительно высокой молекулярной массы, состоящие из повторяющихся низкомолекулярных фрагментов, называются макромолекулами. Молекулы белков и некоторых искусственно синтезированных соединений могут содержать сотни тысяч атомов, которые и представляют собой макромолекулы.
Определение молекулы
Молекула — наименьшая единица вещества, сохраняющая его химические свойства и обладающая массой и объемом.
Молекулы могут быть образованы одним или несколькими атомами, связанными между собой химическими связями. Атомы в молекуле могут быть одного или разных элементов.
Молекула является структурной единицей химического соединения и имеет определенную форму и размеры. Форма молекулы может быть линейной, кольцевой или трехмерной, в зависимости от связей между атомами.
Молекульные размеры характеризуются длиной связей между атомами и углами между ними. Для определения молекулярных размеров часто используются методы рентгеноструктурного анализа или спектрального анализа.
Молекулы могут быть разных размеров, от маленьких органических молекул до крупных биологических макромолекул, таких как ДНК и белки. Размеры молекул варьируются от доли нанометра до нескольких нанометров.
Молекулярные размеры имеют важное значение во многих областях науки и технологии, таких как фармацевтика, полупроводниковая промышленность и материаловедение. Понимание молекулярных размеров помогает разрабатывать новые материалы, прогнозировать их свойства и улучшать существующие технологии
Большая молекула
Большие молекулы, состоящие из аминокислот, — полипептиды и белки, по-видимому, менее склонны к распаду на составляющие их единицы, чем молекулы меньшей величины, состоящие из двух или трех аминокислот.
Большие молекулы могут одновременно обладать противоположными качествами. Они могут быть в одно и то же время стойкими и изменчивыми. Каким же образом это достигается.
Большие молекулы, обладающие низкой симметрией, как правило, дают сложные спектры, но и в этом случае удается получить полезные сведения, не проводя детального анализа спектра ЯМР и не идентифицируя все пики.
Большие молекулы занимают на поверхности большую площадь, чем малые.
Большая молекула может адсорбироваться предпочтительно или более легко подвергаться каталитической реакции, если она способна сесть на поверхность, так, чтобы ее атомы расположились особенно благоприятным образом по отношению к плоской решетке атомов поверхности твердого тела. Эта теория была успешно использована для интерпретации многих работ по дегидрированию и сходным реакциям. Баландин, однако, отрицал необходимость хемосорбции реагирующих веществ; предполагалось, что катализ осуществляется под действием физических сил, но эта точка зрения не получила общего признания.
|
Часть фотоэлектронного спектра ферроцена, записанного с помощью электростатического секторного анализатора с углом отклонения 127. |
Большие молекулы, в особенности органические, можно исследовать этим методом, если вещество обладает достаточной летучестью.
Большая молекула, составленная из остатков мономеров, называется макромолекулой или полимерной цепью, а сами остатки — звеньями.
Большие молекулы ( макромолекулы) термопластов имеют линейную или слабо разветвленную структуру.
Большие молекулы более поляризуемы, чем малые. Это связано с числом электронов.
|
Диаграмма состояния воды. |
Большие молекулы неэлектролитов образуют в структуре воды большие полости, аналогичные по структуре кристаллогидратам. Энергия, необходимая для образования таких полостей, выделяется при разрыве водородных связей между молекулами. Каждая молекула неэлектролита может связывать большое количество молекул воды.
Большие молекулы полимерных веществ, так называемые макромолекулы, имеют либо линейную ( цепную), либо разветвленную структуру. Характерной особенностью этих макромолекул, отличающих их от молекул низкомолекулярных соединений, является гибкость.
Большие молекулы полимерных веществ, так называемые макромолекулы, имеют либо линейную ( цепную), либо разветвленную структуру. Характерной особенностью этих макромолекул, отличающих их от молекул низкомолекулярных соединений, является гибкость. Но она утрачивается у полимерных веществ, обладающих трехмерной пространственной структурой. Весь образец полимера с такой структурой представляет собой единую пространственную макромолекулу.
Большие молекулы стабилизирующих добавок затрудняют процесс кристаллизации полимера при формировании покрытия. В процессе эксплуатации происходит дополнительная кристаллизация, уплотнение материала в микрообъемах, появляются напряжения, приводящие к растрескиванию покрытия. Уменьшение — внутренних кристаллизационных напряжений достигается регулированием надмолекулярной структуры, например совмещением полимеров с гибкими макромолекулами с полимерами, имеющими жесткие молекулярные цепи.
Химические формулы
Химическая формула вещества показывает, сколько атомов каких элементов входит в состав одной молекулы. Каждый атом обозначается символом. Как правило, в качестве символа выбирается первая буква английского, латинского или арабского названия элемента. Например, молекула углекислою газа состоит из двух атомов кислорода и одного атома углерода, поэтому формула углекислого газа СО2. Двойка Атомы обозначает число атомов кислорода в молекуле.
Этот опыт продемонстрирует вам, что молекулы вещества удерживаются вместе силами притяжения. Наполните стакан водой до краев
Осторожно опустите в стакан несколько монет. Вы увидите, что над краями стакана приподнялся водяной купол
Сила, притягивающая молекулы воды друг к другу, может удержать некоторое количество воды над краями стакана. Эта сила называется силой поверхностного натяжения.
Глава 1. Первоначальные сведения о строении вещества§ 8. Молекулы
Все вещества состоят из отдельных частиц, между которыми есть промежутки, — это предположение было доказано современной наукой. Частицы были названы молекулами (в переводе с латинского «маленькая масса»).
Молекула вещества — это мельчайшая частица данного вещества.
Например, самая маленькая частица воды — молекула воды. Наименьшей частицей сахара является молекула сахара.
Попытаемся представить себе, каковы размеры молекул.
Если бы можно было уложить в один ряд вплотную друг к другу 10 000 000 (или 107) молекул воды, то получилась бы ниточка длиной всего в 2 мм. Малый размер молекул позволяет получить тонкие плёнки различных веществ. Капля масла, например, может растекаться по воде слоем толщиной всего в 0,000002 м (или 2 • 10-6 м).

Электронный микроскоп позволяет получать изображения с увеличением до 106 раз
Даже небольшие тела состоят из огромного числа молекул. Так, например, в крупинке сахара содержится очень большое число молекул. Подсчитано, что в 1 см3 воздуха находится около 27 • 1O18 молекул. Чтобы понять, насколько велико это число, представим следующее. Через маленькое отверстие пропускают по миллиону молекул в секунду, тогда указанное количество молекул пройдёт через отверстие за 840 000 лет.
Из-за очень малых размеров молекулы невидимы невооружённым глазом или в обычные микроскопы. Ho при помощи специального прибора — электронного микроскопа — удаётся сфотографировать наиболее крупные из них
На рисунке 21 показано расположение молекул белка, являющегося важной частью питания организма человека и животных.
Рис. 21. Молекула белка под микроскопом
Окружающие нас тела, даже похожие на первый взгляд, будут различны. В природе вы не встретите двух совершенно одинаковых снежинок или песчинок, людей, животных и пр.
Учёные с помощью опытов доказали, что молекулы разных веществ отличаются друг от друга, а молекулы одного и того же вещества одинаковы. Например, воду, полученную из сока или молока, нельзя отличить от воды, полученной путём перегонки из морской воды. Молекулы воды одинаковы. Из таких молекул не может состоять никакое другое вещество.
Молекулы, в свою очередь, состоят из ещё более мелких частиц — атомов (в переводе с греческого «неделимый»).
Например, наименьшая частица воды — это молекула воды. Она состоит из трёх атомов: двух атомов водорода и одного атома кислорода. Из курса химии вы узнаете, что любое вещество имеет своё обозначение, так, воду обозначают H2O, где H — атом водорода, О — атом кислорода.
Молекулы принято изображать схематически, т. е. с помощью моделей молекул. Две молекулы воды показаны на рисунке 22, а. Если разделить две молекулы воды, то образуется два атома кислорода и четыре атома водорода. На рисунке 22, б показано, что каждые два атома водорода могут соединиться в молекулу водорода, а атомы кислорода — в молекулу кислорода.
Рис. 22. Схематическое изображение: а — молекул воды; б — молекул водорода и кислорода
Вопросы:
1. Что такое молекула?
2. Что вы знаете о размерах молекул?
3. Из каких частиц состоит молекула воды?
4. Как изображается схематически молекула воды?
Предыдущая страницаСледующая страница
Что такое молекула в химии
Учение о молекулах для химической науки является одним из самых главных. Именно химические исследования дали важнейшие сведения о составе и свойствах этой мельчайшей единицы вещества.
При прохождении химического превращения молекулы обмениваются атомами, распадаются. Поэтому знания о строении и состоянии этих частиц лежат в основе изучения химии веществ и их превращений.
На основании знаний о проходящей химической реакции можно предсказать строение молекул веществ, в ней участвующих. Противоположное заключение тоже будет верным: на основании сведений о строении молекулы вещества реально предсказать его поведение во время химической реакции.
Основные понятия размера
Размер молекулы — один из важных параметров, определяющих ее свойства и взаимодействия с другими молекулами. В физике и химии существует несколько понятий и классификаций молекулярных размеров, включая радиус гибридизации, радиус Ван-дер-Ваальса и диаметр гибкости.
- Радиус гибридизации — это понятие, используемое в описании структуры и формы молекулы. Он определяет радиус сферического объема, в котором находятся атомы, участвующие в химической связи.
- Радиус Ван-дер-Ваальса — это понятие, используемое для описания взаимодействия молекул в газообразном или конденсированном состоянии. Радиус Ван-дер-Ваальса определяет минимально допустимое расстояние между центрами двух молекул, при котором силы притяжения и отталкивания находятся в равновесии.
- Диаметр гибкости — это понятие, используемое для описания молекулярных цепей и полимеров. Он определяет максимальное расстояние между двумя атомами в цепи, при котором сохраняется их соседство и сохраняется молекулярная структура.
Размеры молекул имеют большое значение при изучении физических и химических свойств вещества, особенно при рассмотрении молекулярной структуры и элементарных процессов, таких как диффузия, реакции и взаимодействия между молекулами.
Состав и виды молекул
Молекулы относительно высокой молекулярной массы, состоящие из повторяющихся низкомолекулярных фрагментов, называются макромолекулами. Молекулы белков и некоторых искусственно синтезированных соединений могут содержать сотни тысяч атомов, которые и представляют собой макромолекулы.
Макромолекулы чаще всего встречаются в биологии. Рассмотрим некоторые примеры таких молекул.
Молекула может иметь совсем другие свойства, чем атомы, из которых она состоит. Например, сахар (глюкоза или сахароза) представляет собой комбинацию атомов. В него входят кислород, углерод и водород. Углерод в отдельности может представлять собой серое твердое вещество, а кислород и водород — оба газы.
Образуя между собой ковалентные связи, эти атомы создают сладкое питательное вещество, богатое энергией, которое многим животным помогает выжить.
В биологии много других примеров макромолекул, например, РНК, ДНК, ферменты, иммуноглобулин, гемоглобин и др.
Также макромолекулами называют полимерные соединения, которые могут быть синтезированы из множества мономеров и составлять большие и длинные цепи.
Свойства молекулы
Современная наука выделяет следующие свойства молекул:
Электрические — этими свойствами определяется то, как ведет себя вещество в электрическом поле. Атомы, входящие в состав молекулы, состоят, в свою очередь, из положительно заряженного ядра и электронов, несущих отрицательный заряд. Эти заряды внутри самой молекулы располагаются неравномерно, в связи с этим возникает так называемый дипольный момент и смещение электронной плотности в сторону одного из атомов.
Оптические — дают характеристику того, как ведет себя вещество в поле световой волны. К оптическим свойствам относят способность поляризовать свет, преломлять его и рассеивать.
Магнитные — объясняются распределением электронов в атомах.
диамагнитные — парных электронов нет;
парамагнитные — имеются непарные электроны.
Знания о свойствах и строении молекул являются основополагающими для развития теоретических и прикладных наук и играют важную роль в жизни человека.
https://youtube.com/watch?v=tbHvc7NsyYs
-
Менеджмент как особый вид человеческой деятельности реферат
-
Влажность как экологический фактор реферат
-
Взаимосвязь финансовой стратегии и стадии жизненного цикла организации реферат
-
Реферат сутеев владимир григорьевич
- Лесоводственно географические особенности лесов россии реферат
Примеры молекул
| Вода: H20 | Сахароза: C12ЧАС22ИЛИ11 |
| Водород: H2 | Пропанал: C3ЧАС8ИЛИ |
| Кислород: O2 | Пропенал: C3ЧАС6ИЛИ |
| Метан: CH4 | Парааминобензойная кислота: C7ЧАС7Нет2 |
| Хлор: Cl2 | Фтор: F2 |
| Соляная кислота: HCl | Бутан: C4ЧАС10 |
| Двуокись углерода: CO2 | Ацетон: C3ЧАС6ИЛИ |
| Окись углерода: CO | Ацетилсалициловая кислота: C9ЧАС8ИЛИ4 |
| Гидроксид лития: LiOH | Этановая кислота: C2ЧАС4ИЛИ2 |
| Бром: Br2 | Целлюлоза: C6ЧАС10ИЛИ5 |
| Йод: I2 | Декстроза: C6ЧАС12ИЛИ6 |
| Аммоний: NH4 | Тринитротолуол: C7ЧАС5N3ИЛИ6 |
| Серная кислота: H2ЮЗ4 | Рибоза: C5ЧАС10ИЛИ5 |
| Пропан: C3ЧАС8 | Метаналь: CH2ИЛИ |
| Гидроксид натрия: NaOH | Нитрат серебра: AgNO3 |
| Хлорид натрия: NaCl | Цианид натрия: NaCN |
| Диоксид серы: SO2 | Бромистоводородная кислота: HBr |
| Сульфат кальция: CaSO4 | Галактоза: C6ЧАС12ИЛИ6 |
| Этанол: C2ЧАС5ой | Азотистая кислота: HNO2 |
| Фосфорная кислота: H3PO4 | Кремнезем: SiO2 |
| Фуллерен: C60 | Тиопентат натрия: C11ЧАС17N2ИЛИ2SNa |
| Глюкоза: C6ЧАС12ИЛИ6 | Барбитуровая кислота: C4ЧАС4N2ИЛИ3 |
| Кислый сульфат натрия: NaHSO4 | Мочевина: CO (NH2)2 |
| Трифторид бора: BF3 | Хлорид аммония: NH2Cl |
| Хлороформ: CHCl3 | Аммиак: NH3 |
Молекулы беспорядочно движутся
2) Молекулы находятся в непрерывном беспорядочном (тепловом) движении.
Вид теплового движения (поступательное, колебательное, вращательное) молекул зависит от характера их взаимодействия и изменяется при переходе вещества из одного агрегатного состояния в другое. Интенсивность теплового движения зависит и от температуры тела.
Приведем некоторые из доказательств беспорядочного (хаотического) движения молекул: а) стремление газа занять весь предоставленный ему объем; б) диффузия; в) броуновское движение.
Диффузия
Диффузия — самопроизвольное взаимное проникновение молекул соприкасающихся веществ, приводящее к выравниванию концентрации вещества по всему объему. При диффузии молекулы граничащих между собой тел, находясь в непрерывном движении, проникают в межмолекулярные промежутки друг друга и распределяются между ними.
Диффузия проявляется во всех телах — в газах, жидкостях, твердых телах, но в разной степени.
Диффузию в газах можно обнаружить, если, например, сосуд с пахучим газом открыть в помещении. Через некоторое время газ распространится по всему помещению.
Диффузия в жидкостях происходит значительно медленнее, чем в газах
Например, если в стакан налить сначала слой раствора медного купороса, а затем очень осторожно добавить слой воды и оставить стакан в помещении с неизменной температурой, то через некоторое время исчезнет резкая граница между раствором медного купороса и водой, а через несколько дней жидкости перемешаются
Диффузия в твердых телах происходит еще медленнее, чем в жидкостях (от нескольких часов до нескольких лет). Она может наблюдаться только в хорошо отшлифованных телах, когда расстояния между поверхностями отшлифованных тел близки к межмолекулярному расстоянию (10-8 см). При этом скорость диффузии увеличивается при повышении температуры и давления.
Диффузия играет большую роль в природе и технике. В природе благодаря диффузии, например, осуществляется питание растений из почвы. Организм человека и животных всасывает через стенки пищеварительного тракта питательные вещества. В технике с помощью диффузии, например, поверхностный слой металлических изделий насыщается углеродом (цементация) и т.д.
Разновидностью диффузии является осмос — проникновение жидкостей и растворов через пористую полупроницаемую перегородку.
Броуновское движение
Броуновское движение открыто в 1827 г. английским ботаником Р. Броуном, теоретическое обоснование с точки зрения MKT дано в 1905 г. А. Эйнштейном и М. Смолуховским.
Броуновское движение — это беспорядочное движение мельчайших твердых частиц, «взвешенных» в жидкостях (газах).
«Взвешенные» частицы — это частицы, плотность вещества которых сравнима с плотностью среды, в которой они находятся. Такие частицы находятся в равновесии, и малейшее внешнее воздействие на нее приводит к их движению.
Для броуновского движения характерно следующее:
- броуновские частицы совершают непрерывное хаотическое движение, интенсивность которого зависит от температуры и от размеров броуновской частицы;
- траектория движения броуновской частицы очень сложная, не зависит от природы вещества частиц и внешних условий.
Рис. 2
На рисунке 2 показаны положения броуновской частицы через каждые 30 с, а на врезке — положения этой частицы на участке АВ, зафиксированные через каждую секунду. Эти положения соединены прямыми линиями. Траектория же частицы еще более сложная;
- броуновское движение наблюдается в жидкостях и газах.
Причинами броуновского движения являются:
- тепловое хаотическое движение молекул среды, в которой находится броуновская частица;
- отсутствие полной компенсации ударов молекул среды об эту частицу с различных сторон, так как движение молекул носит случайный характер.
Движущиеся молекулы жидкости при столкновении с какими-либо твердыми частицами передают им некоторое количество движения. Случайно с одной стороны о частицу ударит заметно большее число молекул, чем с другой, и частица придет в движение.
Если частица достаточно велика, то число молекул, налетающих на нее со всех сторон, чрезвычайно велико, их удары в каждый данный момент компенсируются, и такая частица практически остается неподвижной.
Постоянная Авогадро
Количество вещества равно отношению числа молекул в данном теле к числу атомов в 0,012 кг углерода, то есть количеству молекул в 1 моле вещества.
где – количество молекул в данном теле, – количество молекул в 1 моле вещества, из которого состоит тело.
– это постоянная Авогадро. Количество вещества измеряется в молях.
Постоянная Авогадро – это количество молекул или атомов в 1 моле вещества. Эта постоянная получила своё название в честь итальянского химика и физика Амедео Авогадро (1776 – 1856).
В 1 моле любого вещества содержится одинаковое количество частиц.
Молярная масса – это масса вещества, взятого в количестве одного моля:
где – масса молекулы.
Молярная масса выражается в килограммах на моль (кг/моль = кг*моль-1).
Молярная масса связана с относительной молекулярной массой соотношением:
Масса любого количества вещества равна произведению массы одной молекулы на количество молекул:
Количество вещества равно отношению массы вещества к его молярной массе:
Массу одной молекулы вещества можно найти, если известны молярная масса и постоянная Авогадро:
Более точное определение массы атомов и молекул достигается при использовании масс-спректрометра – прибора, в котором происходит разделение пучком заряженных частиц в пространстве в зависимости от их массы заряда при помощи электрических и магнитных полей.
Для примера найдём молярную массу атома магния. Как мы выяснили выше, масса атома магния равна m0Mg = 40,3463 * 10-27кг. Тогда молярная масса будет:
То есть в одном моле «помещается» 2,4288 * 10-2 кг магния. Ну или примерно 24,28 грамм.
Как видим, молярная масса (в граммах) практически равна атомной массе, указанной для элемента в таблице Менделеева. Поэтому когда указывают атомную массу, то обычно делают так:
Атомная масса магния равна 24,305 а.е.м. (г/моль).
Можете посчитать молярную массу для различных элементов и убедиться в правоте этого утверждения. Для расчёта молярной массы можно использовать простой калькулятор, который находится внизу страницы:
Типы молекул
Молекулы можно классифицировать по их атомному составу, а именно:
Сдержанный. Состоит из определенного количества атомов, состоящих из разных элементов или одинаковых по природе. В свою очередь, его можно классифицировать по количеству различных атомов, интегрированных в его структуру, в:
- Одноатомный (1 атом одного типа),
- Диатомики (два вида),
- Трихотомия (три типа),
- Тетралогический (четыре типа) и так далее.
Макромолекулы или полимеры. Макромолекулы — это большие молекулярные цепи, состоящие из более простых частей, соединенных вместе, чтобы образовать более сложные конструкции.
Традиционная модель обозначений молекул выражается по отношению к присутствующему атомному составу с помощью символов периодической таблицы, которые представляют задействованные элементы, и нижнего индекса, который выражает их числовые отношения в пределах молекулы.
Однако, поскольку молекулы представляют собой трехмерные объекты, визуальная модель, отражающая структуру, а не только количество ее элементов, часто используется для их полного понимания.
Моль вещества
Массы отдельных молекул и атомов очень малы, поэтому в расчётах удобнее использовать не абсолютные значения масс, а относительные.
Относительная молекулярная масса (или относительная атомная масса) вещества – это отношение массы молекулы (или атома) данного вещества к 1/12 массы атома углерода.
где – масса молекулы (или атома) данного вещества, – масса атома углерода.
Относительная молекулярная (или атомная) масса вещества показывает, во сколько раз масса молекулы вещества больше 1/12 массы изотопа углерода С12. Относительная молекулярная (атомная) масса выражается в атомных единицах массы.
Атомная единица массы – это 1/12 массы изотопа углерода С12. Точные измерения показали, что атомная единица массы составляет 1,660*10-27 кг, то есть
Относительная молекулярная масса вещества может быть вычислена путём сложения относительных атомных масс элементов, входящих в состав молекулы вещества. Относительная атомная масса химических элементов указана в периодической системе химических элементов Д.И. Менделеева.
В периодической системе Д.И. Менделеева для каждого элемента указана атомная масса, которая измеряется в атомных единицах массы (а.е.м.). Например, атомная масса магния равна 24,305 а.е.м., то есть магний в два раза тяжелее углерода, так как атомная масса углерода равна 12 а.е.м. (это следует из того, что 1 а.е.м. = 1/12 массы изотопа углерода, который составляет большую часть атома углерода).
Зачем измерять массу молекул и атомов в а.е.м., если есть граммы и килограммы? Конечно, можно использовать и эти единицы измерения, но это будет очень неудобно для записи (слишком много чисел придётся использовать для того, чтобы записать массу). Чтобы найти массу элемента в килограммах, нужно атомную массу элемента умножить на 1 а.е.м. Атомная масса находится по таблице Менделеева (записана справа от буквенного обозначения элемента). Например, вес атома магния в килограммах будет:
Массу молекулы можно вычислить путём сложения масс элементов, которые входят в состав молекулы. Например, масса молекулы воды (Н2О) будет равна:
Количество вещества принято считать пропорциональным числу частиц. Количество вещества – это физическая величина, характеризующая относительное число молекул и атомов в теле. Единица количества вещества называется молем (моль).
Моль равен количеству вещества системы, в которой содержится столько же молекул, сколько содержится атомов в 0,012 кг углерода С12. То есть, если у нас есть система с каким-либо веществом, и в этой системе столько же молекул этого вещества, сколько атомов в 0,012 кг углерода, то мы можем сказать, что в этой системе у нас 1 моль вещества.
Типы химических связей в молекуле
Различают несколько типов химических связей: ковалентная, ионная, металлическая, водородная.
Обычно ионная связь образуется между типичными металлом и неметаллом, например: поверенная соль (хлорид натрия), оксид бария и т.д.
Ковалентной связью связаны атомы в молекулах простых веществ (хлор, бром, кислород и др.), органических веществ. То есть ковалентная связь образуется между атомами неметаллов. Если неметаллы одинаковые, то образуется ковалентная неполярная связь, а если связь образуется между разными неметаллами — то это ковалентная полярная связь (Рис.2).
Рис.2. Образование ковалентной полярной связи (на примере соляной кислоты).
Строение молекулы
Понятие о строении включает геометрическую структуру и распределение электронной плотности.
В качестве примера рассмотрим строение наименьшей частицы воды.
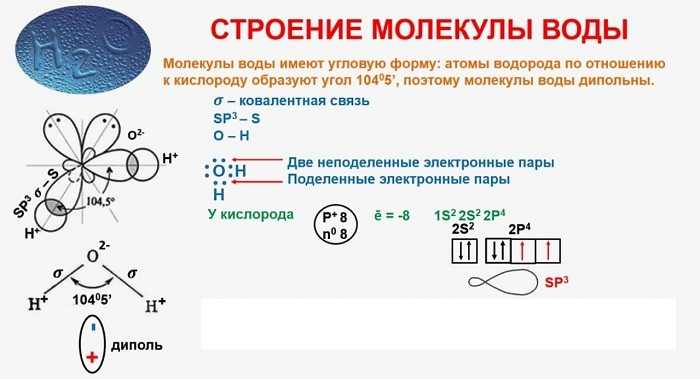
Существует несколько способов взаимодействия атомов. Основным способом являются химические связи, благодаря им поддерживается стабильное существование молекул. Прочие (неосновные) взаимодействия происходят между теми атомами, которые не связаны непосредственно.
Виды химической связи:
-
Металлическая — ядра атомов металлов, расположенные в узлах кристаллических решёток, объединены общим облаком электронов.
-
Водородная — основана на способности атома водорода образовывать дополнительную связь при смещении от него электронной плотности.
-
Ионная — имеет электрическую природу. Сильно поляризована. Возникает при притяжении ионов, несущих противоположный заряд.
-
Ковалентная — может быть полярной и неполярной. Образуется за счет пары электронов, совместно принадлежащей двум атомам. Отличается наибольшей устойчивостью и энергетической емкостью.
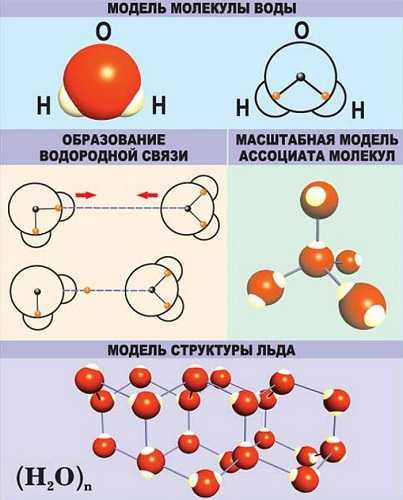
Связи характеризуются следующими показателями:
-
длина – степень удаления друг от друга ядер атомов, образовавших связь;
-
энергия – сила, прилагаемая для разрушения связи;
-
полярность – смещение электронного облака к одному из атомов;
-
порядок или кратность – количество пар электронов, образовавших связь.
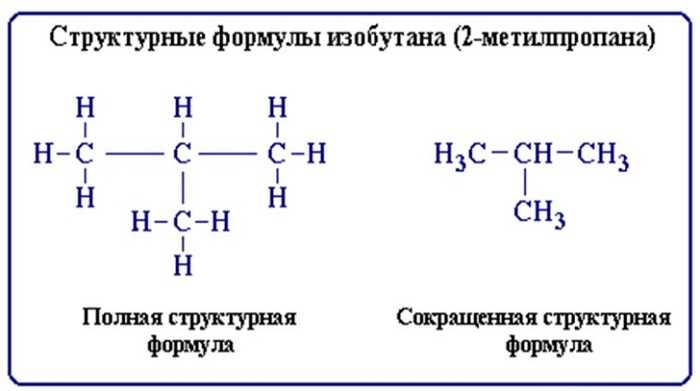
Строение молекул условно отражается структурными формулами. Основные взаимодействия атомов, при составлении таких формул, отображается черточками. В таких формулах связи образуют неразрывную цепь и иллюстрируют валентности образовавших их элементов (атомов).
Структурные формулы также отражают то, как выглядит молекула (линейная, циклическая, наличие радикалов и т. д.).
Строение частицы вещества активно изучается. Для этого используют различные экспериментальные и теоретические методы. К экспериментальным относят рентгеновский структурный анализ, спектроскопия, массспектрометрия и др. К теоретическим — расчётные методы квантовой химии.





























