Определение, назначение, применение
Электролизер — это устройство, которое используется для проведения электролиза, процесса разложения вещества на составляющие его компоненты с помощью электрического тока. Основной принцип работы электролизера заключается в пропускании электрического тока через электролит, в результате чего происходит окисление одного компонента вещества на аноде и восстановление другого компонента на катоде.
Главным назначением электролизера является получение нужных химических элементов или соединений. Благодаря этому приспособлению можно проводить синтез химических веществ, очистку растворов от примесей, получение металлов, производство водорода и кислорода, а также другие процессы, связанные с электрохимией.
Электролизеры находят широкое применение в различных отраслях промышленности. Например, в химической промышленности электролизеры используются для получения химических продуктов, таких как содовый щелок, хлор, алюминий и др. В энергетике электролизеры применяются для производства водорода, который используется в качестве энергетического носителя или для производства аммиака. Кроме того, электролизеры находят применение в металлургической промышленности, а также в производстве электродных материалов и аккумуляторов.
Типы электрического тока
Существует два основных типа электрического тока: постоянный ток (DC) и переменный ток (AC).
Постоянный ток (DC)
Постоянный ток – это ток, который имеет постоянную величину и направление. В постоянном токе заряды движутся в одном направлении, не меняя своего направления со временем. Примером постоянного тока является ток, который поступает от батареи или аккумулятора.
Переменный ток (AC)
Переменный ток – это ток, который меняет свою величину и направление со временем. В переменном токе заряды периодически меняют свое направление движения. Это происходит из-за изменения напряжения в электрической сети. В большинстве домашних и промышленных электрических систем используется переменный ток.
Переменный ток имеет частоту, которая измеряется в герцах (Гц) и обозначает количество полных циклов изменения направления тока в секунду. В России и большинстве стран частота переменного тока составляет 50 герц (Гц), что означает, что направление тока меняется 50 раз в секунду.
Переменный ток имеет свои преимущества, такие как возможность передачи энергии на большие расстояния и использование трансформаторов для изменения напряжения. Однако, для некоторых устройств требуется постоянный ток, поэтому переменный ток может быть преобразован в постоянный с помощью выпрямителей.
Распад молекул воды
При пропускании тока через молекулы воды, они распадаются на атомы. Каждая молекула воды состоит из двух атомов водорода (Н) и одного атома кислорода (О).
Процесс распада молекул воды на атомы происходит благодаря электролизу. При этом, под воздействием электрического тока, происходит разрушение связей между атомами водорода и кислорода.
Когда молекула воды распадается на атомы, то образуется катион водорода (H+) и анион гидроксидного иона (ОН-). Катионы и анионы обладают электрическим зарядом и перемещаются к электродам с противоположным зарядом.
При пропускании тока через молекулы воды, важно отметить, что процесс электролиза только возможен при наличии электролита, который обеспечивает передачу электрического заряда. В случае воды, электролитом являются ионы, образующиеся при распаде молекул воды
Распад молекул воды на атомы является важным процессом, который используется в различных областях науки и техники. Например, электролиз воды широко применяется для получения водорода и кислорода, используемых в различных химических процессах и водородных топливных элементах.
Процесс диссоциации молекул воды под воздействием тока
При пропускании тока через воду, молекулы воды распадаются на атомы. Процесс диссоциации происходит благодаря электролизу, когда на электроды подается электрический ток.
Молекула воды (H2O) состоит из двух атомов водорода (H) и одного атома кислорода (O). В результате электролиза, под воздействием тока, молекулы воды распадаются на атомы водорода и атомы кислорода.
Во время электролиза, анод — положительно заряженный электрод, привлекает атомы кислорода, которые окисляются, образуя молекулы кислородного газа (O2). Таким образом, анод становится местом, где происходит окисление.
Катод — отрицательно заряженный электрод, привлекает атомы водорода, которые отрицательно заряжаются, образуя молекулы водородного газа (H2). Катод становится местом, где происходит восстановление.
Процесс диссоциации молекул воды под воздействием тока является важным в области электрохимии. Полученные при этом газы — водород и кислород — могут использоваться в различных процессах, таких как водородное сжигание и производство различных химических соединений.
Роль ионов в процессе разложения молекул воды
Молекулы воды при пропускании тока распадаются на атомы. Этот процесс, известный как электролиз, является важным явлением в химии. Разложение молекул воды осуществляется благодаря наличию ионов в растворе.
При пропускании электрического тока через воду, происходит деление молекул воды на отдельные компоненты — атомы водорода (H2) и атомы кислорода (O2). Эти атомы существуют в виде ионов в растворе, где водородные ионы (H+) и оксидные ионы (O2-) осуществляют перенос электрического заряда.
Процесс разложения воды на ионы происходит на электродах. На аноде — положительном электроде — происходит окисление воды, в результате которого образуются оксидные ионы (O2-) и протоны (H+). На катоде — отрицательном электроде — происходит восстановление воды, в результате чего образуются атомы водорода (H2).
Ионы водорода и оксигена в растворе представляются в виде свободных электрически заряженных частиц, которые играют важную роль в реакциях разложения молекул воды. Ионы водорода (H+) являются положительными, а ионы кислорода (O2-) — отрицательными, что способствует перемещению электрического заряда через раствор.
В процессе электролиза вода может быть использована для получения водорода и кислорода, которые также имеют широкое применение в различных отраслях промышленности.
Электролиз расплавов
Один из вариантов электролиза – использование в качестве электролита расплав. В этом случае в электролизном процессе участвуют только ионы расплава. В качестве классического примера можно привести электролиз солевого расплава NaCl (поваренная соль). К аноду устремляются отрицательные ионы, а значит, выделяется газ (Cl). На катоде будет происходить восстановление металла, т.е. оседание чистого Na, образующегося из положительных ионов, притянувших избыточные электроны. Аналогично можно получать другие металлы (К, Са, Li и т.д.) из расправа соответствующих солей.
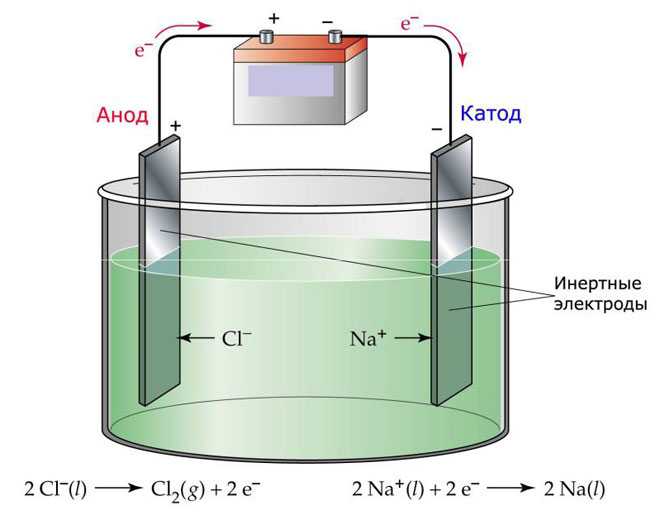
При электролизе в расплаве электроды не подвергаются растворению, а участвуют только в качестве источника тока. При их изготовлении можно использовать металл, графит, некоторые полупроводники
Важно, чтобы материал имел достаточную проводимость. Один из наиболее распространенных материалов – медь
методы
Методы электролиза воды варьируются в зависимости от количества Н2 и O2 что предлагается генерировать. Оба газа очень опасны, если их смешивать друг с другом, и поэтому электролизеры имеют сложную конструкцию, чтобы минимизировать увеличение газовых давлений и их диффузию через водную среду..
Кроме того, методы колеблются в зависимости от элемента, электролита, добавляемого в воду, и самих электродов. С другой стороны, некоторые подразумевают, что реакция проводится при более высоких температурах, уменьшая потребление электроэнергии, а другие используют огромные давления для поддержания H.2 хранится.
Среди всех методов можно упомянуть следующие три:
Электролиз щелочной водой
Электролиз проводят с основными растворами щелочных металлов (КОН или NaOH). С помощью этой техники происходят реакции:
4H2O (l) + 4e- => 2H2(г) + 4ОН-(Aq)
4OH-(ac) => O2(г) + 2Н2O (l) + 4e-
Как видно, как на катоде, так и на аноде вода имеет основной pH; и кроме того, ОН- мигрировать на анод, где они окисляются до O2.
Электролиз с полимерной электролитической мембраной
В этой технике используется твердый полимер, который служит проницаемой мембраной для H+, но водонепроницаемый для газов. Это гарантирует большую безопасность при электролизе.
Полуклеточные реакции для этого случая:
4H+(ac) + 4e- => 2H2(G)
2H2O (l) => O2(г) + 4Н+(ac) + 4e-
Ионы Н+ они мигрируют от анода к катоду, где они уменьшаются, чтобы стать H2.
Электролиз с твердыми оксидами
Очень отличающийся от других методов, он использует оксиды в качестве электролитов, которые при высоких температурах (600-900ºC) функционируют в качестве среды переноса анионов.2-.
Реакции:
2H2O (г) + 4e- => 2H2(г) +202-
2O2- => O2(г) + 4е-
Обратите внимание, что на этот раз оксидные анионы, или2-, те, кто путешествует на анод
Реакция электролиза
Электролиз воды включает в себя много сложных аспектов. Однако в общих чертах его основа лежит в простой глобальной реакции:
2H2O (l) => 2H2(г) + О2(G)
Как видно из уравнения, вмешиваются две молекулы воды: одну обычно нужно уменьшить или получить электроны, а другую — окислить или потерять электроны..
H2 Это продукт восстановления воды, потому что усиление электронов способствует протонов H+ может быть ковалентно связан, и кислород превращается в ОН-. Поэтому Н2 происходит на катоде, который является электродом, где происходит восстановление.
В то время как O2 происходит от окисления воды, потому что она теряет электроны, которые позволяют ей связываться с водородом, и, следовательно, высвобождает протоны H+. O2 происходит на аноде, электроде, где происходит окисление; и в отличие от другого электрода, pH вокруг анода является кислым, а не основным.
Полуклеточные реакции
Вышеизложенное можно обобщить следующими химическими уравнениями для полуклеточных реакций:
2H2O + 2e- => H2 + 2OH- (Катод, основной)
2H2O => O2 + 4H+ + 4e- (Анод, кислота)
Однако вода не может потерять больше электронов (4e-) из которых другая молекула воды побеждает на катоде (2e-); следовательно, первое уравнение должно быть умножено на 2, а затем вычтено со вторым уравнением, чтобы получить чистое уравнение:
2 (2H2O + 2e- => H2 + 2OH-)
2H2O => O2 + 4H+ + 4e-
6H2O => 2H2 + О2 + 4H+ + 4OH-
Но 4Н+ и 4OH- они образуют 4H2Или, таким образом, они устраняют четыре из шести молекул H2Или оставив два; и в результате глобальная реакция только что изложил.
Реакции полуэлемента изменяются в зависимости от значений рН, методов, а также имеют потенциальные потенциалы восстановления или окисления, которые определяют, какой ток необходимо подавать, чтобы электролитический процесс воды происходил самопроизвольно..
Особенности процессов, происходящих на катоде и аноде
Для практического применения электролиза важно понимать, что происходит на обоих электродах при подаче электрического тока. Характерны такие процессы:
- Катод. К нему устремляются положительно заряженные ионы. Здесь происходит восстановление металлов или выделение водорода. Можно выделить несколько категорий металлов по катионной активности. Такие металлы, как Li, K, Ba, St, Ca, Na, Mg, Be, Al, хорошо восстанавливаются только из расплава солей. Если используется раствор, то выделяется водород за счет электролиза воды. Можно обеспечить восстановление в растворе, но при достаточной концентрации катионов, у следующих металлов — Mn, Cr, Zn, Fe, Cd, Ni, Ti, Co, Mo, Sn, Pb. Процесс протекает наиболее легко для Ag, Cu, Bi, Pt, Au, Hg.
- Анод. К этому электроду поступают отрицательно заряженные ионы. Окисляясь, они отбирают электроны у металла, что приводит к их анодному растворению, т.е. переходу в положительно заряженные ионы, которые направляются к катоду. Анионы также подразделяются по своей активности. Только из расплавов могут разряжаться такие анионы PO4, CO3, SO4, NO3, NO2, ClO4, F. В водных растворах электролизу подвергаются не они, а вода с выделением кислорода. Наиболее легко реагируют такие анионы, как ОН, Cl, I, S, Br.
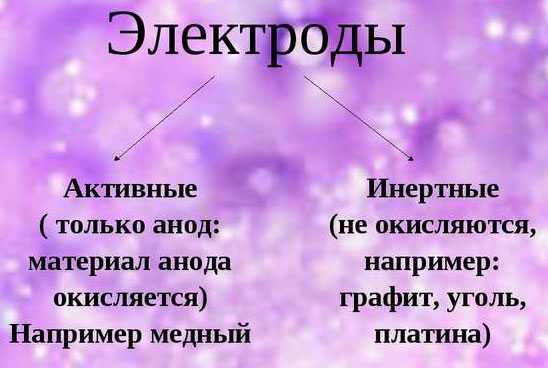
При обеспечении электролиза важно учитывать склонность материала электродов к окислению. В этом отношении выделяются инертные и активные аноды
Инертные электроды делаются из графита, угля или платины и не участвуют в снабжении ионами.
Электролиз воды — что это и для чего он нужен
Электролиз — это процесс, направленный на проведение электрического тока через раствор или расплав электролита, который сопровождается выделением различных ионов вещества. Электролит — это любое вещество, способное пропускать электрический ток — упорядоченное движение электронов.
Чтобы получить водород и кислород в чистом виде, в химических лабораториях проводят электролиз воды. Для осуществления процесса электролиза в раствор или в расплав помещают два электрода (анод и катод), подключённых к разноименным полюсам источника тока. В качестве электродов чаще всего используется графит или благородные металлы (золото, платина и так далее), так как эти материалы пропускают электрический ток, но не подвергаются воздействию электролиза.

Катод — это тот электрод, на котором происходит процесс восстановления (то есть принятия электронов и соответственно понижение степени окисления вещества), подключаемый к отрицательному полюсу источника тока. На аноде же происходит процесс отдачи электронов, то есть окисления. При этом данный электрод подключается к положительному полюсу источника («плюсу»).

Интересно! Шунгитовая вода — что это такое, полезные свойства для организма и как приготовить в домашних условиях
Процесс электролиза начинается с диссоциации — процесса распада вещества (раствора или расплава электролита) на элементарные ионы. После диссоциации начинаются реакции на катоде и на аноде.
На аноде:
2H2O → O2 + 4H+ + 4e–
на этом электроде происходит распад двух молекул воды на одну молекулу кислорода и четырех катионов водорода.
На катоде:
4H+ + 4e– → 2H2
катионы водорода притягиваются к катоду и восстанавливаются там посредством присоединения электронов. Таким образом образуются две молекулы газообразного водорода.
Общее уравнение электролиза воды запишется в виде:
2H2O → 2H2 + O2

Но нужно понимать, что вода является достаточно слабым электролитом, поэтому процесс электролиза будет происходить медленно. Для ускорения реакции следует добавить катализатор — вещество, которое увеличивает скорость протекания реакций посредством внедрения дополнительных элементарных химических реакций с меньшим значением энергии активации.
Элекролит не должен вступать в конфликт с водой. Следует подобрать такое вещество, электродный потенциал которого будет меньше, чем у катиона воды (H+). Иначе молекулы водорода не смогут образоваться на катоде. В таблице указаны те ионы (катионы), которые смогут электролизоваться, выделяя чистый кислород и водород.
| Li+ | Rb+ | K+ | Ba2+ | Sr2+ | Ca2+ | Na+ | Mg2+ |
| -3,05 В | -2,92 В | -2,92 В | -2,90 В | -2,89 В | -2,87 В | -2,713 В | -2,38 В |
В качестве неконкурирующего аниона, наоборот, подбирают электролит с большим электродным потенциалов, чем гидроксид-анион OH– воды. В качестве такого электролита применяется щелочь для образования иона. Для электролиза воды используют сильные щелочи — то есть те соединения, которые образованы активными металлами, например, LiOH (гидроксид лития), KOH (гидроксид калия) и NaOH (гидроксид натрия). Иногда для такого электролиза используют сильную кислоту — серную (H2SO4).

Интересно! Вода — удивительное вещество для планеты. Свойства и значение
процесс
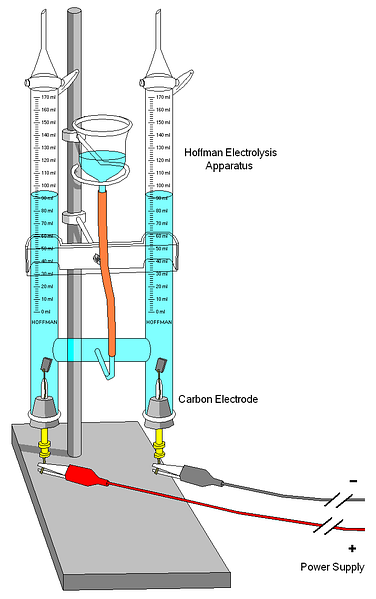
На верхнем изображении показан вольтметр Хоффмана. Цилиндры заполняются водой и выделенными электролитами через среднее сопло. Роль этих электролитов заключается в повышении проводимости воды, потому что в нормальных условиях очень мало ионов H3О+ и ОН- продукты вашего авто ионизации.
Два электрода обычно платиновые, хотя на изображении они были заменены угольными электродами. Оба связаны с батареей, с которой применена разность потенциалов (ΔV), которая способствует окислению воды (образование O).2).
Электроны перемещаются по всему контуру, пока вы не достигнете другого электрода, где вода выигрывает и становится Н2 и ОН-. На данный момент анод и катод уже определены, которые могут быть дифференцированы по высоте водяных столбов; тот, который имеет меньшую высоту, соответствует катоду, где образуется Н2.
В верхней части цилиндров есть несколько клавиш, позволяющих выпускать образующиеся газы. Вы можете тщательно проверить наличие H2 заставляя его реагировать с пламенем, сгорание которого дает газообразную воду.
Где применяется электролиз?
Электролиз применяется во многих сферах. Можно выделить несколько основных направлений использования для получения практических результатов.
Гальваническое покрытие
Тонкое, прочное гальваническое покрытие из металла можно наложить путем электролиза. Покрываемое изделие устанавливается в ванну в виде катода, а электролит содержит соль нужного металла. Так можно покрыть сталь цинком, хромом или оловом.

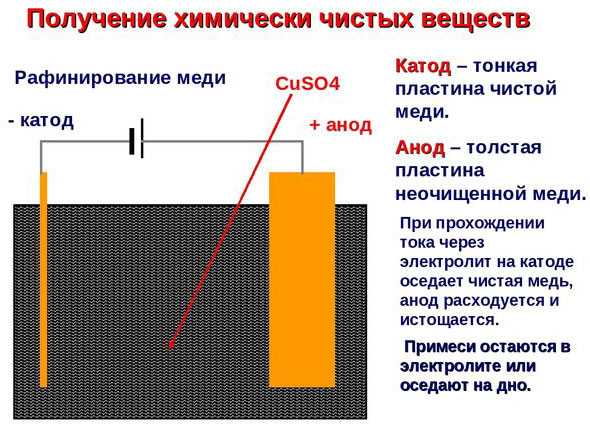
Электроочистка — рафинирование меди
Примером электроочистки может служить такой вариант: катод – чистая медь, анод – медь с примесями, электролит – водный раствор медного сульфата. Медь из анода переходит в ионы и оседает в катоде уже без примесей.
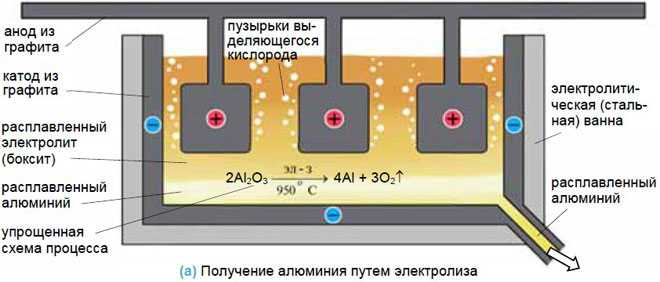
Добыча металлов
Для получения металлов из солей они переводятся в расплав, а затем обеспечивается электролиз в нем. Достаточно эффективен такой способ для получения алюминия из бокситов, натрия и калия.
Анодирование
При этом процессе покрытие выполняется из неметаллических соединений. Классический пример – анодирование алюминия. Алюминиевая деталь устанавливается, как анод. Электролит – раствор серной кислоты. В результате электролиза на аноде оседает слой из оксида алюминия, обладающего защитными и декоративными свойствами. Указанные технологии широко используются в различных отраслях промышленности. Можно осуществить процессы и своими руками с соблюдением техники безопасности.
Перспективы развития и исследований
- Увеличение эффективности: Одним из главных направлений исследований является повышение эффективности процесса разложения воды. Ученые и инженеры работают над поиском новых катализаторов, оптимизацией условий электролиза и улучшением конструкции электролизера. Это позволит увеличить выход водорода и кислорода, снизить энергозатраты и сделать процесс более экономически выгодным.
- Использование возобновляемых источников энергии: Разложение воды может быть использовано для хранения энергии из возобновляемых источников, таких как солнечная или ветровая энергия. В таком случае, процесс может быть использован для получения водорода, который впоследствии может быть использован в топливных элементах или восстановлен обратно в электроэнергию. Исследования в этой области направлены на повышение эффективности таких систем хранения энергии и разработку новых перспективных архитектур.
- Применение водорода в транспорте и промышленности: Водород, полученный в результате разложения воды, имеет широкий спектр применений. Он может быть использован в транспорте для двигателей внутреннего сгорания с нулевым выбросом CO2 или для питания городского транспорта на топливных элементах. Водород также может быть использован в промышленности для производства аммиака, газовых смесей, водородной перекиси и других химических соединений. Исследования в этой области направлены на оптимизацию процессов производства и использования водорода, а также на разработку новых материалов и каталитических систем.
- Устранение проблемы долговечности электролизеров: Электролизеры, используемые для разложения воды, имеют ограниченный срок службы, что является одной из главных проблем в этой области. Исследования ведутся с целью разработки новых материалов и конструкций электролизеров, которые будут более долговечными и экономически выгодными. Устранение этой проблемы позволит повысить эффективность процесса и снизить его затраты.
В целом, перспективы развития разложения воды под действием постоянного электрического тока остаются очень обнадеживающими. Исследования и разработки в этой области продолжаются, и они могут привести к новым открытиям и инновационным применениям этого процесса в различных сферах жизни.
Практическое применение электрического тока в жидкостях
Электролитическое покрытие
Одним из практических применений электрического тока в жидкостях является электролитическое покрытие. Это процесс, при котором тонкий слой металла наносится на поверхность другого металла или материала с помощью электролита и электрического тока. Электролитическое покрытие может использоваться для защиты от коррозии, улучшения внешнего вида, повышения твердости и других свойств поверхности.
Электроосаждение металлов
Электроосаждение металлов – это процесс, при котором металлы осаждается на электрод из раствора соли металла под воздействием электрического тока. Этот процесс используется для получения чистых металлических покрытий на различных поверхностях. Например, в ювелирной промышленности электроосаждение золота или серебра используется для создания драгоценных украшений.
Электрофорез
Электрофорез – это метод разделения и очистки частиц в жидкости под воздействием электрического поля. В этом процессе заряженные частицы перемещаются к электродам в зависимости от их заряда и размера. Электрофорез используется в биологии, медицине и химии для разделения и анализа белков, ДНК, РНК и других биологических молекул.
Электролитическая очистка
Электролитическая очистка – это процесс удаления загрязнений с поверхности металла с помощью электрического тока. В этом процессе загрязнения растворяются в электролите, а чистый металл остается неповрежденным. Электролитическая очистка используется для удаления окислов, ржавчины и других загрязнений с поверхности металлических изделий.
Электролитическая дезинфекция
Электролитическая дезинфекция – это метод использования электрического тока для уничтожения микроорганизмов в жидкостях, таких как вода или пищевые продукты. В этом процессе электрический ток разлагает воду на активные оксиды, которые уничтожают бактерии, вирусы и другие микроорганизмы. Электролитическая дезинфекция может использоваться для очистки питьевой воды, обеззараживания бассейнов и спа-салонов, а также для консервации пищевых продуктов.
Эти примеры демонстрируют практическое применение электрического тока в жидкостях. Понимание этих процессов помогает нам разрабатывать новые технологии и улучшать существующие методы в различных областях, таких как промышленность, медицина и наука.
Проводимость жидкостей
Проводимость жидкостей определяет их способность проводить электрический ток. Жидкости могут быть разделены на две категории: электролиты и некоторые неполярные жидкости.
Электролиты
Электролиты – это жидкости, которые содержат ионы, заряженные частицы. Примерами электролитов являются соли, кислоты и щелочи. Ионы в электролитах могут двигаться свободно под воздействием электрического поля, что позволяет электрическому току протекать через них.
В электролитах ионы образуются в результате диссоциации или ионизации. Диссоциация происходит, когда молекулы электролита разделяются на ионы при контакте с растворителем. Например, соль NaCl диссоциирует в воде на ионы натрия (Na+) и хлорида (Cl-). Ионизация происходит, когда молекулы электролита разлагаются на ионы под воздействием электрического поля.
Ионы в электролитах могут быть положительно заряженными (катионами) или отрицательно заряженными (анионами). Катионы и анионы движутся в противоположных направлениях под воздействием электрического поля, что создает электрический ток.
Неполярные жидкости
Некоторые неполярные жидкости, такие как некоторые органические растворители, также могут проводить электрический ток. В этом случае ток протекает благодаря движению заряженных молекул или ионов, которые образуются в результате химических реакций в жидкости.
В неполярных жидкостях, таких как бензол или толуол, молекулы не имеют заряда и не диссоциируют на ионы. Однако, некоторые химические реакции в жидкости могут приводить к образованию заряженных молекул или ионов, которые могут двигаться под воздействием электрического поля и проводить электрический ток.
Зависимость проводимости от концентрации и температуры
Проводимость электролитов и неполярных жидкостей может быть изменена изменением концентрации ионов или температуры.
Увеличение концентрации ионов в растворе или жидкости может увеличить проводимость, так как больше ионов будет доступно для движения под воздействием электрического поля.
Температура также может влиять на проводимость жидкостей. В некоторых случаях, увеличение температуры может увеличить движение ионов и, следовательно, увеличить проводимость. Однако, в других случаях, увеличение температуры может привести к уменьшению проводимости, так как ионы могут сталкиваться с большим сопротивлением движению из-за увеличения вязкости жидкости.
Изучение проводимости жидкостей имеет большое значение в различных областях, включая химию, физику, биологию и промышленность. Понимание проводимости жидкостей позволяет разрабатывать новые материалы, улучшать электрохимические процессы и создавать новые технологии.
Электролиз и законы Фарадея
Майкл Фарадей – английский физик-экспериментатор, совершивший несколько важных открытий, касающихся электромагнитных явлений. Электрохимические исследования природы реакций, опубликованные ученым в 1836 году, позволили ему сформулировать законы электролиза. Они формулируют связь между количеством вещества, полученного в процессе электрохимической реакции, и объемом электроэнергии, повлиявшей на электролит.
Первый закон
В общем виде первое правило электролиза Фарадея звучит так: масса вещества, присоединившаяся к электроду при реакции прямо пропорциональна объему электричества, прошедшего через электролит с помощью электродов. Формула реакции:
m = kq = k*I*t
(значения переменных: q – заряд, k –электрохимический эквивалент (коэффициент) вещества, I – сила тока, влияющего на электролит, t – время прохождения электричества).

Второй закон
Этим термином обозначают молярную массу, деленную на целое число, определяющееся реакцией химии, в которой элемент участвует. В другой формулировке закон выглядит так: равное количество электроэнергии ведет к выделению на электродах в течение электролиза эквивалентных масс разных элементов.
Эта константа стала называться числом Фарадея. Самая простая формулировка закона гласит: электрохимический эквивалент каждого элемента прямо пропорционален его молярной массе и обратно пропорционален валентности этого же элемента. Формула:
m = Q/F*A/z
(значения переменных: m – искомая масса полученного вещества, Q – количество полного заряда, прошедшего через электроды, F – число Фарадея, А- молярная масса, z – химическая валентность элемента). Соединяя вместе все значения, описанные в обоих законах, можно вывести общую формулу, определяющую массу собранного на электродах вещества: m = A*I*t/(n*F) (n – заряд иона или количество электронов, участвующих в реакции электролиза).

ссылки
- Wikipedia. (2018). Электролиз воды. Получено с: en.wikipedia.org
- Чаплин М. (16 ноября 2018 г.). Электролиз воды. Структура воды и наука. Получено с: 1.lsbu.ac.uk
- Энергоэффективность и возобновляемая энергия. (Н.Д.). Производство водорода: электролиз. Получено от: energy.gov
- Phys.org. (14 февраля 2018 г.) Высокоэффективный, недорогой катализатор для электролиза воды. Получено с: phys.org
- Химия LibreTexts. (18 июня 2015 г.) Электролиз воды. Получено от: chem.libretexts.org
- Сян С., М. Пападантонакисаб К. и С. Льюис Н. (2016). Принципы и реализации электролизных систем для вододеления. Королевское химическое общество.
- Регенты Университета Миннесоты. (2018). Электролиз воды 2. Университет Миннесоты. Получено из: chem.umn.edu
Домашний эксперимент
Эксперименты по электролизу воды проводились на лабораторных весах с помощью вольтметров Хоффмана или другой сборки, которая позволяет вместить все необходимые элементы электрохимической ячейки..
Из всех возможных сборок и оборудования самым простым может быть большой прозрачный контейнер для воды, который будет служить ячейкой. Кроме того, вы должны иметь под рукой любую металлическую или электропроводящую поверхность, которая будет выполнять функцию электродов; один для катода, а другой для анода.
Для этой цели могут быть полезны даже карандаши с острыми точками на обоих концах. И, наконец, небольшой аккумулятор и несколько кабелей, которые соединяют его с импровизированными электродами..
Если не сделать в прозрачном контейнере, образование пузырьков газа не может быть оценено.
Домашние переменные
Хотя электролиз воды является предметом, который содержит много интригующих и обнадеживающих аспектов для тех, кто ищет альтернативные источники энергии, домашний эксперимент может быть скучным для детей и других зрителей..
Следовательно, достаточное напряжение может быть приложено для формирования H-образования2 и O2 чередуя определенные переменные и отмечая изменения.
Первый — это изменение pH воды с использованием уксуса для подкисления воды или Na.2Колорадо3 немного подвести Изменение количества наблюдаемых пузырьков должно произойти.
Кроме того, тот же эксперимент можно повторить с холодной и горячей водой. Таким образом, влияние температуры на реакцию будет затем рассматриваться.
Наконец, чтобы сделать сбор данных немного менее бесцветным, вы можете прибегнуть к очень разбавленному раствору сока фиолетовой капусты. Этот сок является основным кислотным индикатором природного происхождения..
Добавляя его в емкость с введенными электродами, можно заметить, что на аноде вода станет розовой (кислотной), а на катоде окраска будет желтой (основной).





























