Ван-дер-Ваальс
Силы Ван-дер-Ваальса, названные в честь голландского физика, — это сравнительно слабые взаимодействия между атомами. Они существуют потому, что даже в химически устойчивых атомах и молекулах электроны все же не замирают на одном месте, и поэтому распределение заряда меняется. Это означает, что отрицательно заряженная часть одной молекулы может временно притянуть положительно заряженную часть другой. Более стойкое разделение заряда возникает в полярных молекулах — в воде, например, и тогда получаются связи посильнее. Водородные связи — особый случай такого притяжения, в котором образуются межмолекулярные контакты значительной силы.
 Йоханнес Дидерик Ван дер Ваальс
Йоханнес Дидерик Ван дер Ваальс
Поделиться ссылкой
Взаимодействие частиц
Существование устойчивых жидких и твёрдых тел объясняется наличием сил межмолекулярного взаимодействия (сил взаимного притяжения и отталкивания). Этими же причинами объясняется малая сжимаемость жидкостей и способность твёрдых тел сопротивляться деформациям сжатия и растяжения.
Силы межмолекулярного взаимодействия имеют электромагнитную природу – это силы электрического происхождения. Причиной этого является то, что молекулы и атомы состоят из заряженных частиц с противоположными знаками зарядов – электронов и положительно заряженных атомных ядер. В целом молекулы электрически нейтральны. По электрическим свойствам молекулу можно приближённо рассматривать как электрический диполь.
Силы притяжения принято считать отрицательными, а силы отталкивания – положительными, хотя это деления является условным.
Сила взаимодействия между молекулами имеет определённую зависимость от расстояния между молекулами. Эта зависимость изображена на рис. 1.1. Здесь показаны проекции сил взаимодействия на прямую, которая проходит через центры молекул.
Рис. 1.1. Зависимость межмолекулярных сил от расстояния между взаимодействующими атомами.
Как видим, по мере уменьшения расстояния между молекулами r сила притяжения Fr пр увеличивается (красная линия на рисунке). Как уже было сказано, силы притяжения принято считать отрицательными, поэтому по мере уменьшения расстояния кривая уходит вниз, то есть в отрицательную зону графика.
Силы притяжения действуют по мере сближения двух атомов или молекул, пока расстояние r между центрами молекул находится в районе 10-9 м (2-3 диаметра молекул). По мере увеличения этого расстояния силы притяжения ослабевают. Силы притяжения являются короткодействующими силами.
| (1.1) |
где a – коэффициент, зависящий от вида сил притяжения и строения взаимодействующих молекул.
При дальнейшем сближении атомов или молекул на расстояниях между центрами молекул порядка 10-10 м (это расстояние сравнимо с линейными размерами неорганических молекул) появляются силы отталкивания Fr от (синяя линия на рис. 1.1). Эти силы появляются за счёт взаимного отталкивания положительно заряженных атомов в молекуле и убывают с увеличением расстояния r ещё быстрее, чем силы притяжения (что видно на графике – синяя линия более «круто» стремится к нулю, чем красная).
| (1.2) |
где b – коэффициент, зависящий от вида сил отталкивания и строения взаимодействующих молекул.
На расстоянии r = r (это расстояние примерно равно сумме радиусов молекул) силы притяжения уравновешивают силы отталкивания, а проекция результирующей силы Fr = 0. Этому состоянию соответствует наиболее устойчивое расположение взаимодействующих молекул.
В общем случае результирующая сила равна:
| (1.3) |
При r > r притяжение молекул превосходит отталкивание, при r < r– отталкивание молекул превосходит их притяжение.
Зависимость сил взаимодействия молекул от расстояния между ними качественно объясняет молекулярный механизм появления сил упругости в твёрдых телах.
При растяжении твёрдого тела частицы удаляются друг от друга на расстояния, превышающие r. При этом появляются силы притяжения молекул, которые возвращают частицы в первоначальное положение.
При сжатии твёрдого тела частицы сближаются на расстояния, меньшие расстояния r. Это приводит к увеличению сил отталкивания, которые возвращают частицы в первоначальное положение и препятствуют дальнейшему сжатию.
Если смещение молекул из положений равновесия мало, то силы взаимодействия растут линейно с увеличением смещения. На графике этот отрезок показан утолщённой линией светло-зелёного цвета.
Поэтому при малых деформациях (в миллионы раз превышающих размер молекул) выполняется закон Гука, согласно которому сила упругости пропорциональна деформации. При больших смещениях закон Гука не действует.
Простые и сложные вещества. Валентность
вы получаете соль KCl и кислород O
Число атомов калия и хлора одинаково, но число атомов кислорода различно. Давайте поставим их в равные условия:2Теперь количество атомов калия и хлора изменилось до начала реакции. Давайте поставим их в равные условия:3*.
Полученный символ показывает, что разложение двух молекул KClO
Алмаз — атомы углерода находятся в вершинах воображаемых тетраэдров;
Графит — атомы углерода находятся в одной плоскости;
требуется две молекулы КСІ и три молекулы кислорода O
. Количество молекул задается коэффициентами.
При выборе коэффициентов нет необходимости считать отдельные атомы. Если состав определенных групп атомов не изменился в ходе реакции, то количество этих групп можно рассматривать как единое целое:
Последовательность операций следующая:21. определить прочность исходных атомов и группы PO.22. перенесите эти числа в правую часть уравнения:
3. написать химические формулы полученных веществ в соответствии со значениями составляющих компонентов:
4. укажите состав «самого сложного» соединения: Ca
(PO
и поставить число атомов кальция (их три) и число PO
(их два):25. Число атомов натрия и хлора до реакции теперь равно шести; добавим соответствующий коэффициент:
Эти правила составляют алгоритм уравнений реакций химического обмена, поскольку с помощью этой последовательности можно уравнять схемы многих химических реакций, за исключением более сложных окислительно-восстановительных реакций (см. урок 7).
Жизненные ситуации
Есть три основных типа химических связей. Начнем с ковалентной, в которой каждая молекула вещества — семейка атомов с несколькими общими электронами. Эти электроны спарены лишь между членами семьи одной молекулы. Представьте себе жизненную ситуацию: каждая молекула, или семья, обитает в симпатичном отдельном домике, держит в нем свое добро, сама по себе. Так живут молекулы вроде диоксида углерода, воды и аммиака — пахучего вещества, которое самопроизвольно улетучивается из удобрений.
Ионные связи возникают по принципу «противоположности притягиваются», как в случае с хлоридом натрия в примере с поваренной солью. Такой вид связи подобен житью в многоквартирнике, где у любого обитателя есть соседи слева и справа, а также сверху и снизу. Тут уже нет отдельных домиков, это одно высотное здание. Свой скарб жильцы в основном держат при себе, однако близкие соседи берут или отдают электрон-другой. Это связывает их между собой — образуются соединения с ионными связями, и атомы не расстаются друг с другом, потому что существуют как противоположно заряженные ионы.
А есть еще металлическая связь. Связь в металлах несколько страннее. Возникает она по тому же принципу притяжения противоположных зарядов, но тут у нас не жилая высотка, а, скорее, община хиппи. Все электроны — обобществленные. Эти отрицательные заряды вольно обретаются в металле, и положительно заряженные ионы металла то берут их себе попользоваться, то возвращают в коллективный котел. Поскольку все общее, нет никакого воровства — словно все держатся вместе на чистом доверии.
На одних этих связях Вселенная единой не осталась бы. Помимо сильных связей внутри молекул и веществ есть слабые взаимодействия, которые стягивают воедино целые ансамбли молекул — подобно общественным связям, удерживающим вместе человеческие сообщества. Сильнейшие из таких взаимодействий можно наблюдать в воде.
Температура
Благодаря комбинациям атомов у разных веществ молекулы неодинаковы. А если рассмотреть одно вещество, но в разных ситуациях, например, воду из водопроводного крана, в кружке чая или весеннем ручейке. Во всех трех случаях молекулы одни и те же, но ведут они себя по-разному. В горячем чае молекулы движутся наиболее быстро. В холодном ручейке гораздо медленнее. А в воде из крана молекулы движутся медленнее, чем в горячем чае, но быстрее, чем в ручейке.

Конечно, речь здесь идет о таких скоростях, с которыми человек не может передвигаться. Человек может идти со скоростью 4 – 7 км/ч. Скорость молекулы воды при комнатной температуре в среднем 590 м/с = 2124 км/ч (в кипящей воде — ≈ 2340км/ч) Это надо понимать, когда говорят, что одни молекулы движутся быстро, а другие медленно.
Когда говорят «холодно», «тепло», «горячо», то сравнивают температуру. Определяется температура любого тела тем, как движутся молекулы этого тела: быстро или медленно. Температура тем выше, чем быстрее передвигаются молекулы. Если же молекулы начинают двигаться медленнее, то и температура тела понижается.
Окружающая нас природа зависит от температуры. С понижением ее приходит осень, а потом зима. С ростом температуры зима уступает место весне, а весна – лету.
Свойства вещества также зависят от температуры. Например, мягкая резина на холоде становится твердой, а твердый лед превращается в жидкость, если его занести в теплую комнату.
Температура характеризует свойства живой и неживой природы. Значит, о ней многое нужно знать. Главное надо запомнить это: скорость движения молекул, образующих вещество, определяет его температуру.
Чтобы измерить температуру, используют приборы – термометры. Термометры бывают по назначению:
- лабораторные;
- медицинские;
- уличные;
- комнатные;
- технические.
по конструкции:
- жидкостные;
- газовые;
- механические;
- электрические;
- оптические.
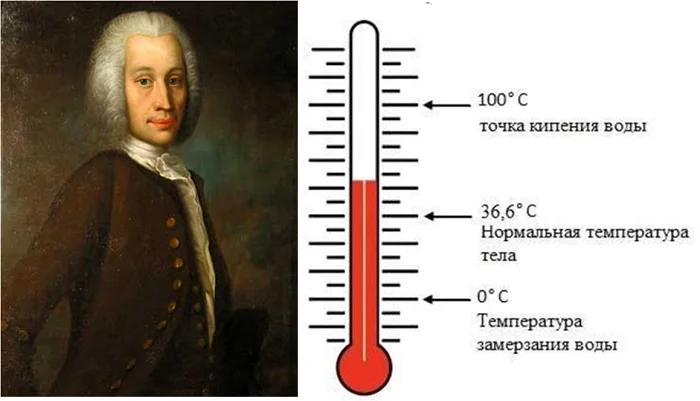
Температура измеряется в градусах. В 1742 году шведский геолог, метеоролог и астроном Андрес Цельсий придумал шкалу, в основе которой лежат отсчетные точки: температура таяния льда (0 градусов) и температура кипения воды (100 градусов).
 (Источник)
(Источник)
В 1848 году Уильям Томсон (лорд Кельвин) ввел понятие абсолютного нуля температуры (-273 градуса, минимальная возможная температура во Вселенной). При этом, температура таяния льда уже 273 градуса и соответственно кипения воды 373 градуса.
 (Источник)
(Источник)
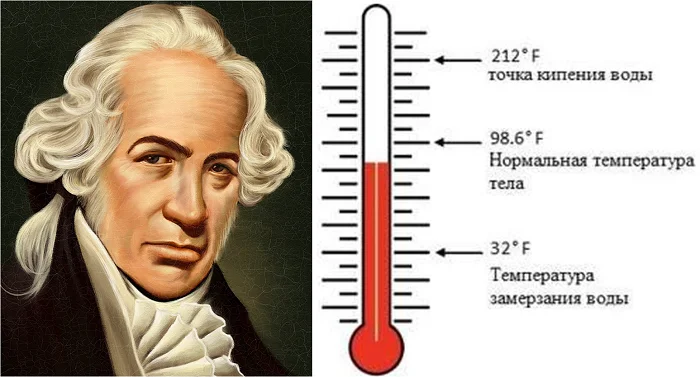
В 1724 году польско-немецкий ученый Даниель Габриель Фаренгейт создал свою шкалу, которая использовала в англоязычных странах. Сейчас она используется только в США.
 (Источник)
(Источник)
На всех трех шкалах используются две основные точки – температуры перехода выбранного вещества из одного состояния в другое.
На шкалах Цельсия и Кельвина этим веществом выбраны вода, а две точки – это температура таяния льда и кипения воды. Промежуток между этими температурами разделен на 100 частей, таким образом получен 1 градус.
Цельсий выбрал за 0о температуру плавления льда. Кельвин обозначил нулем минимальную возможную температуру (когда движение молекул прекращено). Тогда по Цельсию лед плавится при 0о С (по Кельвину при — 273о К), вода кипит при 100о С, а по Кельвину при 373о К, так как нуль Кельвина ниже нуля Цельсия на 273о. При переходе от градусов Цельсия к градусам Кельвина нужно прибавлять 273 градуса.
Фаренгейт основными точками назвал температуру, близкую к температуре застывания ртути и нормальную температуру человеческого тела. В результате температура таяния льда Фаренгейта выше примерно на 32 градуса температуры Цельсия.
Пример перехода от одной шкалы к другой:
нормальная комнатная температура
- по шкале Цельсия – 20о С;
- по шкале Кельвина – оС + 273о = 20о С + 273о = 293о К;
- по шкале Фаренгейта – о С ∙ 9/5 + 32о = 20о С ∙ 9/5 + 32о = 68о F.
Наиболее рациональной и простой в использовании считается шкала Цельсия.
(Подробно температура изучается в старших классах в разделах «Тепловые явления» и «Термодинамика»).
Молекулы в любых условиях движутся постоянно и хаотично. Движение влияет на температуру, поэтому называется оно тепловым. Тепловое движение передается и броуновским частицам. Определение этого явления: движение частиц твердого вещества, попавших в жидкость, под действием теплового движения молекул жидкости называется броуновским движением.
Итак:
- Движение молекул определяет температуру тела
- Температура измеряется термометром по шкалам Цельсия, Кельвина, Фаренгейта
- Температура – физическая характеристика тела
Атом и молекула: отличные свойства
Неделимость. Атом является мельчайшим элементом, из которого нельзя выделить еще меньшую частицу. (Получение иона влияет только на заряд, но не на вес). Молекулу, в свою очередь, можно разделить на более мелкие молекулы или можно разложить на атомы. Процесса распада легко добиться с использованием химических катализаторов. Иногда достаточно просто нагреть вещество.
Свободное существование. Молекула может свободно существовать в природе. Атом существует в вольной форме лишь в двух случаях:
- Как одноатомная ртуть или инертный газ.
- В условиях космоса — как отдельные атомы могут находиться любые химические элементы.
В остальных случаях атом всегда входит в состав молекулы.
Образование заряда. Взаимодействие между ядром и электроном в атоме можно легко преодолеть даже мельчайшим электрическим полем. Таким образом, — из атома легко получить положительный или отрицательный ион. Наличие химических связей между атомами внутри молекулы требует приложения гораздо большего электрического поля или взаимодействия с другим химически активным веществом.
https://youtube.com/watch?v=tbHvc7NsyYs
Взаимное притяжение и отталкивание молекул. 7 класс
- Подробности
- Обновлено 20.01.2019 00:20
- Просмотров: 473
1. Почему твердые тела и жидкости не распадаются на отдельные молекулы?Молекулы в веществе разделены промежутками и находятся в непрерывном беспорядочном движении.
Однако между молекулами существует взаимное притяжение.
Каждая молекула притягивает к себе соседние молекулы.
Когда мы разрываем нить, ломаем палку или отрываем кусочек бумаги, то преодолеваем силы притяжения между молекулами.
Заметить притяжение между двумя молекулами совершенно невозможно. Когда же притягиваются многие миллионы таких частиц, взаимное притяжение становится значительным. Поэтому трудно разорвать руками веревку или стальную проволоку.
2. Почему у разных веществ прочность различна?
Притяжение между молекулами в разных веществах неодинаково, поэтому прочность тел различна.
Например:
Легко разорвать лист бумаги, но трудно разбить кирпич.
Можно разбить стекло, но невозможно разбить стальную деталь.
3. На каких расстояниях работают силы притяжения между молекулами?
Между молекулами существует взаимное притяжение, которое заметно только на расстояниях, сравнимых с размерами самих молекул.
На расстоянии, превышающем размеры самих молекул, притяжение ослабевает.
Например:
Две капли воды сливаются, если они соприкасаются.
Два свинцовых цилиндра не оторвать друг от друга даже под действием груза, если их вплотную прижать друг к другу отполированными поверхностями.
Но осколки стекла нельзя срастить из-за их неровностей. Однако нагретого стекло размягчается, осколки можно сблизить, и тем самым спаять.
Здесь молекулы оказались на расстоянии не больше, чем размер молекулы.
4. Почему между молекулами имеются промежутки?
Молекулы не слипаются в результате притяжения, так как между молекулами (атомами) в то же время существует отталкивание. На расстояниях, сравнимых с размерами самих молекул, заметнее проявляется притяжение, а при дальнейшем сближении — отталкивание.
Например:
При сжатии куска резины
возникает сближение молекул и появляется отталкивание между ними. Резина распрямляется.5. Что такое смачивание и несмачивание?
Явления смачивание и несмачивания возникают между твердыми телами и жидкостями.
Например:
Гусь выходит их воды сухим.
Мы можем писать — чернила смачивают бумагу.
Хлопковыми полотенцами вытирают лицо и руки.
6. Как происходит смачивание?
При соприкосновении жидкости и твердого тела рассматривают силы притяжения между :
— молекулами внутри тведого тела,
— между молекулами внутри жидкости
— и между молекулами жидкости и тела в месте соприкосновения.
Самые сильные силы притяжения между молекулами твердого тела, поэтому молекулы твердого тела друг от друга не отрываются (и их можно не рассматривать).
Если жидкость смачивает твердое тело, то это значит, что молекулы жидкости притягиваются друг к другу слабее, чем к молекулам тела.
Когда наблюдается несмачиваемость, то это означает, что молекулы жидкости притягиваются сильнее друг к другу, чем к молекулам твердого тела.
Например:
Если к пружине подвесить горизонтально стеклянную пластинку так, чтобы она коснулась воды, то при отрывании пластинки от воды пружина растянется, т.е. между молекулами есть притяжение. На пластинке останется слой воды — пластина смочена водой. Отрыв произошел там, где молекулы воды соприкасаются друг с другом.
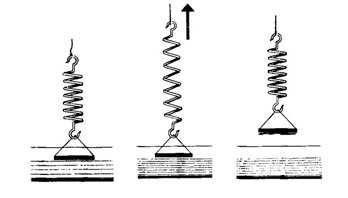
Жидкости могут смачивать одни твердые тела и не смачивать другие.
Например:
Вода не смачивает воск и парафин,
Вода не смачивает жирные поверхности.
Вода смачивает стекло, кожу, дерево и др.
Главное:
Между молекулами существует взаимное притяжение и отталкивание.
На расстояниях, сравнимых с размерами самих молекул, заметнее проявляется притяжение, а при дальнейшем сближении — отталкивание.
Явление смачивания возникает между твердыми телами и жидкостями.
Явления смачивания зависит от сил притяжения молекул твердого тела и жидкости.
Следующая страница — смотреть
Назад в «Оглавление» — смотреть
Слайды и текст этой презентации
Слайд 2Молекулы- это частицы, из которых состоят веществаМолекула вещества – это
мельчайшая частица данного вещества.. Самая малая частица воды – молекула
воды. Самая малая частица сахара – молекула сахара

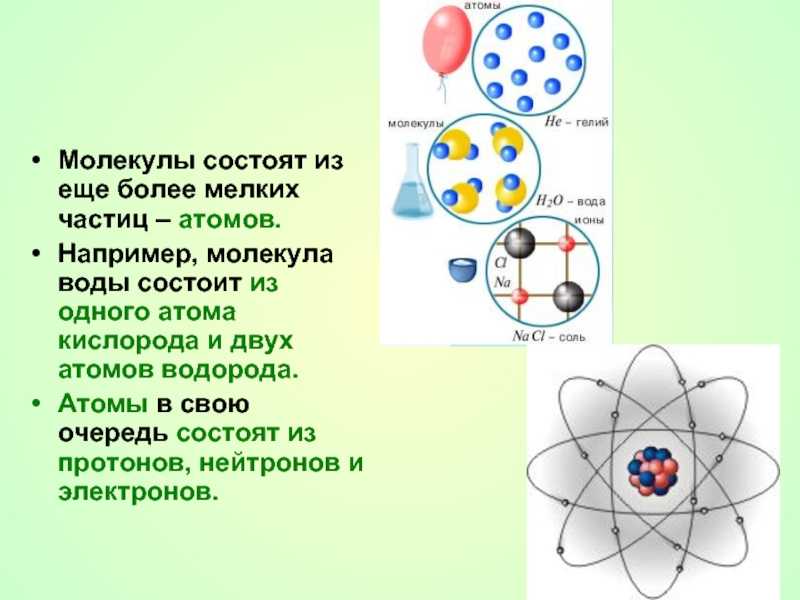
Слайд 3Молекулы состоят из еще более мелких частиц – атомов. Например,
молекула воды состоит из одного атома кислорода и двух атомов
водорода. Атомы в свою очередь состоят из протонов, нейтронов и электронов.

Слайд 5Размеры молекул
Если бы молекулы стали размером с точку на листе
бумаги. Тогда все бы тела тоже увеличились и верхушка Эйфелевой
башни достала бы до Луны, люди бы были высотой 1700 км, мыши были бы длинной 100 км, а мухи – 7 км, каждый волос был бы толщиной 100 м, красные тельца нашей крови – эритроциты имели бы в поперечнике 7м. Человек во столько раз больше атома, во сколько раз он сам меньше звезды.


Слайд 7Как увидеть молекулу? Такие малые частицы как молекулы нельзя увидеть
в простой микроскоп. Однако существуют электронные микроскопы и с их
помощью стало возможно получить фотографии молекул и даже атомов .

Слайд 9 Атомы можно увидеть в самые современные электронные микроскопы!никельплатинауглеродзолото

ступенях древних каменных лестниц?


Слайд 15ОПРЕДЕЛЕНИЕ РАЗМЕРОВ МАЛЫХ ТЕЛ МЕТОДОМ РЯДОВ
Если вам необходимо определить
размеры очень маленького тела (хотя бы макового зернышка), и осуществить
это с помощью измерительных приборов (например, линейки) невозможно, следует прибегнуть к «методу рядов».

вылила себе на голову три флакона французских духов. Как мама,
сидя к Маше спиной, догадалась о случившемся?

прозрачной?

Слайд 21И наконец, на морском берегу, разбивающем волны,Платье сыреет всегда, а
на солнце вися, оно сохнет,Видеть, однако, нельзя, как влага
на нём оседает,Да и не видно того, как она исчезает от зноя.Значит, дробится вода на такие мельчайшие части,Что недоступны они совершенно для нашего глаза.

Слайд 22г ж: O в H O – рыбы
дышат растворённым O;ж тв: вода растворяет соль, сахар;ж
ж: чайная заварка добавляется в воду и окрашивает её;г г: запахи распространяются в воздухе;тв тв: за 5 лет золото и свинец проникают друг в друга на 1 мм;г тв: O из воздуха через кожу проникает внутрь организма.

Слайд 23Диффузия в различных средах:
Газы ЖидкостиТвердые тела
Слайд 25Вопросы на засыпку…Почему трудно отвинтить гайку, долго находившуюся в туго
завинченном состоянии, хотя болт и гайка сделаны из нержавеющего металла?Вокруг
гвоздя, забитого в сырую доску, через некоторое время появляется красноватый налёт. Объясните причину.

Слайд 265. Чтобы сварить (соединить) два куска железа или стали, их нагревают
до определённой температуры, накладывают друг на друга и ударяют по
ним молотком. Объясните, зачем.6. Почему чай заваривают горячей, а не холодной или тёплой водой?

Слайд 27Что мешает семикласснику Васе, пойманному директором школы на месте курения,
распасться
Урок 1. Основные понятия и законы предмета «Химия»
Если вещество состоит из атомов только одного химического элемента, то это простое вещество. А некоторые химические элементы образуют различные простые вещества. Например, химический элемент кислород образует простое вещество «кислород» O
и простое вещество «озон» O
* В 2002 году было сообщено, что существует еще одно простое вещество — кислород O.
А химический элемент углерод образует четыре простых вещества, ни одно из которых не называется «углерод». Эти вещества отличаются пространственным расположением своих атомов:
- свежее молоко стало кислым;
- зелёные листья стали жёлтыми;
- сырое мясо при обжаривании изменило запах.
В четвертой модификации «углерода», фуллерене, атомы углерода образуют сферу, то есть молекулы фуллерена выглядят как сфера.
Наличие элемента в виде нескольких простых веществ называется аллотропией. Алмаз, графит, карбин, фуллерен являются аллотропными модификациями элемента «углерод», а кислород и озон — аллотропными модификациями элемента «кислород».
Поэтому не следует путать термины «химический элемент» и «простое вещество», а также «молекула» и «атом».
- обязательно изменяется состав или строение молекул;
- никогда не изменяется состав и заряд ядер атомов.
В письменном виде слова «молекула» или «атом» очень часто заменяются соответствующими символами, но не всегда правильно. Например, неправильно писать: «Вода содержит H
» при упоминании химического элемента водорода — H. Правильно писать: «Вода содержит ( Н )». Соответственно, правильной записью будет: «Когда металл действует в кислом растворе, H
«, т.е. вещество водород, молекула которого является двухатомной.
Сложные молекулы состоят из атомов различных химических элементов:
Как мы знаем, соединения состоят из атомов различных химических элементов. Эти атомы соединены друг с другом химическими связями: ковалентными, ионными и металлическими.
Способность атома образовывать определенное количество ковалентных химических связей называется валентностью. (Для получения дополнительной информации см. урок 4, «Химический контейнер

- О2— это молекула вещества кислорода, состоящая из двух атомов кислорода;
- Н2О — это молекула вещества воды, состоящая из двух атомов водорода и одного атома кислорода.
Вещества, состав которых отражает химические типы, могут участвовать в химических процессах (реакциях). Графическое представление конкретной химической реакции называется уравнением химической реакции. Например, при сжигании угля (в сочетании с кислородом) происходит химическая реакция:
Запись показывает, что атом углерода C соединяется с молекулой кислорода O
- 2Н2— две молекулы водорода;
- 3Н2О — три молекулы воды.
с образованием молекулы углекислого газа CO
. Количество атомов отдельных химических элементов до и после реакции должно быть одинаковым! Это правило является следствием закона сохранения массы: масса исходных материалов равна массе продуктов реакции. Закон был открыт в XVIII веке М.В. Ломоносовым и, независимо от него, А.Л. Лавуазье.
При применении этого закона коэффициенты должны быть вставлены в уравнения химических реакций таким образом, чтобы число атомов каждого химического элемента не изменялось в результате реакции. Например, при разложении соли хлорида берилла KClO.
Из чего все состоит. Молекулы
Сейчас тела рассматривают при помощи очень мощных электронных микроскопов. Через них видно, что вещество представлено множеством мельчайших подвижных «кирпичиков». У разных веществ эти «кирпичики» различны. Их называют молекулами. А если представить, что глаза – это «глаза-микроскопы», то мысленно можно увидеть эти маленькие частички.
Молекулы, оказывается, состоят из атомов, а они еще более мелкие частицы. Например, атомы кислорода и водорода, объединившись, образуют знаменитую молекулу воды. Существует шутливая фраза: «Сапоги мои того – пропускают Н2О». Н2О – химическая формула молекулы вода. Н – обозначение водорода, О – кислорода. Индекс 2 в данному случае обозначает число атомов водорода в составе молекулы воды. Молекулы газов водорода и кислорода уже новые. В них по два атома водорода и кислорода (Н2 и О2).
Существуют вещества, состоящие только из атомов. Это металлы и инертные газы (например, неон в рекламной иллюминации). Различные комбинации атомов порождают новые вещества, существующие в природе.
Люди очень давно предполагали, что вещества составлены из молекул и атомов. Еще в пятом веке до нашей эры ученый Древней Греции Демокрит высказал такую гипотезу. В России учение о молекулярном строении вещества развил М.В. Ломоносов в восемнадцатом веке.
Как же оценить размеры загадочных маленьких частиц?
Следуя правилу измерения, их нужно с чем-то сравнить. Интересен такой мысленный эксперимент: семиклассник и молекула. Если молекулу увеличить в несколько раз так, чтобы она стала размером с семиклассника, но и его увеличить во столько же раз, то семиклассник может достать до Солнца. Наука, конечно, не пользуется такими сравнениями. Современные приборы — микроскопы позволяют найти размеры атомов и молекул довольно точно. Существует возможность подсчитать и количество маленьких частиц в любом теле.
Легко догадаться, что число молекул вещества огромно. И опять интересное сравнение: если бы людей на планете Земля было столько, сколько молекул в одном кубическом сантиметре воздуха, то на одном квадратном километре Земли могли бы уместиться пять тысяч человек.
Итак, вещество состоит из молекул, а молекулы из атомов;
- разные вещества по структуре имеют разные молекулы (комбинации атомов);
- молекулы микроскопически малы, а в теле их огромное количество.
Отрицательный заряд
Так или иначе, атомы внутри молекул и веществ соединены между собой электронами — крохотными субатомными частицами, образующими облако отрицательного заряда вокруг положительно заряженного ядра. Электроны упорядочены внутри атома в соответствии со своим уровнем энергии и образуют электронные оболочки вокруг ядра, а поскольку у атомов каждого элемента разное количество электронов, на внешней оболочке атомов оказывается разное число электронов. Электронное облако атома натрия выглядит не так, как у хлора, и у этой разницы есть свои интересные следствия. Скажем больше: это вообще причина их соединения. Натрий легко отдает единственный электрон с внешней оболочки. Потеря одной отрицательно заряженной частицы превращает атом натрия в положительно заряженный ион (Na+). А вот атом хлора легко присоединяет один электрон и так заполняет свою внешнюю электронную оболочку, превращаясь в отрицательно заряженный ион (С1-). Противоположности притягиваются — и извольте: получается химическая связь. И немножко соли — хлорида натрия (NaCl).
Вдумавшись в Периодическую таблицу, понимаешь, до чего легко электроны добыть и потерять и что именно распределение отрицательного заряда определяет, как атомы вещества крепятся друг к дружке. От того, как электрон добыт, отдан или перешел в общее пользование, зависит тип связи между атомами и типы веществ, которые из этих атомов состоят.




























