Физические свойства:
Простое вещество существует в двух аллотропных модификациях: O2 и O3 (озон).Кислород, О2 — при нормальных условиях газ без цвета, вкуса и запаха. 1л его весит 1,429 г. Немного тяжелее воздуха. Слабо растворяется в воде (4,9 мл/100г при 0°C) и спирте (2,78 мл/100г при 25 °C). Хорошо растворяется в расплавленном серебре (22 объема O2 в 1 объеме Ag при 961 °C). Является парамагнетиком.Озон, О3 — аллотропная модификация кислорода. При нормальных условиях это газ голубого цвета со специфическим запахом, ядовит. В твёрдом виде (Тпл.=-197°C) представляет собой тёмно-синие, серые, практически чёрные кристаллы.
Водород
1. Водород как химический элемент
Водород — химический элемент с порядковым номером 1 — самый легкий из всех элементов периодической таблицы. В состав атома входят один протон и один электрон, такое строение является причиной уникальных свойств водорода.
Водород в периодической системе занимает особое место. С одной стороны, он может быть помещен в главную подгруппу первой группы, т.к. водород, как и щелочные металлы, способен отдавать один электрон. С другой стороны, подобно галогенам, водород способен присоединять один электрон, поэтому он может быть помещен в главную подгруппу седьмой группы.
В соединениях водород всегда одновалентен. Для него характерны две степени окисления: +1 и -1
| характеристика | водород |
| Химический знак | H |
| Электронная конфигурация | 1S1 |
| Степени окисления | +1, 0, -1 |
| степень окисления | -1 | +1 | |
| соединения | KH, MgH2 | H2 | H2O, HF, NH3 |
Существуют три изотопа водорода: протий H, дейтерий D и тритий T.
| H | D | T | |
| электроны | 1 | 1 | 1 |
| протоны | 1 | 2 | 3 |
2. Физические свойства водорода
- Температура кипения: -252,76 °С
- Температура плавления: -259,14 °С
- Слабо растворяется в воде
- Легче воздуха в 14,5 раз
- Взрывоопасное вещество
3. Химические свойства водорода
1. Взаимодействие с простыми веществами-неметаллами (проявление восстановительных свойств, повышение степени окисления)
| реагент | реакция | Условия/особенности |
| кислород | 2H2 + O2 = 2H2O | Нагревание, смесь H2 и O2 взрывоопасна |
| Хлор (возможно с другими галогенами) | H2 + Cl2 = 2HCl | Ультрафиолетовый свет или нагревание |
| Сера | H2 + S = H2S | Пропускание водорода над нагретой серой, H2S имеет запах тухлых яиц |
| Азот | N2 + 3H2 = 2NH3 | Присутствие катализатора, повышенное давление и температура |
2. Взаимодействие с простыми веществами — металлами (проявление окислительных свойств, понижение степени окисления)
| реагент | реакция | условия/особенности |
| ЩМ, ЩЗМ | 2Na + H2 = 2NaH Ca + H2 = CaH2 | Нагревание, происходит образование гидридов |
3. Взаимодействие со сложными веществами
| реагент | реакция | Примечания |
| Оксиды металлов | CuO + H2 = Cu + H2O Fe3O4 + 4H2 = 3Fe + 4H2O | Получение металлов из их оксидов в металлургии Не реагируют оксиды активных металлов (левее марганца в ряду активности) |
| Оксиды неметаллов | CO + 2H2 = CH3OH | Присутствие катализатора Смесь CO и H2 — “синтез-газ” |
| 2NO + 2H2 = N2 + 2H2O | Реакция используется в очистительных системах при производстве HNO3 |
4. Основные способы получения водорода
а) В лаборатории:
водород получают действием кислот (соляной или разбавленной серной) на металлы, стоящие в ряду напряжений до водорода (чаще цинк или железо):
Zn + 2HCl = ZnCl2 + H2
Fe + H2SO4 = FeSO4 + H2
Реакцию обычно проводят в аппарате Киппа, а для получения малых количеств водорода — в приборе Кирюшкина. Водород собирают методом вытеснения воздуха, держа пробирку донышком вверх, или методом вытеснения воды.
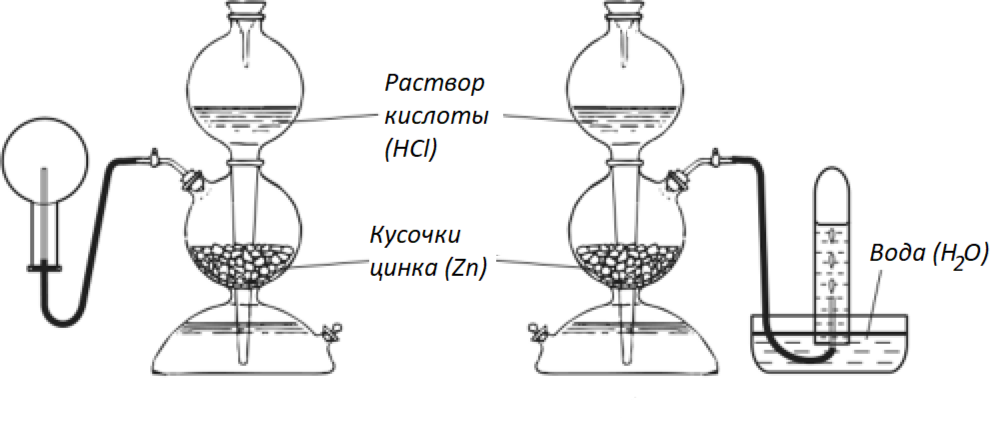
Рис. 1. Получение водорода в аппарате Киппа
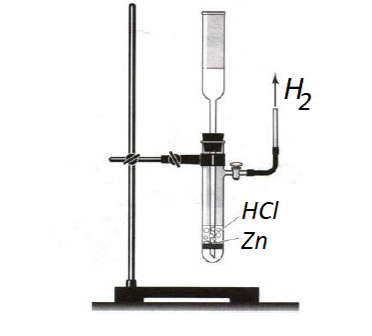
Рис. 2. Прибор Кирюшкина
б) В промышленности:
| Способ получения | Уравнение реакции |
| Газопаровая конверсия угля | C + H2O = CO + H2 |
| Взаимодействие метана с водяным паром | CH4 + H2O = CO + 3H2 |
| Разложение метана | CH4 = C + 2H2 |
| Электролиз воды | 2H2O = 2H2 + O2 |
5. Применение водорода
- Получение многих веществ
- аммиака
- хлороводорода
- метилового спирта и других органических веществ из синтез-газа
- маргарина
- металлов (например, вольфрама) из оксидов
- Жидкий водород используется как ракетное горючее
6. Вода
Физические свойства:
Чистая вода — прозрачная жидкость, без цвета, вкуса и запаха
- температура кипения: 100 °С при 1 атм
- температура плавления 0°С
- плотность 1 кг/л
Химические свойства:
С металлами (в ряду напряжений до водорода)
H2O + K = KOH + H2
С основными и кислотными оксидами:
CaO + H2O = Ca(OH)2
P2O5 + 3H2O = 2H3PO4
Гидролиз солей
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
С гидридами активных металлов
Реакции с C, CO, CH4
С галогенами
Cl2 + H2O = HCl + HClO (соляная и хлорноватистая кислоты — без нагревания)
Cl2 + H2O = HCl + HClO3 (соляная и хлорноватая кислоты — при нагревании)
7. Кристаллогидраты
Кристаллогидраты — это сложные вещества, содержащие в кристаллической решетке молекулы воды
 |
 |
 |
| медный купорос CuSO4*5H2O — пентагидрат сульфата меди (II) | кристаллическая содаNa2CO3*10H2O — декагидрат карбоната натрия | цинковый купорос ZnSO4*7H2O — гептагидрат сульфата цинка |
8. Пероксид водорода H2O2
Физические свойства:
бесцветная прозрачная жидкость со слабым своеобразным запахом, “металлическим” вкусом, слегка вязкая
Получение
Используют пероксиды и супероксиды металлов
K2O2 + H2O = KOH + H2O2
BaO2 + H2SO4 = BaSO4+ H2O2
Химические свойства
разложение в разбавленных растворах
H2O2 = H2O2+ O2
проявление окислительных свойств
KCl + H2O2 + H2SO4 = Cl2 + K2SO4 + H2O
Физические свойства кислорода:
| 400 | Физические свойства | |
| 401 | Плотность* | 0,001429 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – газ),
0,00142897 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – газ), 1,141 г/см³ (при -183 °C и иных стандартных условиях, состояние вещества – жидкость), 1,27 г/см3 (при -219 °C и иных стандартных условиях, состояние вещества – твердое тело) |
| 402 | Температура плавления* | -218,79 °C (54,36 K, -361,82 °F) |
| 403 | Температура кипения* | -182,962 °C (90,188 K, -297,332 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 0,444 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 6,82 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,911 Дж/г·K (при 15 °C), 0,9125 Дж/г·K (при 100 °C), 0,915 Дж/г·K (при 200 °C), 0,926 Дж/г·K (при 400 °C), 0,938 Дж/г·K (при 600 °C) |
| 410 | Молярная теплоёмкость* | 29,378 Дж/(K·моль) |
| 411 | Молярный объём | 11,196 см³/моль |
| 412 | Теплопроводность | 0,02658 Вт/(м·К) (при стандартных условиях),
0,027 Вт/(м·К) (при 300 K) |
| 413 | Коэффициент теплового расширения | |
| 414 | Коэффициент температуропроводности | |
| 415 | Критическая температура* | -118,57 °C (154,581 К, -181,43 °F) |
| 416 | Критическое давление* | 5,043 МПа |
| 417 | Критическая плотность | 0,41 г/см3 |
| 418 | Тройная точка | -218,79 °C (54,361 К, -361,82 °F), 0,1463 кПа |
| 419 | Давление паров (мм.рт.ст.) | 1 мм.рт.ст. (при -219 °C), 10 мм.рт.ст. (при -210,7 °C), 100 мм.рт.ст. (при -198,7 °C) |
| 420 | Давление паров (Па) | 1 кПа (при 61 K),
10 кПа (при 73 K), 100 кПа (при 90 K) |
| 421 | Стандартная энтальпия образования ΔH | 0 кДж/моль (при 298 К, для состояния вещества – газ) |
| 422 | Стандартная энергия Гиббса образования ΔG | 0 кДж/моль (при 298 К, для состояния вещества – газ) |
| 423 | Стандартная энтропия вещества S | 205,04 Дж/(моль·K) (при 298 К, для состояния вещества – газ) |
| 424 | Стандартная мольная теплоемкость Cp | 29,35 Дж/(моль·K) (при 298 К, для состояния вещества – газ) |
| 425 | Энтальпия диссоциации ΔHдисс | |
| 426 | Диэлектрическая проницаемость | 1,000486 (при 25 °C),
1,51 (при -192,78 °C) |
| 427 | Магнитный тип | Парамагнитный материал |
| 428 | Точка Кюри | |
| 429 | Объемная магнитная восприимчивость | +1,90772·10-6 |
| 430 | Удельная магнитная восприимчивость | +1,335·10-6 |
| 431 | Молярная магнитная восприимчивость | +3449,0·10-6 см3 (при 298 K, состояние вещества – газ),
+7699,0·10-6 см3 (при 90 K, состояние вещества – жидкость), +10200,0·10-6 см3 (при 54 K, состояние вещества – твердое тело) |
| 432 | Электрический тип | |
| 433 | Электропроводность в твердой фазе | |
| 434 | Удельное электрическое сопротивление | |
| 435 | Сверхпроводимость при температуре | |
| 436 | Критическое магнитное поле разрушения сверхпроводимости | |
| 437 | Запрещенная зона | |
| 438 | Концентрация носителей заряда | |
| 439 | Твёрдость по Моосу | |
| 440 | Твёрдость по Бринеллю | |
| 441 | Твёрдость по Виккерсу | |
| 442 | Скорость звука | 314 (0 °C, состояние вещества – газ) |
| 443 | Поверхностное натяжение | |
| 444 | Динамическая вязкость газов и жидкостей | 0,0192 мПа·с (при 0 °C), 0,0218 мПа·с (при 50 °C), 0,0244 мПа·с (при 100 °C), 0,029 мПа·с (при 200 °C), 0,0369 мПа·с (при 400 °C), 0,189 мПа·с (при -183 °C) |
| 445 | Взрывоопасные концентрации смеси газа с воздухом, % объёмных | |
| 446 | Взрывоопасные концентрации смеси газа с кислородом, % объёмных | |
| 446 | Предел прочности на растяжение | |
| 447 | Предел текучести | |
| 448 | Предел удлинения | |
| 449 | Модуль Юнга | |
| 450 | Модуль сдвига | |
| 451 | Объемный модуль упругости | |
| 452 | Коэффициент Пуассона | |
| 453 | Коэффициент преломления | 1,000271 (при стандартных условиях для линии D, длина волны которой приближенно равна 0,5893 μ) |
История открытия[]
Официально считается, что кислород был открыт английским химиком Джозефом Пристли 1 августа 1774 года путём разложения оксида ртути в герметично закрытом сосуде (Пристли направлял на это соединение солнечные лучи с помощью мощной линзы).
-
- 2HgO →ot 2Hg+O2↑{\displaystyle {\mathsf {2HgO\ {\xrightarrow {^{o}t}}\ 2Hg+O_{2}\uparrow }}}
Однако Пристли первоначально не понял, что открыл новое простое вещество, он считал, что выделил одну из составных частей воздуха (и назвал этот газ «дефлогистированным воздухом»). О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье. В 1775 году А. Лавуазье установил, что кислород является составной частью воздуха, кислот и содержится во многих веществах.
Несколькими годами ранее (в 1771 году) кислород получил шведский химик Карл Шееле. Он прокаливал селитру с серной кислотой и затем разлагал получившийся оксид азота. Шееле назвал этот газ «огненным воздухом» и описал своё открытие в изданной в 1777 году книге (именно потому, что книга опубликована позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода). Шееле также сообщил о своём опыте Лавуазье.
Важным этапом, который способствовал открытию кислорода, были работы французского химика Пьера Байена, который опубликовал работы по окислению ртути и последующему разложению её оксида.
Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле. Его работа имела громадное значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория. Лавуазье провёл опыт по сжиганию различных веществ и опроверг теорию флогистона, опубликовав результаты по весу сожженных элементов. Вес золы превышал первоначальный вес элемента, что дало Лавуазье право утверждать, что при горении происходит химическая реакция (окисление) вещества, в связи с этим масса исходного вещества увеличивается, что опровергает теорию флогистона.
Таким образом, заслугу открытия кислорода фактически делят между собой Пристли, Шееле и Лавуазье.
Кристаллическая решётка кислорода:
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | α-кислород (α-O2) |
| 512 | Структура решётки |
Простая моноклинная |
| 513 | Параметры решётки | a = 5,403 Å, b = 3,429 Å, c = 5,086 Å, β = 135,53° |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 155 К |
| 516 | Название пространственной группы симметрии | C12/m1 |
| 517 | Номер пространственной группы симметрии | 12 |
| 521 | Кристаллическая решётка #2 | β-кислород (β-O2) |
| 522 | Структура решётки |
Ромбоэдрическая (тригональная) |
| 523 | Параметры решётки | a = 4,21 Å, α = 46,25° |
| 524 | Отношение c/a | |
| 525 | Температура Дебая | |
| 526 | Название пространственной группы симметрии | |
| 527 | Номер пространственной группы симметрии | |
| 531 | Кристаллическая решётка #3 | γ-кислород (γ-O2) |
| 532 | Структура решётки |
Простая кубическая |
| 533 | Параметры решётки | a = 6,83 Å |
| 534 | Отношение c/a | |
| 535 | Температура Дебая | |
| 536 | Название пространственной группы симметрии | |
| 537 | Номер пространственной группы симметрии |
Химические свойства
Кислород является химически активным веществом. Он способен вступать в реакции с множеством других веществ, однако для протекания большинства этих реакций необходима более высокая, чем комнатная, температура. При нагревании кислород реагирует с неметаллами и металлами.
Если стеклянную колбу наполнить кислородом и внести в нее ложечку с горящей серой, то сера вспыхивает с образованием яркого пламени и быстро сгорает (рис. 80).
Химическую реакцию, протекающую в этом случае, можно описать следующим уравнением:
В результате реакции образуется вещество SO2, которое называется сернистым газом. Сернистый газ имеет резкий запах, который вы ощущаете при зажигании обычной спички. Это говорит о том, что в состав головки спички входит сера, при горении которой и образуется сернистый газ.
Подожженный красный фосфор в колбе с кислородом вспыхивает еще ярче и быстро сгорает, образуя густой белый дым (рис. 81).
При этом протекает химическая реакция:
Белый дым состоит из маленьких твердых частиц продукта реакции — P2O5.
Если в колбу с кислородом внести тлеющий уголек, состоящий в основном из углерода, то он также вспыхивает и сгорает ярким пламенем (рис. 82).
Протекающую химическую реакцию можно представить следующим уравнением:
Продуктом реакции является CO2, или углекислый газ, с которым вы уже знакомы. Доказать образование углекислого газа можно, добавив в колбу немного известковой воды. Помутнение свидетельствует о присутствии CO2 в колбе.
Возгорание уголька можно использовать для отличия кислорода от других газов. Если в сосуд (колбу, пробирку) с газом внести тлеющий уголек и он вспыхнет, то это указывает на наличие в сосуде кислорода.
Кроме неметаллов, с кислородом реагируют и многие металлы. Внесем в колбу с кислородом раскаленную стальную проволоку, состоящую в основном из железа. Проволока начинает ярко светиться и разбрасывать в разные стороны раскаленные искры, как при горении бенгальского огня (рис. 83).
При этом протекает следующая химическая реакция:
В результате реакции образуется вещество Fe3O4 (железная окалина). В состав формульной единицы этого вещества входят три атома железа, причем один из них имеет валентность II, а два других атома имеют валентность III. Поэтому формулу этого вещества можно представить в виде FeO * Fe2O3.
На заметку: Реакцию железа с кислородом используют для резки стальных изделий. Для этого определенный участок детали сначала нагревают с помощью кислородногазовой горелки. Затем направляют на нагретое место струю чистого кислорода, для чего перекрывают кран поступления горючего газа в горелку. Нагретое до высокой температуры железо вступает в химическую реакцию с кислородом и превращается в окалину. Так можно разрезать очень толстые железные детали.
Общие сведения:
| 100 | Общие сведения* | |
| 101 | Название | Кислород |
| 102 | Прежнее название | |
| 103 | Латинское название | Oxygenium |
| 104 | Английское название | Oxygen |
| 105 | Символ | О |
| 106 | Атомный номер (номер в таблице) | 8 |
| 107 | Тип | Неметалл |
| 108 | Группа | |
| 109 | Открыт | Карл Вильгельм Шееле, Швеция, 1771 г., Джозеф Пристли, Великобритания, 1 августа 1774 г. |
| 110 | Год открытия | 1771 г. |
| 111 | Внешний вид и пр. | Газ без цвета, запаха и вкуса |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | 4 аллотропные модификации кислорода (O), обусловленные различным составом молекул:
— кислород (O2), — озон (O3), — ε-кислород (O4 или O8) с простой моноклинной кристаллической решёткой, — ζ-кислород, металлическая фаза кислорода (On). 4 аллотропные модификации кислорода (O2), отличающихся строением кристаллической решётки: — α-кислород (α-O2) с простой моноклинной кристаллической решёткой, — β-кислород (β-O2) с ромбоэдрической (тригональной) кристаллической решёткой, — γ-кислород (γ-O2) с простой кубической кристаллической решёткой, — δ-кислород (δ-O2) |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | O2 переходит в O3 при облучении ионизирующим излучением либо жёстким ультрафиолетом.
— α-кислород существует при температуре ниже 23,65 K и иных стандартных условиях, — β-кислород существует в интервале температур от 23,65 K до 43,65 K и иных стандартных условиях, — γ-кислород (γ-O2) существует при температуре выше 43,65 K и иных стандартных условиях, — δ-кислород (δ-O2) существует в интервале температур от 20 K до 240 K и давлении 6 – 8 ГПа, — ε-кислород (O4 или O8) существует при давлении от 10 до 96 ГПа, — ζ-кислород, металлическая фаза кислорода (On) существует при давлении выше 96 ГПа |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 23,15 % |
| 119 | Содержание в земной коре (по массе) | 46 % |
| 120 | Содержание в морях и океанах (по массе) | 86 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 1 % |
| 122 | Содержание в Солнце (по массе) | 0,9 % |
| 123 | Содержание в метеоритах (по массе) | 40 % |
| 124 | Содержание в организме человека (по массе) | 61 % |
Кислород — что это за химический элемент
В природе встречается:
Простое вещество кислород является газом без цвета, вкуса и запаха.
В условиях низких температур кислород имеет вид жидкости с голубоватым оттенком. В твердом агрегатном состоянии кислород представляет собой кристаллы светло-синего цвета. В химии вещество определяют, как химически активный неметалл. Это наиболее легкий элемент из группы халькогенов.
Атомы в молекуле кислорода образуют ковалентную неполярную связь. Связь является двойной, что объясняется наличием у каждого атома двух неспаренных электронов на внешнем энергетическом уровне. Структура молекулярной кристаллической решетки кислорода является моноклинной. Электронная формулы молекулы кислорода:
Кислород обладает данной способностью. Он существует в виде нескольких простых веществ:
Процесс, при котором формировались запасы летучего кислорода в земной атмосфере, можно изобразить с помощью графика. На схеме зеленый график представляет собой нижнюю оценку уровня кислорода, красный — верхнюю оценку.
Расшифровать приведенные данные можно, таким образом:
- (3,85—2,45 млрд лет назад), в данный период кислород не образовывался.
- (2,45—1,85 млрд лет назад), при образовании кислорода его поглощали океан и породы, залегающие на морском дне.
- (1,85—0,85 млрд лет назад), происходит выделение кислорода из океана, вещество расходуется в процессе окисления горных пород на суше и при образовании озонового слоя.
- (0,85—0,54 млрд лет назад), благодаря окислению всех горных пород на суше, кислород начинает накапливаться в атмосфере.
Кислород представляет собой наиболее распространенный элемент в коре Земли. Вещество в составе различных соединений, главным образом силикатов, составляет примерно 47 % от массы твердой земной коры. Содержание связанного кислорода в морских и пресных водах достигает 85,82 % (по массе). Свыше 1500 соединений в коре планеты содержат кислород. Концентрация свободного кислорода в атмосфере равна 20,95 % по объёму и 23,10 % по массе (примерно 1015 тонн).
До того момента, пока не появились первые микробы в архее 3,5 млрд лет назад, способные участвовать в фотосинтезе, атмосфера практически не содержала кислород. Появление больших объемов этого газа связано с эпохой палеопротерозоя (3—2,3 млрд лет назад), когда произошли глобальные изменения состава атмосферы, то есть случилась «кислородная катастрофа». В течение первого миллиарда лет кислород почти полностью поглощался железом, которое было растворено в океанах. Таким образом, были сформированы запасы джеспилита.
Около 3—2,7 млрд лет назад началось выделение кислорода в атмосферу. Позднее, 1,7 млрд лет назад, объем вещества достиг 10 % от нынешнего уровня. По причине большого количества растворенного и свободного кислорода, содержащегося в океанах и атмосфере, вымерло большинство анаэробных организмов. С другой стороны, благодаря клеточному дыханию, за счет кислорода аэробные организмы стали производить значительно больше АТФ, чем анаэробные. Данное обстоятельство способствовало занятию аэробными организмами доминирующих позиций.
Начиная с кембрия, 540 млн лет назад, концентрация кислорода в атмосфере соответствовала интервалу от 15 % до 30 % по объему. Когда завершился каменноугольный период (примерно 300 миллионов лет назад) уровень содержания вещества достиг максимальных значений в 35 % по объему. По этой причине насекомые и земноводные в то время обладали крупными размерами.
По большей части кислород на Земле выделяется фитопланктоном Мирового океана. Около 60 % кислорода от используемого живыми существами идет на обеспечение процессов гниения и разложения. Около 80 % кислорода, который производят леса, потребляется в процессе гниения и разложения лесной растительности.
Деятельность человека в меньшей степени оказывает влияние на количество свободного кислорода в атмосфере. При сохранении существующих темпов фотосинтеза потребуется примерно 2 тысячи лет на восстановление всего кислорода в атмосфере. Кислород является составным компонентом многих органических веществ и всех живых клеток. По числу атомов в живых клетках он составляет около 25 %, по массовой доле — около 65 %.
Элемент в окружающей среде
Земная кора состоит в основном из кремниево-кислородных минералов, и многие другие элементы присутствуют в виде их оксидов. Газообразный кислород составляет пятую часть атмосферы. О2 в атмосфере Земли образуется в результате фотосинтеза растений, он накапливался в течение длительного времени, поскольку они использовали обильные запасы углекислого газа в ранней атмосфере и выделяли кислород.

Почти все химические вещества, кроме инертных газов, связываются с кислородом с образованием соединений. Вода, H2O и кремнезём, SiO2, основной компонент песка, являются одними из наиболее распространённых двойных кислородных соединений. Среди соединений, которые содержат более двух элементов, наиболее распространёнными являются силикаты, которые образуют большинство пород и почв. Другими соединениями, которые в изобилии встречаются в природе, являются карбонат кальция (известняк и мрамор), сульфат кальция (гипс), оксид алюминия (боксит) и различные оксиды железа, которые используются в качестве источника металла.
Элемент встречается во всех видах минералов. Некоторые общие примеры включают оксиды, карбонаты, нитраты, сульфаты и фосфаты. Оксиды — это химические соединения, которые содержат кислород и ещё один элемент. Карбонаты — это соединения, которые содержат кислород, углерод и ещё один элемент. В качестве примера можно привести карбонат натрия или соду, кальцинированную соду или солевую соду (Na2CO3), которая часто встречается в моющих и чистящих средствах.
Нитраты, сульфаты и фосфаты также содержат кислород. Другими элементами в этих соединениях являются азот, сера или фосфор плюс ещё один элемент. Примерами этих соединений являются нитрат калия или селитра (KNO3), сульфат магния или соли Эпсома (MgSO4) и фосфат кальция (Ca3 (PO 4)2).
Реакции вещества, токсические производные
Молекула кислорода характеризуется наличием прочной связи. В нормальных условиях вещество представляет собой газ с малой степенью активности, вступающий в химические реакции лишь с наиболее активными веществами. К таким веществам относятся щелочные и щелочноземельные металлы. В процессе нагрева активность кислорода резко возрастает. Вещество интенсивно вступает в химические реакции с большинством простых и многими сложными веществами, проявляя при этом окислительные свойства.
Практически все реакции с кислородом экзотермичны. По этой причине повышать температуру нужно только в начале процесса. Реакции с участием кислорода по большей части сопровождаются выделением тепловой энергии и света. Данные процессы представляют собой реакции горения, в результате которого образуются оксиды.
Определенные производные кислорода под названием «реактивные формы кислорода» аналогично синглетному кислороду, перекиси водорода, супероксиду, озону и гидроксильному радикалу, представляют собой высокотоксичные продукты. Данные вещества формируются в процессе активирования или частичного восстановления кислорода. Супероксид (супероксидный радикал), перекись водорода и гидроксильный радикал могут образовываться в клетках и тканях организма человека и животных. Данные вещества способны вызывать оксидативный стресс.
История открытия кислорода
Открытие кислорода приписывают Джозефу Пристли (Joseph Priestley). У него была лаборатория, оборудованная приборами для собирания газов. Он испытывал его физиологическое действие на себе и на мышах. Пристли установил, что после вдыхания газа некоторое время ощущается приятная легкость. Мыши в герметически закрытой банке с воздухом задыхаются быстрей, чем в банке с O2. Поскольку Пристли был приверженцем флогистонной теории он так и не узнал, что оказалось у него в руках. Он только описал этот газ, даже не догадываясь, что он описал. А вот лавры открытия кислорода принадлежат Антуан Лоран Лавуазье (Antoine Laurent de Lavoisier), который и дал ему имя.
Лавуазье, поставил свой знаменитый опыт, продолжавшийся 12 дней. Он нагревал ртуть в реторте. При кипении образовывалась ее красная окись. Когда реторту охладили, оказалось, что воздуха в ней убыло почти на 1/6 его объема, а остаток ртути весил меньше, чем перед нагревом. Но когда разложили окись ртути сильным прокаливанием, все вернулось: и недостача ртути, и «исчезнувший» кислород.
Впоследствии Лавуазье установил, что этот газ входит в состав азотной, серной, фосфорной кислот. Он ошибочно полагал, что O2 обязательно входит в состав кислот, и поэтому назвал его «оксигениум», что значит «рождающий кислоты». Теперь хорошо известны кислоты, лишенные «оксигениума» (например: соляная, сероводородная, синильная и др.).
Кислород: химические свойства
Ключевые слова конспекта: химические свойства простых веществ-неметаллов, характеристика элемента? простое вещество — кислород O2, получение кислорода.
Характеристика элемента кислорода
Кислород О – элемент № 8, 2-й период, VIA группа. Электронная конфигурация атома кислорода 1s22s22p4.
Валентные возможности кислорода – II и III (с учётом возможности образования связи по донорно–акцепторному механизму, например в ионе гидроксония Н3О+). Возможные степени окисления кислорода:
+2 – в соединении со фтором OF2;+1 – в соединении со фтором О2F2; – в простых веществах O2 (кислород), O3 (озон);–1 – в пероксидах (Н2O2, Na2O2);–2 – во всех остальных соединениях кислорода (кроме супероксидов).
Кислород – самый распространённый элемент в земной коре. Кислороду присуща аллотропия, элемент кислород образует два простых вещества – киcлород O2 и озон O3.
Кислород – простое вещество O2
Кислород является молекулярным веществом, молекула двухатомна. В молекуле кислорода связь ковалентная неполярная.
При обычных условиях кислoрoд – газ без цвета и запаха, тяжелее воздуха, плохо растворим в воде (несколько лучше, чем азот). В жидком состоянии кислород светло-голубого, в твёрдом – синего цвета.
Кислород является хорошим окислителем. Реагирует практически со всеми простыми веществами (кроме инертных газов, галогенов, благородных металлов). Так, например, киcлород окисляет металлы:
O2 + 2Zn = 2ZnO3O2 + 4Al = 2Al2O3O2 + 2Cu = 2CuO2O2 + 3Fe = Fe3O4
Кислорoд является также окислителем многих неметаллов. В некоторых случаях, для того чтобы началась реакция, требуется нагревание:
O2 + C = CO2O2 + S = SO25O2 + 4Р = 2Р2O5O2 + 2Н2 = 2Н2O
Кислoрод реагирует с азотом в электрической дуге (реакция обратима, идёт с небольшим выходом NO):
В кислороде сгорают многие горючие вещества, практически все органические вещества:
2O2 + СН4 = СO2 + 2Н202Н2S + 3O2 = 2SO2 + 2Н20
Кислoрoд окисляет многие сложные вещества – как неорганические, так и органические:
O2 + 4Fe(OH)2 + 2Н20 = 4Fe(OH)3O2 + 2СН3СНО = СН3СООН.
В промышленности кислород получают перегонкой воздуха. Способ основан на том, что у азота и кислорода разные температуры кипения. В лаборатории киcлорoд получают:
а) электролизом воды:
б) разложением пероксида водорода под действием катализатора:
в) разложением перманганата калия при нагревании:
г) разложением хлората калия (бертолетовой соли) при нагревании:
д) разложением нитратов щелочных металлов при нагревании:
Изотопы кислорода
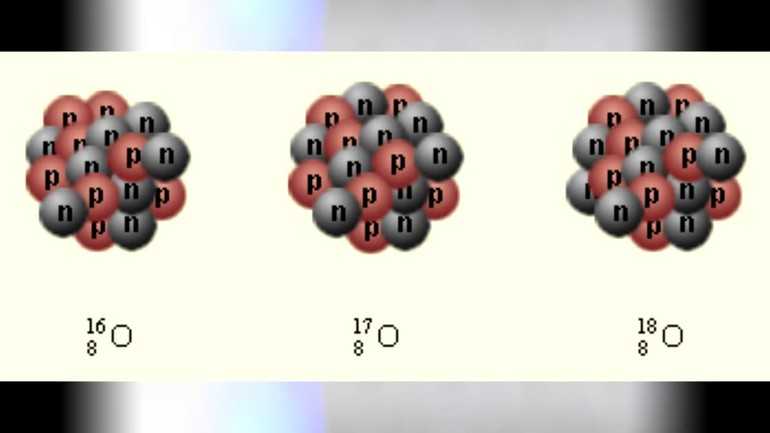
Есть три естественных изотопа О2: кислород-16, кислород-17 и кислород-18. Изотопы — это две или более формы элемента. Они отличаются друг от друга по их массовому числу. Число, написанное справа от названия элемента, является массовым числом. Оно представляет количество протонов плюс нейтронов в ядре атома элемента. Количество протонов определяет элемент, но количество нейтронов в атоме любого одного элемента может варьироваться. Каждая вариация является изотопом.
Известно также пять радиоактивных изотопов элемента. Радиоактивный изотоп — это тот, который распадается на части и испускает некоторую форму радиации. Радиоактивные изотопы образуются, когда очень маленькие частицы обжигают атомы. Эти частицы прилипают к атомам и делают их радиоактивными.
Физические свойства
Кислород более растворим в воде, чем азот. Вода содержит приблизительно одну молекулу O2 на каждые две молекулы N2 по сравнению с атмосферным отношением приблизительно от одного до четырёх. Плотность кислорода в газообразном состоянии 1,42897 кг/м3. Другими физическими свойствами элемента являются:

- Газ в нормальном состоянии бесцветный, без запаха и вкуса. Жидкий кислород слегка парамагнитен. Он реактивен и образует оксиды со всеми элементами, кроме гелия, неона, криптона и аргона. Умеренно растворим в воде.
- Элемент конденсируется при температуре -182,95С, а замерзает при -218,79С. И в жидком, и в твёрдом состоянии является прозрачным веществом светло-голубого цвета.
- Существование элемента в двух аллотропных формах. Аллотропы — это модификации элемента с различными физическими и химическими свойствами. Аллотропы О2 — это двухатомный кислород и озон, или трёхатомный. Озон встречается в довольно больших количествах в особых условиях. Например, необычно большое количество озона находится в верхних слоях атмосферы Земли. Этот озоновый слой важен для жизни на планете. Он защищает от вредного излучения, которое исходит от Солнца. Озон на уровне земли бесполезен для жизни и может вызвать проблемы со здоровьем у растений, людей и животных.
- Атомарный кислород очень высоко активен. Он способен окислять атомы элементов, которые несвойственны этому организму, и является одним из сильнейших антиоксидантов, который устраняет кислородное голодание тканей и уничтожает практически любую патогенную микрофлору (грибы, вирусы, бактерии и другие) и лишние свободные радикалы.






























