Разложение воды на водород и кислород
Существуют различные способы получения водорода и кислорода, которые условно можно разделить на промышленные и лабораторные.Один из наиболее простых и популярных методов получения и кислорода, и водорода – разложение воды на водород и кислород. Уравнение данной химической реакции имеет вид:
.
Учитывая, что разложению подверглось 100 г воды, рассчитаем её количество вещества:
;
;
![]() ;
;
.
Согласно уравнению реакции, вода, водород и кислород находятся в следующих мольных соотношениях:
;
.
Это означает, что количество вещества продуктов реакции будет равно:
;
![]() .
.
Тогда, объемы выделившихся в ходе реакции разложения воды газов будут равняться:
;;.
;
.
Как отделить кислород от водорода
Для этого нужен более сложный прибор — электролизер, который состоит из широкой загнутой трубки, наполненной раствором щелочи, в которую погружены два электрода из никеля.
Кислород будет выделяться в правом колене электролизера, куда подключен положительный полюс источника тока, а водород — в левом.
Это обычный тип электролизера, которым пользуются в лабораториях для получения небольших количеств чистого кислорода.
В больших количествах кислород получают в электролитических ваннах разнообразных типов.
Войдем в один из электрохимических заводов по производству кислорода и водорода. В огромных светлых залах-цехах строгими рядами стоят аппараты, к которым по медным шинам подводится постоянный ток. Это электролитические ванны. В них из воды можно получить кислород и водород.
Электролитическая ванна — сосуд, в котором параллельно друг другу расположены электроды. Сосуд наполняют раствором — электролитом. Число электродов в каждой ванне зависит от размера сосуда и от расстояния между электродами. По схеме включения электродов в электрическую цепь ванны делятся на однополярные (монополярные) и двухполярные (биполярные).
В монополярной ванне половина всех электродов подключается к положительному полюсу источника тока, а вторая половина — к отрицательному полюсу.
В такой ванне каждый электрод служит или анодом, или катодом, и на обеих сторонах его идет один и тот же процесс.
В биполярной ванне источник тока подключается только к крайним электродам, один из которых служит анодом, а другой — катодом. С анода ток поступает в электролит, через который он переносится ионами к близлежащему электроду и заряжает его отрицательно.
Проходя через электрод, ток снова входит в электролит, заряжая обратную сторону этого электрода положительно. Таким образом, проходя от одного электрода к другому, ток доходит до катода.
В биполярной ванне только анод и катод работают как монополярные электроды. Все же остальные электроды, расположенные между ними, являются с одной стороны катодами (—), а с другой стороны — анодами (+).
При прохождении электрического тока через ванну между электродами выделяются кислород и водород. Эти газы нужно отделить друг от друга и направить каждый по своему трубопроводу.
Существуют два способа отделения кислорода от водорода в электролитической ванне.
Первый из них заключается в том, что электроды отгораживаются друг от друга металлическими колоколами. Образующиеся на электродах газы поднимаются в виде пузырьков кверху и попадают каждый в свой колокол, откуда через верхний отвод направляются в трубопроводы.
Этим способом кислород легко отделить от водорода. Однако такое разделение приводит к излишним, непроизводительным затратам электроэнергии, так как электроды приходится ставить на большом расстоянии друг от друга.
Другой способ разделения кислорода и водорода при электролизе заключается в том, что между электродами ставится перегородка — диафрагма, которая является непроницаемой для пузырьков газа, но хорошо пропускает электрический ток. Диафрагма может быть сделана из плотно сотканной асбестовой ткани толщиной 1,5—2 миллиметра. Эту ткань натягивают между двумя стенками сосуда, создавая тем самым изолированные друг от друга катодные и анодные пространства.
Водород из всех катодных и кислород из всех анодных пространств поступают в сборные трубы. Оттуда по трубопроводам каждый газ направляется в отдельное помещение. В этих помещениях под давлением 150 атмосфер полученными газами наполняют стальные баллоны. Баллоны направляют во все уголки нашей страны. Кислород и водород находят широкое применение в различных областях народного хозяйства.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Водород из воды: просто и дешево — Наука
Российский исследователь сконструировал электролизер, позволяющий получать водород из воды, затрачивая на это очень мало энергии.
Водород — экологически чистый энергоноситель, к тому же практически неисчерпаемый. Согласно расчетам, из 1 л воды можно получить 1234, 44 л водорода. Однако переход энергетики на водородное топливо тормозят большие затраты энергии, необходимые для получения водорода из воды. Процесс электролиза идет при напряжении 1,6—2,0 В и силе тока в десятки и сотни ампер. Самые современные электролизеры расходуют на получение кубометра водорода больше энергии, чем можно получить при его сжигании (4 и 3,55 кВт.ч соответственно). Проблему уменьшения затрат энергии на получение водорода из воды решают многие лаборатории мира, но существенных результатов достичь пока не удалось. Однако в природе существует экономный процесс разложения молекул воды на водород и кислород. Протекает он при фотосинтезе. При этом атомы водорода участвуют в формировании органических молекул, а кислород уходит в атмосферу. Ячейка электролизера, разработанная Ф.Канаревым из Кубанского государственного аграрного университета, моделирует этот процесс.
Сходство с фотосинтезом заключается в том, что ячейка потребляет очень мало энергии. Фактически устройство использует напряжение всего в 0,062 В при силе тока 0,02 А. Ф.Канарев сконструировал две лабораторные модели электролизера: с коническими и цилиндрическими стальными электродами. По замыслу своего создателя, они моделируют годовые кольца ствола дерева. Даже при полном отсутствии электролита на электродах ячейки появляется разность потенциалов около 0,1В. После заливки раствора разность потенциалов возрастает. При этом положительный знак заряда всегда появляется на верхнем электроде, отрицательный — на нижнем. Ячейка низкоамперного электролизера представляет собой конденсатор. Вначале он заряжается при напряжении 1,5-2 В и силе тока, значительно большей 0,02 А, а затем постепенно разряжается под действием происходящих в нем электролитических процессов. И в это время устройство потребляет совсем немного энергии, которую тратит на подзарядку конденсатора. Даже в отключенном от сети приборе электролиз идет еще пять часов, о чем свидетельствует интенсивное бульканье пузырьков газа.
Обе модели электролизера, и с коническими, и с цилиндрическими электродами, работают с одинаковой энергетической эффективностью. Показатель этой эффективности еще предстоит уточнять. Но уже сейчас ясно, что затраты энергии на получение водорода из воды при низкоамперном электролизе уменьшаются в 12 раз, а по самым смелым подсчетам — почти в 2000 раз (т.е. составляют всего от 0,407 до 0,0023 кВт.ч на кубометр водорода). По мнению Ф.Канарева, предложенный им метод получения дешевого водорода из воды можно будет использовать для создания промышленных электролизеров, которые найдут применение в будущей водородной энергетике.
Как отделить кислород от водорода
Для этого нужен более сложный прибор — электролизер, который состоит из широкой загнутой трубки, наполненной раствором щелочи, в которую погружены два электрода из никеля.
Кислород будет выделяться в правом колене электролизера, куда подключен положительный полюс источника тока, а водород — в левом.
Это обычный тип электролизера, которым пользуются в лабораториях для получения небольших количеств чистого кислорода.
В больших количествах кислород получают в электролитических ваннах разнообразных типов.
Войдем в один из электрохимических заводов по производству кислорода и водорода. В огромных светлых залах-цехах строгими рядами стоят аппараты, к которым по медным шинам подводится постоянный ток. Это электролитические ванны. В них из воды можно получить кислород и водород.
Электролитическая ванна — сосуд, в котором параллельно друг другу расположены электроды. Сосуд наполняют раствором — электролитом. Число электродов в каждой ванне зависит от размера сосуда и от расстояния между электродами. По схеме включения электродов в электрическую цепь ванны делятся на однополярные (монополярные) и двухполярные (биполярные).
В монополярной ванне половина всех электродов подключается к положительному полюсу источника тока, а вторая половина — к отрицательному полюсу.
В такой ванне каждый электрод служит или анодом, или катодом, и на обеих сторонах его идет один и тот же процесс.
В биполярной ванне источник тока подключается только к крайним электродам, один из которых служит анодом, а другой — катодом. С анода ток поступает в электролит, через который он переносится ионами к близлежащему электроду и заряжает его отрицательно.
Проходя через электрод, ток снова входит в электролит, заряжая обратную сторону этого электрода положительно. Таким образом, проходя от одного электрода к другому, ток доходит до катода.
В биполярной ванне только анод и катод работают как монополярные электроды. Все же остальные электроды, расположенные между ними, являются с одной стороны катодами (—), а с другой стороны — анодами (+).
При прохождении электрического тока через ванну между электродами выделяются кислород и водород. Эти газы нужно отделить друг от друга и направить каждый по своему трубопроводу.
Существуют два способа отделения кислорода от водорода в электролитической ванне.
Первый из них заключается в том, что электроды отгораживаются друг от друга металлическими колоколами. Образующиеся на электродах газы поднимаются в виде пузырьков кверху и попадают каждый в свой колокол, откуда через верхний отвод направляются в трубопроводы.
Этим способом кислород легко отделить от водорода. Однако такое разделение приводит к излишним, непроизводительным затратам электроэнергии, так как электроды приходится ставить на большом расстоянии друг от друга.
Другой способ разделения кислорода и водорода при электролизе заключается в том, что между электродами ставится перегородка — диафрагма, которая является непроницаемой для пузырьков газа, но хорошо пропускает электрический ток. Диафрагма может быть сделана из плотно сотканной асбестовой ткани толщиной 1,5—2 миллиметра. Эту ткань натягивают между двумя стенками сосуда, создавая тем самым изолированные друг от друга катодные и анодные пространства.
Водород из всех катодных и кислород из всех анодных пространств поступают в сборные трубы. Оттуда по трубопроводам каждый газ направляется в отдельное помещение. В этих помещениях под давлением 150 атмосфер полученными газами наполняют стальные баллоны. Баллоны направляют во все уголки нашей страны. Кислород и водород находят широкое применение в различных областях народного хозяйства.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Электролитическое получение кислорода из воды
Большое количество кислорода получают электролизом воды.
При электролизе воды одновременно с кислородом выделяется другой ценный промышленный продукт — водород.
При наличии дешевой электроэнергии чрезвычайно выгодно получать кислород и водород из воды путем разложения ее электрическим током на составные части.
Впервые кислород и водород были получены электролизом воды примерно сто шестьдесят лет назад. Однако этот метод не находил практического применения почти в течение ста лет.
В 1888 году русский профессор Д. А. Лачинов сконструировал несколько типов электролитических ванн для получения кислорода и водорода. Через несколько лет появились первые промышленные установки по производству этих газов электролитическим путем. Это были сравнительно небольшие установки, дававшие в сутки 100—200 кубических метров Кислорода и водорода.
В настоящее время имеются установки, способные вырабатывать в один час 20 тысяч кубических метров водорода и 10 тысяч кубических метров кислорода.
Такие установки требуют много электроэнергии.
В нашей стране, где вырабатывается большое количество дешевой электрической энергии, кислород получают не только из воздуха, а широко используют электролитический способ получения кислорода и водорода из воды.
В настоящее время на крупных реках идет строительство новых гигантских гидроэлектростанций. Через четыре-пять лет они дадут свыше 22 миллиардов киловатт — часов электроэнергии в год. Часть этой дешевой электроэнергии пойдет на электрохимические предприятия, в том числе и на заводы по электролизу воды.
Похожие патенты RU2675862C2
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ВОДОРОДА ПРИ РАЗЛОЖЕНИИ ВОДЫ | 2016 | RU2640227C2 | |
| СПОСОБ ПОЛУЧЕНИЯ ВОДОРОДНОЙ ВОДЫ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2017 | RU2645492C2 | |
| УСТРОЙСТВО РАЗЛОЖЕНИЯ ВОДЫ НА КИСЛОРОД И ВОДОРОД ЭЛЕКТРОМАГНИТНЫМИ ПОЛЯМИ | 2017 | RU2645504C2 | |
| УСТРОЙСТВО ПОЛУЧЕНИЯ ВОДОРОДНОЙ И КИСЛОРОДНОЙ ВОДЫ | 2018 | RU2671720C2 | |
| СПОСОБ ОБЕЗВОЖИВАНИЯ ПИЩЕВЫХ ПРОДУКТОВ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2017 | RU2642174C2 | |
| УСТРОЙСТВО ПОЛУЧЕНИЯ ОБОГАЩЁННОЙ КИСЛОРОДОМ И ОБОГАЩЁННОЙ ВОДОРОДОМ ВОДЫ | 2019 | RU2727362C2 | |
| СПОСОБ ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ РАБОТЫ ПЛАЗМЕННОВОДОРОДНОГО ИЗЛУЧАТЕЛЯ | 2016 | RU2640193C2 | |
| СПОСОБ ПОЛУЧЕНИЯ ОБОГАЩЁННОЙ КИСЛОРОДОМ И ОБОГАЩЁННОЙ ВОДОРОДОМ ВОДЫ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2018 | RU2696713C2 | |
| УСТРОЙСТВО ДЛЯ ПОЛУЧЕНИЯ ЭЛЕКТРОАКТИВИРУЕМОЙ ВОДЫ | 2016 | RU2640530C2 | |
| СПОСОБ ОПРЕДЕЛЕНИЯ МАКСИМАЛЬНОЙ ПРОИЗВОДИТЕЛЬНОСТИ РАЗЛОЖЕНИЯ ВОДЫ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ (ВОДОРОДНАЯ ЯЧЕЙКА) | 2013 | RU2506349C2 |
Получение водорода в домашних условиях
В данной статье описаны наиболее популярные способы получения дешевого водорода в домашних условиях.
Способ 1. Водород из алюминия и щелочи.
Используемый раствор щелочи – едкого кали (гидроксид калия), либо едкого натра (гидроксид натрия, продается в магазинах, как средство очистки труб «Крот»). Выделяемый водород более чистый, чем при реакции кислот с активными металлами.
Насыпаем в колбу небольшое количество едкого кали либо натра и заливаем 50 -100 мл воды, перемешиваем раствор до полного растворения кристаллов. Далее добавляем несколько кусочков алюминия. Сразу же начнется реакция с выделением водорода и тепла, сначала слабая, но постоянно усиливающаяся.Дождавшись пока реакция будет происходить более активно, аккуратно добавим еще 10г. щелочи и несколько кусочком алюминия. Так мы значительно усилим процесс.Закупориваем колбу, пробиркой с трубкой ведущей сосуд для сбора газа. Ждем примерно 3 -5 мин., пока водород вытеснит воздух из сосуда.
Как образуется водород? Оксидная пленка, которая покрывающая поверхность алюминия, при контакте с щелочью разрушается. Так как алюминий является активным металлом, то он начинает реагировать с водой, растворяясь в ней, при этом выделяется водород.
https://youtube.com/watch?v=P_jfp3I160A
Способ 2. Водород из алюминия, сульфата меди и пищевой соли.
В колбу насыпаем немного сульфата меди (медный купорос, продается в любом магазине для сада), и соли (соли чуть больше). Добавляем воду и перемешиваем до полного растворения. Раствор должен, окрасится в зеленый цвет, если этого не произошло, добавьте еще небольшое количество соли.Колбу необходимо поставить в чашку наполненной холодной водой, т.к. при реакции, будет выделятся большое количество тепла.Добавляем в раствор несколько кусочков алюминия. Начнется реакция.
Как происходит выделение водорода? В процессе образуется хлорид меди, смывающий оксидную пленку с метала. Одновременно с восстановлением меди происходит образование газа.
Способ 3. Водород из цинка и соляной кислоты.
Помещаем в пробирку кусочки цинка и заливаем их соляной кислотой.Являясь активным металлом цинк, взаимодействуя с кислотой, вытесняет из нее водород.
Способ 4. Производство водорода электролизом.
Пропускаем через раствор воды и проваренной соли электрический ток (12В). При реакции, будет выделятся водород (на аноде) и кислород (на катоде).
При получении водорода и последующих экспериментах, соблюдайте технику безопасности.
Ученые расщепили воду на водород и кислород, используя обычную батарейку
Ученые из Стэнфордского университета разработали необычное устройство, которое использует обычную 1,5-вольтовую батарейку, для расщепления воды на водород и кислород при комнатной температуре. Их разработка может являться дешевым и удобным способом для производства горючего для водородных автомобилей.
Расщепитель воды производится из относительно дешевых металлов, никеля и железа, через которые пропускается ток от обычной батарейки типа ААА, сообщает ресурс Gizmag.
«Нам впервые удалось расщепить воду при низком напряжении, используя недорогие металлы
Это очень важно, ведь ранее для подобных целей использовались дорогие металлы, такие как платина или иридий», — говорит ведущий исследователь Hongjie Dai
Технология имеет огромный потенциал в качестве источника питания для водородных двигателей, которые уже давно пророчат на смену бензиновым. В отличие от бензиновых двигателей, которые производят много вредных выбросов в атмосферу, в качестве побочного продукта у водородных агрегатов является вода.
Ранее водородные двигатели критиковали за их высокую стоимость, отсутствие развитой инфраструктуры и низкую энергоэффективность. Однако, по мнению исследователей из Стэнфордского университета, их изобретение может значительно исправить большинство этих недостатков.
«На протяжении многих лет ученые пытались сделать недорогие электрокатализаторы с высокой эффективностью и длительным сроком службы. Когда мы обнаружили, что никель является столь же эффективным, как и платина, это стало для нас неожиданностью», — объясняет Hongjie Dai.
Катализатор из никеля и оксида никеля требует для расщепления воды значительно меньшее напряжение, по сравнению с чистым никелем или чистым оксидом никеля. Однако, как сообщают создатели, данная технология еще довольно «сырая» и не совсем готова для коммерческого использования.
В будущем ученые планируют разработать катализатор, работающий от солнечной энергии вместо батарейки. Ведь исследователи полагают, что их изобретение может существенно повлиять на производство водородных автомобилей. Кстати, напомним, что компания Toyota, планирует в следующем году представить автомобиль с двигателем, работающем на водороде.
Ученые расщепили воду на водород и кислород, используя обычную батарейку
Ученые из Стэнфордского университета разработали необычное устройство, которое использует обычную 1,5-вольтовую батарейку, для расщепления воды на водород и кислород при комнатной температуре. Их разработка может являться дешевым и удобным способом для производства горючего для водородных автомобилей.

Расщепитель воды производится из относительно дешевых металлов, никеля и железа, через которые пропускается ток от обычной батарейки типа ААА, сообщает ресурс Gizmag.
Технология имеет огромный потенциал в качестве источника питания для водородных двигателей, которые уже давно пророчат на смену бензиновым. В отличие от бензиновых двигателей, которые производят много вредных выбросов в атмосферу, в качестве побочного продукта у водородных агрегатов является вода.
Ранее водородные двигатели критиковали за их высокую стоимость, отсутствие развитой инфраструктуры и низкую энергоэффективность. Однако, по мнению исследователей из Стэнфордского университета, их изобретение может значительно исправить большинство этих недостатков.
Катализатор из никеля и оксида никеля требует для расщепления воды значительно меньшее напряжение, по сравнению с чистым никелем или чистым оксидом никеля. Однако, как сообщают создатели, данная технология еще довольно «сырая» и не совсем готова для коммерческого использования.
В будущем ученые планируют разработать катализатор, работающий от солнечной энергии вместо батарейки. Ведь исследователи полагают, что их изобретение может существенно повлиять на производство водородных автомобилей. Кстати, напомним, что компания Toyota, планирует в следующем году представить автомобиль с двигателем, работающем на водороде.
Обычная батарейка расщепляет воду на кислород и водород!
В отличие от традиционного топлива, которое выделяет вредные выхлопные газы, загрязняющие атмосферу и приводящие к изменению климатических условий, водородное топливо абсолютно безвредно для окружающей среды.
Почему все транспортные средства не используют водород в качестве топлива?
До сих пор экологически чистый процесс получения водорода требовал большого количества драгоценных металлов, что значительно повышает стоимость водородного топлива, особенно в сравнении с традиционным.
Путем химического взаимодействия атомов водорода с атомами кислорода, находящегося в воздухе, водородное топливо вырабатывает достаточно энергии для двигателя автомобиля, а «выхлопами» такого мотора становится чистая вода. Однако сегодня практически каждый «чистый» двигатель, который работает на водородном топливе, использует водород, полученный с помощью природного газа – процесс, экологическая чистота которого находится под сомнением.
Как получить «чистый» водород?
С помощью электрических потоков воду можно разделить на атомы кислорода и водорода. Этот процесс требует большого количества дорогих металлов, таких как платина или иридий, – они хорошо проводят электричество и не портятся, находясь в воде долгое время.
Процесс расщепления молекулы воды на атомы водорода и кислорода называется электролизом и проходит следующим образом: два электрода опускаются в воду, по ним проводится ток, под действием которого атомы водорода стремятся к отрицательно заряженному катоду, а атомы кислорода к положительно заряженному аноду.
Новый прорыв
Ученые из Стэндфордского университета провели уникальный эксперимент, в результате которого совершили процесс электролиза с помощью стандартных никелевых электродов под рекордно низким напряжением — обычная батарейка в 1.5 Вольт.
По данным ученых, конструкция электродов из никеля и его оксида позволила процессу успешно завершиться под таким низким напряжением. До этого никому не удавалось совершить подобное. Новая технология в промышленных масштабах поможет производителям водородного топлива значительно сэкономить на электричестве и проводниках. Сейчас ученые работают над тем, как увеличить продолжительность работы никелевых проводников в воде.
Обычная батарейка расщепляет воду на кислород и водород!
В отличие от традиционного топлива, которое выделяет вредные выхлопные газы, загрязняющие атмосферу и приводящие к изменению климатических условий, водородное топливо абсолютно безвредно для окружающей среды.
Почему все транспортные средства не используют водород в качестве топлива?
До сих пор экологически чистый процесс получения водорода требовал большого количества драгоценных металлов, что значительно повышает стоимость водородного топлива, особенно в сравнении с традиционным.
Путем химического взаимодействия атомов водорода с атомами кислорода, находящегося в воздухе, водородное топливо вырабатывает достаточно энергии для двигателя автомобиля, а «выхлопами» такого мотора становится чистая вода. Однако сегодня практически каждый «чистый» двигатель, который работает на водородном топливе, использует водород, полученный с помощью природного газа – процесс, экологическая чистота которого находится под сомнением.
Как получить «чистый» водород?
С помощью электрических потоков воду можно разделить на атомы кислорода и водорода. Этот процесс требует большого количества дорогих металлов, таких как платина или иридий, – они хорошо проводят электричество и не портятся, находясь в воде долгое время.
Процесс расщепления молекулы воды на атомы водорода и кислорода называется электролизом и проходит следующим образом: два электрода опускаются в воду, по ним проводится ток, под действием которого атомы водорода стремятся к отрицательно заряженному катоду, а атомы кислорода к положительно заряженному аноду.
Новый прорыв
Ученые из Стэндфордского университета провели уникальный эксперимент, в результате которого совершили процесс электролиза с помощью стандартных никелевых электродов под рекордно низким напряжением — обычная батарейка в 1.5 Вольт.
По данным ученых, конструкция электродов из никеля и его оксида позволила процессу успешно завершиться под таким низким напряжением. До этого никому не удавалось совершить подобное. Новая технология в промышленных масштабах поможет производителям водородного топлива значительно сэкономить на электричестве и проводниках. Сейчас ученые работают над тем, как увеличить продолжительность работы никелевых проводников в воде.
Получение кислорода в лабораторных условиях
В химической лаборатории кислород можно получать нагреванием некоторых сложных веществ, в состав которых входят атомы кислорода. К числу таких веществ относится вещество KMnO4, которое имеется в вашей домашней аптечке под названием «марганцовка».
Вы знакомы с простейшими приборами для получения газов. Если в один из таких приборов поместить немного порошка KMnO4 и нагреть, то будет выделяться кислород (рис. 76):

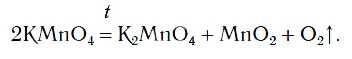
Кислород можно также получить разложением пероксида водорода H2O2. Для этого в пробирку с H2O2 следует добавить очень небольшое количество особого вещества — катализатора — и закрыть пробирку пробкой с газоотводной трубкой (рис. 77).
Для данной реакции катализатором является вещество, формула которого MnO2. При этом протекает следующая химическая реакция:
Обратите внимание на то, что ни в левой, ни в правой частях уравнения формулы катализатора нет. Его формулу принято записывать в уравнении реакции над знаком равенства
Для чего же добавляется катализатор? Процесс разложения H2O2 при комнатных условиях протекает очень медленно. Поэтому для получения заметных количеств кислорода необходимо много времени. Однако эту реакцию можно резко ускорить путем прибавления катализатора.
Катализатор — это вещество, которое ускоряет химическую реакцию, но само в ней не расходуется.
Именно потому, что катализатор не расходуется в реакции, мы не записываем его формулу ни в одной из частей уравнения реакции.
Еще один способ получения кислорода — разложение воды под действием постоянного электрического тока. Этот процесс называется электролизом воды. Получить кислород можно в приборе, схематично изображенном на рисунке 78.
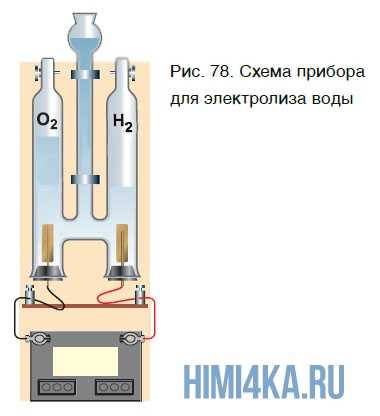
При этом протекает следующая химическая реакция:
Как отделить водород и кислород с помощью электролиза: 6 проверенных методов
Для выполнения электролиза в домашних условиях можно использовать следующие проверенные методы:
- Использование разделительной мембраны: в данном методе использование разделительной мембраны между двумя электродами позволяет отделить образующийся водород и кислород.
- Использование соли: добавление небольшого количества соли в воду увеличивает электропроводность, что способствует более эффективному процессу электролиза.
- Использование катализатора: добавление небольшого количества катализатора, такого как медь или платина, на электроды может ускорить процесс разложения воды.
- Изменение напряжения: изменение напряжения, подаваемого на электроды, позволяет контролировать скорость процесса электролиза.
- Использование разных материалов электродов: использование электродов из разных материалов, таких как медь и алюминий, может влиять на скорость разложения воды.
- Управление расстоянием между электродами: изменение расстояния между электродами позволяет контролировать интенсивность процесса электролиза.
Данные методы являются проверенными и могут быть использованы для получения водорода и кислорода электролизом в домашних условиях.
Как получить водород?
Производство водорода – одна из главных образующих цепочек водородной энергетики. Водород в чистом виде, практически не встречается в природе, поэтому он должен извлекаться из других химических веществ различными методами и способами.
Как получить водород: методы
- Паровая конверсия метана и природного газа: водяной пар при высокой температуре (700 – 1000 градусов Цельсия) смешивается с метаном под давлением, в присутствии катализирующего вещества.
- Газификация угля: один из старейших способов получения водорода. Без доступа воздуха, при температуре 800 – 1300 градусов Цельсия нагревают уголь вместе с водяным паром, при этом из воды уголь вытесняет кислород. На выходе получается углекислый газ и водород.
- Электролиз воды.: очень простой способ получения водорода. В емкость наливается раствор соды, в который помещается 2 электрических элемента, один соответствует минусу – катод, другой плюсу – анод. В данный раствор подается электричество, которое разлаживает воду на составляющие – водород выделяется на катоде, а кислород на аноде.
- Пиролиз: разложение воды на водород и кислород без доступа воздуха и при высокой температуре.
- Частичное окисление: сплав металлов алюминия и галлия формируют в специальные брикеты, которые помещают в емкость с водой, в результате химической реакции образуется водород и окись алюминия. Галлий используется в сплаве для предотвращения окисления алюминия.
- Биотехнологии: еще в 20 веке было обнаружено, что если водорослям хламидомонадам не будет хватать кислорода и серы в процессе жизнедеятельности, то они бурно начнут выделять водород.
- Глубинный газ планеты: в недрах земли водород может находится в чистом газообразном виде, но его выработка оттуда не целесообразна.
Как из воды получить водород
Наиболее простым способом получения водорода из воды является электролиз. Электролиз — химический процесс, при котором раствор электролита, под воздействием электрического тока, разделяется
Ролевые электроды — эффективный способ получения водорода и кислорода
Ролевые электроды представляют собой специальные электроды, которые позволяют проводить электролиз с высокой эффективностью. Они состоят из проводящей основы, покрытой слоем активного катализатора, который способствует разложению воды на водород и кислород. Катализатор, как правило, изготавливают из платины или других металлов, которые обладают высокой электропроводностью и каталитической активностью.
Преимуществами ролевых электродов являются:
| Высокая эффективность | Ролевые электроды обеспечивают максимальное разложение воды на водород и кислород, что позволяет получить большое количество этих газов. |
| Долговечность | Ролевые электроды имеют высокую стабильность и долговечность, что позволяет использовать их в технологических процессах в течение длительного времени. |
| Низкая потребность в энергии | Ролевые электроды позволяют проводить электролиз при низком напряжении и значительно сэкономить энергию. |
Кроме того, ролевые электроды обладают высокой степенью точности и контроля процесса электролиза. Их конструкция позволяет создать оптимальные условия для электролиза, что способствует повышению его эффективности и производительности.
Таким образом, использование ролевых электродов является эффективным способом получения водорода и кислорода путем электролиза воды. Они обеспечивают высокую эффективность разложения воды, долговечность и экономичность процесса.


























