Физические свойства V, Nb, Ta
Ванадий:
- металл стального цвета, обладающий высокой твердостью, температурой плавления и пластичностью;
- более тяжелый, чем титан, но легче железа в 1,5 раза;
- введение легирующих добавок углерода повышает температуру плавления (10% — на 1000°C), но снижает пластичность;
- на воздухе или в атмосфере кислорода при высокой температуре становится хрупким по причине образования твердых растворов кислорода в металле.
Ниобий и тантал:
- металлы, внешним видом похожие на сталь;
- обладают очень высокими температурами плавления;
- ниобий обладает самой высокой среди всех металлов температурой перехода в сверхпроводящее состояние (9,2К).
Применение V, Nb, Ta:
- основное применение ванадия — в качестве легирующих добавок к стали, в которых ванадий в виде карбидов V2C, V8C7 распределяется по всем объему, повышая твердость, износостойкость, вязкость, упругость изделия;
- входит в состав магнитных сплавов, применяемых в сердечниках трансформаторов;
- ниобий применяется в качестве легирующей добавки (200 г на тонну) к цветным металлам и специальным сортам сталей, значительно увеличивая коррозионную стойкость материла не ухудшая при этом пластичность изделия;
- при добавлении 0,05% ниобия к алюминию, он перестает взаимодействовать с щелочами;
- ниобий используется при изготовлении защитных оболочек ТВЭЛов, поскольку до 900°C не реагирует с ураном;
- стали, легированные ванадием и ниобием, используются при изготовлении труб большого диаметра, используемых для прокладки нефтепроводов;
- тантал используется в оксидных конденсаторах, в качестве напыления на металлические пластины;
- высокая твердость и коррозионная стойкость тантала нашли применение в изготовлении хирургических и зубоврачебных инструментов;
- оксид тантала добавляют в стекла с целью повышения их отражательной способности.
Диагностика возможных неисправностей
Чаще всего встречается такая неисправность, как пробой диэлектрической пленки на аноде. Ее толщина составляет всего несколько тысяч ангстрем, а это тоньше человеческого волоса примерно в 500 раз.

Незначительный скачок напряжения может привести к пробою, при котором диэлектрическая пленка приобретает кристаллическую структуру и становится проводником электричества. В этом случае конденсатор становится проводником и сопротивление между анодом и катодом приближается к нулевому значению. На корпусе при пробое часто визуально заметно потемнение и иногда обугливание защитного покрытия из краски.
Более сложно диагностировать потерю номинального значения емкости. В домашних условиях выявить такую неисправность невозможно, для этого требуется специализированное диагностическое оборудование.
Получение ванадия, ниобия, тантала
Примерно половину всего производимого ванадия получают переработкой железных ванадийсодержащих руд. На первом этапе производства, в домне ванадий из руды переходит в чугун, а при выплавке стали — в шлаки в форме оксида ванадия (III) и железа (II). Такие шлаки и являются основным сырьем при производстве ванадия.
Шлак смешивают с хлоридом натрия, после чего прокаливают при температуре 800°C на воздухе:
4FeV2O4+8NaCl+7O2 → 8NaVO3+2Fe2O3+4Cl2↑
Выделяющийся в ходе реакции хлор реагирует со шлаком:
2FeV2O4+9Cl2 = 4VOCl3+2FeCl3+2O2↑
Образующийся в ходе реакции плав, затем выщелачивается содой, и на последнем этапе — раствором серной кислоты осаждается оксид ванадия (V).
Металлический ванадий получают восстановлением из оксида кальцием:
V2O5+5Ca = 2V+5CaO
Поскольку ниобий и тантал в рудах содержатся в очень малых количествах (сотые доли процента), перед их промышленным использованием, такие руды предварительно обогащают при помощи различных методов (магнитных, химических, флотационных, гравитационных). Полученные, в ходе обогащения руд, концентраты (ниобаты и танталаты металлов) разлагают в горячей плавиковой кислоте, а затем спекают с содой или хлорируют. Самым сложным этапом является разделение соединений ниобия и тантала, посколкьу эти металлы обладают очень схожими свойствами.
Достоинства и недостатки
 Как и танталовые, так и ниобиевые конденсаторы имеют свои положительные и отрицательные качества. Главное их достоинство — это малый размер при относительно большой емкости. А недостаток, который значительно ограничивает сферу их применения, это малая электрическая прочность. Самые мощные образцы способны стабильно и надежно функционировать при напряжениях до 35 В.
Как и танталовые, так и ниобиевые конденсаторы имеют свои положительные и отрицательные качества. Главное их достоинство — это малый размер при относительно большой емкости. А недостаток, который значительно ограничивает сферу их применения, это малая электрическая прочность. Самые мощные образцы способны стабильно и надежно функционировать при напряжениях до 35 В.
Принятая стандартная маркировка танталовых конденсаторов состоит из указания плюсового контакта и численного значения. А цвет корпуса указывает рабочее напряжение. Например:
- розовый цвет — напряжение до 35 В;
- белый цвет — до 30 В;
- серый цвет — до 35 В;
- голубой цвет — до 20 В;
- зеленый цвет — до 16 В;
- черный цвет — до 10 В;
- желтый цвет — до 6,3 В.
Система старой маркировки более сложная и неудобная, поэтому от нее отказались. Она состояла из трех полос и точки разного цвета. Цвет полос соответствовал численному значению, а цвет точки указывал множитель, на который умножалось численное значение. Такая система часто вводила в заблуждение радиотехников и требовала повышенного внимания при работе с конденсаторами, поэтому от нее и отказались и разработали новую маркировку.
Тантал способствовал прогрессу
 С самого зарождения радиоэлектроники велись исследования, которые были направлены на уменьшение размеров конструктивных элементов. Основное направление в этом вопросе — это увеличение рабочей частоты сигнала. Если сравнить два силовых трансформатора с частотой работы 50 и 400 Гц, то второй примерно в 8 раз меньше по размерам, чем первый.
С самого зарождения радиоэлектроники велись исследования, которые были направлены на уменьшение размеров конструктивных элементов. Основное направление в этом вопросе — это увеличение рабочей частоты сигнала. Если сравнить два силовых трансформатора с частотой работы 50 и 400 Гц, то второй примерно в 8 раз меньше по размерам, чем первый.
Устаревшие конструкции конденсаторов представляют собой свернутые рулоны тонкой фольги из алюминия, которые помещаются в электролит. Достижение большой емкости было возможно только за счет увеличения размеров самого элемента. Еще один недостаток такой конструкции — это большая паразитная индуктивность при работе на частотах 100 кГц и выше.
Прорыв в производстве конденсаторов большой емкости и малого размера был достигнут при использовании тантала. Этот редкоземельный металл дороже золота и его добыча довольно сложная, но требуется его для изготовления одного элемента очень мало — не более нескольких микрограммов. Постепенно танталовые электролитические конденсаторы вытеснили устаревшие на основе алюминиевой фольги, так как их производство усовершенствовалось, а стоимость стала довольно низкой.
Химические свойства V, Nb, Ta
Ванадий является более активным металлом, чем ниобий и тантал, но менее, чем титан. Из кислот-неокислителей, ванадий вступает в реакцию только с плавиковой кислотой:
2V+12HF = 2H3[VF6]+3H2↑
С горячим раствором концентрированной серной кислоты ванадий окисляется до соединений ванадила:
2V+12HF = 2H3[VF6]+3H2↑
Азотная кислота с плотностью выше 1,35 г/см3 окисляет и растворяет ванадий:
V+3H2SO4 = VOSO4+2SO2↑+3H2O
Полностью окисляют ванадий до высших степеней окисления хлорная, хлорноватая, бромноватая, йодноватая и пероксодисерная кислоты: HClO4, HClO3, HBrO3, HIO3, H2S2O8. Лучше всего ванадий растворяют царская водка и смесь азотной и плавиковой кислоты. При н.у. ванадий практически не окисляется на воздухе, не реагирует с растворами органических кислот и щелочей.
Реакционная активность ванадия повышается по мере роста температуры — порошок ванадия при нагревании на воздухе воспламеняется. С азотом при температуре 1000°C ванадий образует нитрид VN, с водородом — гидрид VH (500-900°C). Легче всего ванадий реагирует с галогенами, образуя при нагревании фториды (VF5), тетрахлориды (VCl4), трибромиды (VBr3), дииодиды (VI2).
Ниобий, и в большей степени тантал, еще менее склонны вступать в реакции с другими веществами, что объясняется наличием прочной защитной оксидной пленки на их поверхности. При н.у. ниобий медленно реагирует только со смесью азотной и плавиковой кислот, а тантал вообще с кислотами не реагирует. Даже при нагревании до температуры красного каления на воздухе слитки ниобия и тантала только тускнеют с поверхности. Измельченные в порошок ниобий и тантал при нагревании до 900°C сгорают в кислороде, мелкоизмельченный ниобий воспламеняется в расплавленной селитре. С галогенами ниобий и тантал взаимодействуют при нагревании до высоких температур. Также при значительном нагревании тантал и ниобий реагируют с серой, углеродом, аммиаком, азотом, сероводородом, водородом (реакция обратима).
Конструктивные особенности устройства
Физико-химические свойства, которыми обладают тантал и ниобий, позволяют создавать из них анод особой пористой структуры. Такие структуры имеют внутреннюю поверхность в несколько десятков раз больше, чем наружную. А это дает возможность накапливать значительный электрический заряд.
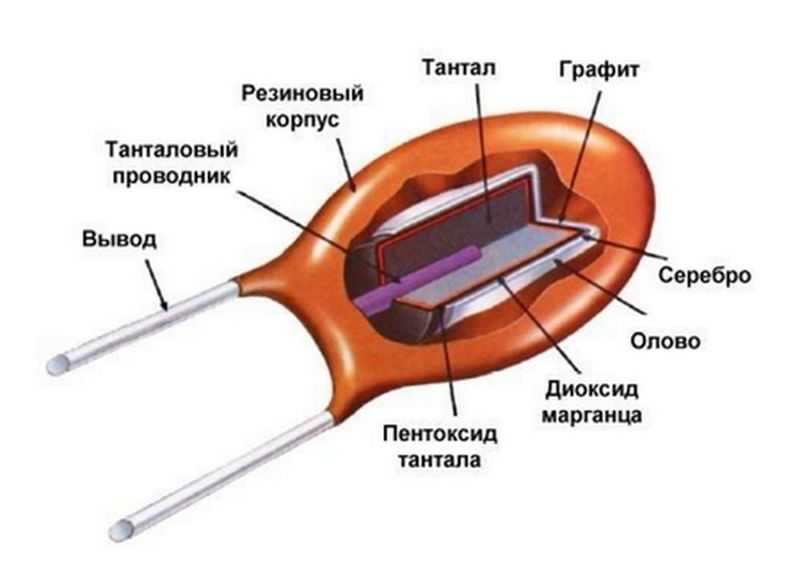
Любой современный электролитический конденсатор состоит их трех конструктивных элементов:
- катода и анода;
- диэлектрического слоя;
- одного из видов электролита (щелочи, кислоты, воды, твердого или мягкого вещества).
В роли диэлектрика выступает тончайшая оксидная пленка. Ее получают методом электрохимической коррозии при пропускании электрического тока через анод на стадии производства.
Электролитом служит твердое вещество — диоксид марганца. Он имеет малый коэффициент линейного расширения, не вытекает и не высыхает, как жидкие электролиты. Внутренняя часть катода изготавливается из серебра для увеличения проводимости.
https://youtube.com/watch?v=teSZkSES8pc











![Почему тантал и ниобий названы в честь героев древнегреческой мифологии?. новейшая книга фактов. том 3 [физика, химия и техника. история и археология. разное]](http://lesniepolyani.ru/wp-content/uploads/e/a/a/eaa5a4894214f917304344c7858c46ac.jpeg)



![Почему тантал и ниобий названы в честь героев древнегреческой мифологии?. новейшая книга фактов. том 3 [физика, химия и техника. история и археология. разное]](http://lesniepolyani.ru/wp-content/uploads/9/b/1/9b172fc74e11dfa048f218ee7cd170eb.jpeg)








![Почему тантал и ниобий названы в честь героев древнегреческой мифологии?. новейшая книга фактов. том 3 [физика, химия и техника. история и археология. разное]](http://lesniepolyani.ru/wp-content/uploads/7/2/5/725ed9722c9848be2fa2bd2846487e92.jpeg)



