МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследования послужили растения пшеницы (сорт Башкирская 26) и ячменя (сорт
Steptoe и его АБК-дефицитный мутант AZ34). Донорные растения выращивали в полевых
условиях научного стационара Уфимского Института биологии УФИЦ РАН (Уфимский район).
Получение эмбриогенных и неэмбриогенных
каллусов пшеницы и ячменя
Базовая индукционная среда для получения каллусов содержала макро-, микросоли и витамины
по прописи Мурасиге–Скуга (Murashige, Skoog, 1962), а также 100 мг/л миоинозита, 30
г/л сахарозы, 100 мг/л гидролизата альбумина, 2 мг/л глицина, 10 г/л агара. Перед
автоклавированием pH среды доводили до 5.7.
В качестве эксплантов использовали незрелые зародыши через 13–15 сут после массового
цветения.
Каллусы пшеницы получали согласно (Круглова, Сельдимирова, 2011). При этом для получения
эмбриогенных каллусов зародыши инокулировали на базовую индукционную среду, дополненную
2.0 мг/л 2,4-Д и 0.2 мг/л кинетина. Неэмбриогенные каллусы получали из зародышей,
инокулированных на базовую индукционную среду, дополненную 5.0 мг/л 2,4-Д и 0.2 мг/л
кинетина. Все каллусы инкубировали в течение 4 недель в темноте, при 26°C.
Также для получения неэмбриогенных каллусов пшеницы часть эмбриогенных каллусов, полученных
на индукционной среде с 2.0 мг/л 2,4-Д, длительно (в течение полугода) культивировали
на среде того же состава, пересаживая каллусы на свежую среду каждые 4 недели, до
полной потери ими эмбриогенной способности (см ниже).
Каллусы ячменя получали согласно (Сельдимирова и др., 2017). На базовой индукционной
среде, дополненной 2.0 мг/л 2,4-Д, 0.5 мг/л 6-БАП и 12.5 мг/л CuSO4 ⋅ 12H2O, у ячменя сорта Steptoe формировались эмбриогенные каллусы, тогда как у его АБК-дефицитного
мутанта AZ34 – неэмбриогенные каллусы. Эмбриогенные каллусы у AZ34 получали на базовой
индукционной среде, дополненной 2.0 мг/л 2,4-Д, 0.5 мг/л 6-БАП, 12.5 мг/л CuSO4 · 12H2O и 0.5 мг/л АБК. Все каллусы инкубировали в течение 4 недель в темноте, при 26°C.
Прижизненную съемку каллусов вели с применением стереомикроскопа Technival 2 (Carl
Zeiss, Jena, Germany) и цифровой камеры Olympus Camedia C-4000 (Olympus Optical Co.,
LTD, Japan).
Определение эмбриогенной способности
каллусов пшеницы и ячменя
Для определения эмбриогенной способности каллусы переносили на регенерационную среду
(среда, соответствующая по составу базовой индукционной среде) и культивировали при
16/8-часовом фотопериоде в течение 2 недель. Далее проводили гистологическую оценку
проявления/непроявления компетентности каллусов к эмбриогенезу по наличию/отсутствию
в их составе соматических зародышей на той или иной стадии развития.
Постоянные гистологические препараты готовили согласно (Световой микроскоп …, 2013)
с применением микротома HM 325 (Microm, Германия) и окрашиванием срезов методом тройного
окрашивания или же только реактивом Шиффа. Препараты анализировали с использованием
светового микроскопа Axio Imager.A1 light microscope (Carl Zeiss, Jena, Germany),
оснащенного объективом EC Plan-NEOFLURAL 10×/0.3, и фотографировали с использованием
цифровой камеры AxioCam MRc5 с программным обеспечением Axio Vision 4.7 (Carl Zeiss,
Jena, Germany).
Химический состав зародыша зерна
Зародыш зерна пшеницы состоит из следующих химических элементов:
- витамин Е 150 мг/кг;
- В1 19 мг/кг;
- В2, В6 по 12 мг/кг;
- РР 65 мг/кг;
- положительные зольные, микро-, макроэлементы;
- активные ферменты.
Массовая часть зародыша составляет 2-3%. Пшеничные белки содержат в своем составе незаменимые кислоты. В масле пшеницы главными элементами выступают олеиновые и линолевые кислоты. Помимо этого, в зернах пшеницы имеются каротиноиды, альфа-токоферол, стерины.

Питательные вещества постоянно кочуют от растения к семязачатку в период вегетации.
За счет этого процесса значительное количество питательных соединений скапливается в эндосперме. Зародыш полностью отделяется от семяножки, а питательные вещества переходят в созревшие плоды. Семечко высыхает, теряя влагу. Кожура становится твердой, окружая защитным слоем уже новый зародыш.
РЕЗУЛЬТАТЫ
Сравнительный анализ содержания
фитогормонов в эмбриогенных и неэмбриогенных каллусах пшеницы
Культивирование in vitro незрелых зародышей пшеницы на среде, дополненной 2.0 мг/л 2,4-Д, через 4 недели приводило
к формированию плотных бугорчатых каллусов, состоящих главным образом из меристематических
клеток. После культивирования таких каллусов на регенерационной среде в течение 2
недели в них, по данным морфологического (а) гистологического (б) анализа, отмечено формирование соматических зародышей с такими органами на ранних
стадиях развития, как лист, корень, побег, семядоля (щиток). Такие каллусы, способные
к индукции непрямого соматического эмбриогенеза, оценены как эмбриогенные (далее –
ЭК).
Рис. 1.
Эмбриогенные и неэмбриогенные каллусы пшеницы (2 недели культивирования in vitro на регенерационной среде). (а) – эмбриогенный каллус, полученный на среде, дополненной
2.0 мг/л 2,4-Д; (б) – гистологический срез соматического зародыша в каллусе, изображенном
на (а); (в) – неэмбриогенный каллус, полученный на среде с содержанием 2,4-Д, в 5.0
мг/л; (д) – неэмбриогенный каллус, полученный при длительном культивировании эмбриогенного
каллуса на среде, дополненной 2.0 мг/л 2,4-Д; (г, е) – гистологические срезы каллусов,
изображенных на (в, г), соответственно. (а, в, д) – прижизненная съемка, (б, г, е)
– СМ, постоянные препараты. АП – апекс побега, ДК – дегенерировавшие клетки, ЖК –
жизнеспособные клетки, К – каллус, КМ – корневая меристема, Л – лист, СЗ – соматический
зародыш, Щ – щиток. Шкала: (а, в–г) – 1 мм, (б, е) – 500 мкм.
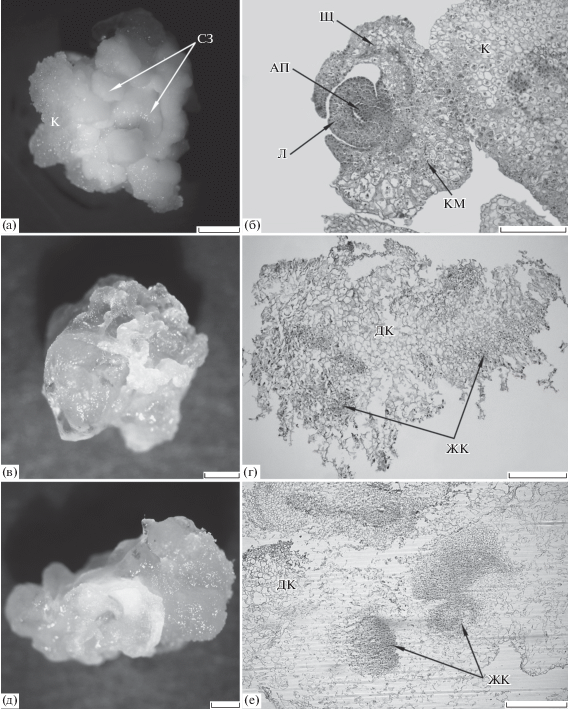
В результате культивирования in vitro незрелых зародышей пшеницы на среде, дополненной 5.0 мг/л 2,4-Д, формировались рыхлые
водянистые каллусы. Такие каллусы через 2 недели культивирования на регенерационной
среде (в), согласно гистологическим данным (г), были представлены в основном крупными сильновакуолизированными клетками, главным
образом дегенерировавшими, и небольшим количеством мелких жизнеспособных, но не обладающих
признаками меристематичности клеток. Соматические зародыши в таких каллусах отмечены
не были, поэтому каллусы оценивались как неэмбриогенные (далее – НЭК-5).
При длительном культивировании in vitro эмбриогенных каллусов на среде, дополненной 2.0 мг/л 2,4-Д, их меристематические
клетки активно пролиферировали. Однако через 2 недели культивирования на регенерационной
среде в таких каллусах (д), по данным гистологического анализа (е), большинство клеток дегенерировало, а оставшиеся жизнеспособные клетки утрачивали
признаки меристематичности. Такие каллусы оценивались как неэмбриогенные (далее –
НЭК-дк).
В ходе выполнения экспериментов изучали содержание фитогормонов в каллусах пшеницы,
различающихся по компетентности к соматическому эмбриогенезу in vitro. Полученные данные отражены в .
Таблица 1.
Содержание фитогормонов в каллусах пшеницы
| Тип каллуса | Содержание фитогормонов,нг/г сырой массы | ||
|---|---|---|---|
| АБК | ИУК | сумма ЦК | |
| ЭК | 1.1 ± 0.1б | 13.1 ± 1.2а | 1.3 ± 1.2а |
| НЭК-5 | 0.7 ± 0.05а | 16.8 ± 1.5аб | 1.2 ± 0.1а |
| НЭК-дк | 1.0 ± 0.1аб | 21.4 ± 2.1б | 1.8 ± 0.2б |
Условные обозначения: НЭК-5 – неэмбриогенные каллусы, полученные на среде МС, дополненной
5.0 мг/л 2,4-Д, НЭК-дк – неэмбриогенные каллусы, полученные в результате длительного
культивирования in vitro, ЭК – эмбриогенные каллусы. Средние значения по отдельным гормонам, помеченные разными
буквами, различаются при р < 0.05.
Анализ полученных данных () показывает, что НЭК-5 характеризуются наиболее низким содержанием АБК, тогда как
между ЭК и НЭК-дк существенных различий не обнаружено. Содержание ИУК, минимальное
у ЭК, сравнительно выше у неэмбриогенных каллусов обоих типов. Максимальное содержание
цитокининов выявлено в НЭК-дк, в то время как у ЭК и НЭК-дк этот показатель практически
не различается.
Строение семени
Строение семени пшеницы основывается на эндосперме. Он представляет из себя ядро мучнистой структуры. В центральной его части расположены крупные, тонкостенные, обычно неправильной формы клетки. По мере удаления от центра клетки приобретают прямоугольную форму. Внутри клеточных структур расположены белки, образующие сплошную матричную систему с крахмальными гранулами.
Оболочка
Оболочки играют защитную функцию. Голозерные сорта имеют 2 оболочки. Снаружи перикарпий, образующийся из тканей завязи. Перикарпий состоит из трех слоев, формируемых толстостенными клеточными одревесневшими структурами, полыми внутри. Локализация клеток напоминает по структуре кирпичную кладку. Такое положение делает оболочку более плотной, способной выдерживать механические повреждения.
Семенную оболочку формируют стенки почки. Состоит она из нескольких слоев мелких клеточных структур, неправильной формы. Центральный слой содержит красящее вещество, придающее цвет семени.
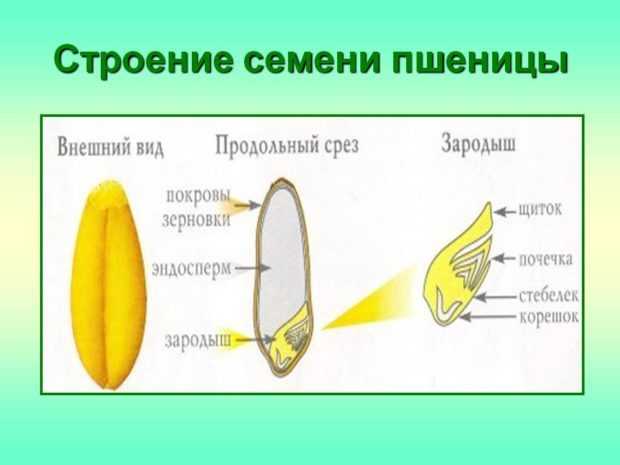
По внешнему виду строение семя пшеницы напоминает цилиндр, заостренный сверху и снизу. Цвет его желтовато-золотистый. Структура плотная.
Строение зародыша семени
Строение зародыша зерна пшеницы:
- корешки – центральный и 1-2 пары вторичных;
- апикальная меристема;
- стебелек;
- почечка.
Рассмотреть его можно только при помощи лупы. Семядоля (щиток) представляет собой тонкую пластинку, прилегающую к эндосперму, состоящую из алейроновых клеток. Паренхимная часть щитка состоит из пористых оболочек. По центральной части семядоли проходит линия (тяж), соединяющийся с пучком корешковых сосудов у основания почки. Нижняя область щитка соединена с тканью колеоризы.
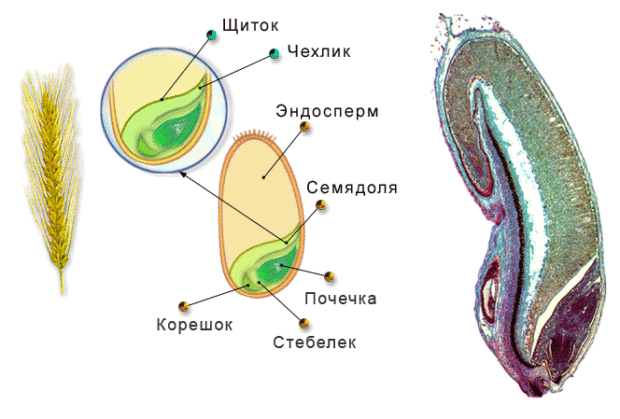
С внешней стороны, граничащей с эндоспермом, семядоля покрыта секреторными клетками (эпителием). В момент прорастания эти клеточные структуры выделяют ферменты, расщепляющие сложные питательные соединения на простые водорастворимые элементы.
Щиток образует выступ (лигула) в верхней части зародыша, который закрывает почку от повреждений. В нижней части расположен эпибласт орган, поглощающий влагу из почвы в период прорастания, и передает ее по сосудистой системе.
Апикальная меристема обеспечивает развитие из зародыша полноценного ростка. Она продуцирует все новые клеточные структуры.
Почечка точка роста, состоящая из 3 листовых эмбрионов. Развивается обычно только 2, а 3-й представлен дуговидным валиком. Наружную часть почечки покрывает колеоптиле, предохраняющий семя от повреждений в период вегетации.
В колеоптилярном узле расположены центральный корень и 1-2 пары дополнительных. Все они покрыты пленками из калиптрогена. Внешний слой центрального корня состоит из дерматогена, который превращается в эпиблему в момент прорастания. Последующий слой периблема преобразуется в первичную кору. Плерома – начальный слой центральной цилиндричной полости.
Тип плода пшеницы
Зерновка относится к паракарпным формированиям. Основной ее слой выстлан паракарпным гинецеем. К однодольному типу пшеницу относят, опираясь на характерные морфологические признаки:
- Мочковатое корневище – основные корни в процессе роста уходят глубоко в землю, второстепенные располагаются в поверхностном слое.
- Семена пшеницы состоят из одной доли.
- Стебель представляет собой вытянутый столбик, полый, разделенный изнутри перегородками.
- Отсутствует сердцевидная стадия.
- Семена пшеницы однодольного типа строения с тонким околоплодником, плотно прилегающим к кожуре зерна.
Питательные вещества в зерне
В зерновке запасы питательных веществ содержатся в эндосперме. Наружный его слой, примыкающий к оболочке, содержит зерна алейрона, богатые азотистыми соединениями. Под эндоспермом расположены крахмалсодержащие клетки.
Семена пшеницы содержат в своем составе:
- 75-85% крахмала;
- 2% сахарозы;
- 0,3% редуцирующего сахара;
- 15% белка (глианид, глютенин);
- 0,5% золы;
- 0,8% жира;
- 1,5% пентозана;
- 0,12% клетчатки.
Слои эндосперма отличаются по содержанию белка. От центральной части до периферии его количество в слоях растет от 7 до 16%. Семена пшеницы состоят из эндосперимия, который занимает около 80% общей массы культуры.





























