Производство фенола
Есть три важных технических процесса для синтеза фенола:
В прошлом фенол экстрагировали из дистиллята при перегонке каменноугольной смолы. Фенолят натрия получали добавлением к дистилляту раствора гидроксида натрия, который можно было разложить на фенол добавлением соляной кислоты.
В промышленных масштабах бензол превращается в изопропилбензол (кумол) реакцией с пропеном. Гидропероксид кумола получают в результате реакции с кислородом. Кислоты расщепляют эту перекись на фенол и ацетон. Экономичность процесса особенно высока, потому что производятся два важных химических материала. Сегодня это наиболее предпочтительный способ производства фенола. Бензол и пропен первоначально превращаются в кумол путем алкилирования. Затем кумол окисляется кислородом с образованием гидропероксида. Последующая кислотная обработка дает фенол и ацетон в реакции перегруппировки. Этот процесс крайне экономичен из-за попутно производимого ацетона.
Гидролиз хлорбензола гидроксидом натрия при 250 C и давлении в от 2 до 5 МПа дает в результате искомый фенол.
Принципы оказания первой помощи
Первое, что необходимо сделать, это прервать контакт человека с отравляющим источником.
Пострадавшего вынести из помещения на свежий воздух, расстегнуть пуговицы, замки, молнии, чтобы лучше обеспечить доступ кислорода.
Если раствор фенола попал на одежду, ее немедленно снять. Пораженную кожу и слизистую глаз многократно и тщательно промыть проточной водой.
При попадании фенола в ротовую полость ничего не проглатывать, а немедленно прополоскать рот в течение 10 минут. Если вещество успело попасть в желудок, можно выпить сорбент со стаканом воды:

- активированный или белый уголь;
- энтеросорб;
- энтеросгель;
- сорбекс;
- карболен;
- полисорб;
- лактофильтрум.
Антидот фенола – раствор глюконата кальция для внутривенного введения. При отравлении любой степени тяжесть пострадавший доставляется в больницу для наблюдения и лечения.
Вывести фенол из организма в условиях стационара при тяжелых отравлениях можно такими методами:
- Гемосорбция – очищение крови специальным сорбентом, который связывает молекулы ядовитого вещества. Кровь очищается путем прогонки в специальном аппарате.
- Дезинтоксикационная терапия – внутривенное вливание растворов, которые разбавляют концентрацию вещества в крови и способствуют его естественному выведению из организма (через почки).
- Гемодиализ – показан в тяжелых случаях, когда есть потенциальная угроза жизни. Процедура проводится с помощью аппарата «искусственная почка», в котором кровь проходит через специальные мембраны и оставляет молекулы отравляющего вещества. В организм кровь возвращается чистая и насыщенная полезными микроэлементами.
Фенол – это синтетическое отравляющее вещество, опасное для человека. Даже соединение природного происхождения может нанести вред здоровью. Чтобы избежать отравления, необходимо с ответственностью относится к работе на производстве, где есть риск контакта с ядом. При покупках интересоваться составом продукции. Неприятный запах пластмассовых изделий должен насторожить. При употреблении лекарственных препаратов с содержанием фенола соблюдать предписанную дозировку.
Применение фенолов
Фенолы широко применяются в производстве пластмасс, резин, лекарств, моющих средств, ядохимикатов, топлива и др. Основное применение фенолы находят в производстве различных феноло-альдегидных смол, полиамидов, полиарилатов, полиариленсульфонов, поликарбонатов, эпоксидных смол, антиоксидантов, бактерицидов и пестицидов (например, нитрафен). Алкилфенолы используют в производстве ПАВ, стабилизаторов и присадок к топливам. Двухатомные фенолы и их производные входят в состав дубителей для кожи и меха, модификаторов и стабилизаторов резин и каучуков, применяются для обработки кино- и фотоматериалов. В медицине фенолы и их производные используют в качестве антимикробных (фенол, резорцин), противовоспалительных (салол, осарсол), спазмолитических (адреналин, папаверин), жаропонижающих (аспирин, салициловая кислота), слабительных (фенолфталеин), адреномиметических (мезатон), вяжущих (таннины) и других лекарственных средств, а также витаминов E и P.
Физические свойства
Большинство одноатомных фенолов при нормальных условиях представляют собой бесцветные кристаллические вещества с невысокой температурой плавления и характерным запахом. Фенолы малорастворимы в воде, хорошо растворяются в органических растворителях, токсичны, при хранении на воздухе постепенно темнеют в результате окисления.
Фенол C6H5OH (карболовая кислота) — бесцветное кристаллическое вещество на воздухе окисляется и становится розовым, при обычной температуре ограниченно растворим в воде, выше 66 °C смешивается с водой в любых соотношениях. Фенол — токсичное вещество, вызывает ожоги кожи, является антисептиком.
Методы определения фенолов
Для анализа воды на содержание в ней фенолов в лабораторной практике используются следующие методы:
- фотометрический;
- газо-жидкостная хроматография;
- броматометрическое титрование;
- флуориметрический метод.
Метод выбирают в зависимости от задач исследования химического состава контролируемого объекта.
Фотометрический
При определении фенола фотометрическим методом (ПНД Ф 14.1:2.105-97) летучие фенолы отгоняются с водяным паром из предварительно подкисленной пробы воды. Далее к отгону прибавляют 4-аминоантипирин и гексацианоферрат (III) калия и проводят экстракцию окрашенного соединения хлороформом. На спектрофотометре или фотоэлектроколориметре при длине волны λ = 460 нм и λ = 460-490 нм соответственно измеряют оптическую плотность экстракта.
Газо-жидкостная хроматография
Метод газо-жидкостной хроматографии основан на взаимодействии гидроксибензола (фенола) с бромирующим реактивом в присутствии слабого раствора серной кислоты. Избыток брома удаляют раствором сернистого натрия. Образовавшийся трибромфенол экстрагируют гексаном, гексановый экстракт хроматографируют на газовом хроматографе с электронозахватным детектором.
Броматометрическое титрование
Определение фенола броматометрическим методом основано на титровании анализируемой пробы воды избытком бромат-бромидной смеси, приготовленной из навесок KBrO3 и KBr.
BrO3 + 5Br+ 6Н = 3Br2 + 3H2O
Образующийся бром вступает в реакцию с фенолом:
С6Н5ОН + 3Br2 = C6H2Br3OH + 3HBr
При добавлении иодида калия, избыточный, не прореагировавший бром окисляет иодид до йода, который оттитровывают стандартным раствором Na2S2O3:
Br2 + 2I = 2Br + I2
I2 + 2S2O = 2I + S4O
Флуориметрический
В ходе флуориметрического анализа фенол экстрагируется из воды растворителем бутилацетатом. Далее проводится реэкстракция фенолов в водный раствор NaOH, а затем определение их концентрации на анализаторе жидкости «Флюорат».
Летучие фенолы методом флуориметрии определяются после предварительной отгонки фенолов при помощи перегонного устройства.
Получение
В настоящее время производство фенола в промышленном масштабе осуществляется тремя способами:
- кумольным методом получают более 95 % всего производимого в мире фенола. Способ был изобретён советскими учёными П. Г. Сергеевым, Н. М. Горнасталевой, Р. Ю. Удрисом, Б. Д. Кружаловым. В каскаде барботажных колонн кумол подвергают некаталитическому окислению воздухом с образованием гидропероксида кумола (ГПК). Полученный ГПК, при катализе серной кислотой, разлагают с образованием фенола и ацетона. Кроме того, ценным побочным продуктом этого процесса является α-метилстирол;
- около 3 % всего фенола получают окислением толуола, с промежуточным образованием бензойной кислоты;
- остальной фенол выделяют из каменноугольной смолы.
Фенол также можно получить восстановлением хинона.
Индивидуальные доказательства
- Вход на в базе вещества GESTIS из в МРС , доступ к 8 мая 2017 года. (Требуется JavaScript)
-
↑
Входа на в базе вещества GESTIS из на выставке IFA , доступ к 2 сентября 2012 года . (Требуется JavaScript) -
↑
въезда на в базе данных вещества GESTIS из в IFA , доступ к 2 сентября 2012 года. (Требуется JavaScript) -
↑
запись на в базе данных вещества GESTIS из в IFA , доступ к 2 сентября 2012 года. (Требуется JavaScript) - ↑ Справочник CRC по таблицам для идентификации органических соединений , третье издание, 1984 г., ISBN 0-8493-0303-6 .
- Скользящий план действий Сообщества ( CoRAP ) Европейского химического агентства (ECHA): , по состоянию на 20 мая 2019 г.
Бактерицидное действие — фенол
Бактерицидное действие фенола повышается и при замещении водорода галогенами, напр, дихлорфеполы имеют фенольный коэфф. Различные изомеры галогенофенолов обладают различной бактерицидной активностью. Из трихлор-фенолов наиболее активен 2 4 5-трихлорфенол. Высокой бактерицидной активностью обладает также пента-хлорфенол, но действие его несколько слабее, чем 2 4 5-трихлорфепола. Высокой бактерицидной активностью обладают также нафтолы и их галогенопроиз-водные.
Бактерицидное действие фенола повышается и при замещении водорода галогенами, напр, дихлорфенолы имеют фенольный коэфф. Различные изомеры галогенофенолов обладают различной бактерицидной активностью. Из трихлор-феиолов наиболее активен 2 4 5-трихлорфенол. Высокой бактерицидной активностью обладает также пента-хлорфенол, но действие его несколько слабее, чем 2 4 5-трихлорфенола. Высокой бактерицидной активностью обладают также нафтолы и их галогенопроиз-водные.
Усиление бактерицидного действия фенолов в результате замещения галогеном пропорционально молекулярному весу галогена, следовательно, самым эффективным заместителем является иод. Замещение на галоген в пара-положении более эффективно, чем в opmo — положении. Одним из самых удачных галогенированных фенолов является хлорксиленол ( XVII), который оказывает меньшее раздражающее действие, чем крезол.
Солюбилизация находит широкое применение эмульсионном получении полимеров, в изготовлении э сионных смазочных и охлаждающих жидкостей, для ления бактерицидного действия фенолов, крезолов, в мацевти ческой, полиграфической, пищевой промышленности.
Солюбилизация находит широкое применение в эмульсионном получении полимеров, в изготовлении эмульсионных смазочных и охлаждающих жидкостей, для усиления бактерицидного действия фенолов, крезолов, в фармацевтической, полиграфической, пищевой промышленности.
Целый ряд фенолов применяется в хирургии в качестве антисептиков. Бактерицидное действие фенолов усиливается при алкилиро-вании, хлорировании или иодировании. Замещение галогеном в пара-положении более эффективно, чем в орто — положении. Органические соединения ртути также обладают высоким бактерицидным действием, и многие из них являются фенольными соединениями. К бакте — риостатически активным веществам с фенольными группами относятся и производные галогенированных хинолинов, эффективные против стафилококков и стрептококков. К фенольным соединениям, содержащим мышьяк, относятся некоторые препараты, применяемые для лечения венерических заболеваний. Для лечения грибкового заболевания кожи — трихофитии — был предложен фенольный антибиотик гризеофульвин.
Ряд фенолов и галогенированных фенолов используется в хирургии со времени применения Листером ( 1867 г.) фенола в качестве антисептика. Бактерицидное действие фенола усиливается при введении в фенольное ядро алкиль-ных групп и атомов хлора. Эффект алкильного заместителя максимален в случае — гексила. Гексилрезорцин ( XVI) применяется как антипруритическое средство, а также при различных глистных инвазиях, особенно нематодных. Как антисептик и дезинфицирующее средство гексилрезорцин обладает ценными свойствами; он не имеет запаха, не вызывает раздражений и не оставляет пятен. Крезиловый эфир уксусной кислоты используется как антисептик и местное замораживающее средство в стоматологии; гвоздичное масло, содержащее эвгенол ( 4-аллил — 2-метоксифенол), также используется в этих целях.
Например, включение гидроксильной группы в бензольное кольцо понижает бактерицидное действие фенола.
Несмотря на то, что впоследствии фенол был заменен менее токсичными соединениями, в качестве стандартного бактерицидного средства он сыграл выдающуюся роль при испытании дезинфекционных веществ. Как стандартное средство фенол и до настоящего времени продолжает широко применяться. Механизм бактерицидного действия фенола изучался многими исследователями, и накопленный опыт был впоследствии использован для изучения других соединений.
Несмотря на то, что впоследствии фенол был заменен менее токсичными соединениями, в качестве стандартного бактерицидного средства он сыграл выдающуюся роль при испытании дезинфекционных веществ. Как стандартное средство фенол и до настоящего времени продолжает широко применяться. Механизм бактерицидного действия фенола изучался многими исследователями, и накопленный опыт был впоследствии использован для изучения других соединений.
Характеристики
| Крезол | |||
| Фамилия | 2-метилфенол | 3-метилфенол | 4-метилфенол |
| Другие названия | о- крезол, орто- крезол, 2-гидрокситолуол | м — крезол мета- крезол 3-гидрокситолуол | р — крезол пункт крезол 4-гидрокситолуол |
| Представление | |||
| Количество CAS | |||
| (смесь) | |||
| Номер CE | 202-423-8 | 203-577-9 | 203-398-6 |
| 215-293-2 (смесь) | |||
| PubChem | |||
| Грубая формула | С 7 Н 8 О | ||
| Молярная масса | 108,14 г моль -1 | ||
| Государство ( CNTP ) | твердый | жидкость | твердый |
| Появление | от бесцветного до желтоватого кристаллического вещества с резким запахом, напоминающим смолу | от бесцветной до желтоватой маслянистой жидкости с запахом фенола | от бесцветного до желтоватого кристаллического вещества с резким запахом, напоминающим смолу |
| Точка слияния | 31 ° С | 11 ° С | 35 ° С |
| Точка кипения | 191 ° С | 203 ° С | 202 ° С |
| Плотность ( 20 ° C ) | 1,05 г · см -3 | 1,03 г · см -3 | 1,03 г · см -3 |
| Давление насыщающего пара | 62 Па ( 30 ° C ) 1,33 гПа ( 40 ° C ) 2,66 гПа ( 50 ° C ) | 0,119 гПа ( 20 ° C ) 0,279 гПа ( 30 ° C ) 0,615 гПа ( 40 ° C ) 1,28 гПа ( 50 ° C ) | 15 Па ( 25 ° C ) 55,9 Па ( 40 ° C ) 1,26 гПа ( 50 ° C ) |
| точка возгорания | 81 ° C (закрытая чашка) | 86 ° C (закрытая чашка) | 86 ° C (закрытая чашка) |
| Точка самовоспламенения | 555 ° С | 626 ° С | 555 ° С |
| Пределы взрываемости | нижняя: 1,3 об.% / 58 г / м³, 74 ° C | нижняя: 1 об.% / 45 г / м³, 84 ° C | нижняя: 1 об.% / 45 г / м³, 85 ° C |
| Растворимость в воде ( 20 ° C ) | 25 г л -1 | 23,5 г л -1 | 20 г л -1 |
| pK A | 10,28 | 10.09 | 10,26 |
| Коэффициент разделения октанол / вода ( LogP ) | 1,98 | 1,98 | 1,97 |
| Электропроводность ( 25 ° C ) | 1,27 × 10 −7 См м −1 | 1.397 × 10 −6 См м −1 | 1,378 × 10 −9 См м −1 |
| Динамическая вязкость | 7,9 МПа · с | ||
| SGH | |||
| H- и P-фразы |
H301, H311, H314, H412, |
H301, H311, H314, |
H301, H311, H314, H412, |
|
P280, P302 + P352, P301 + P330 + P331, P305 + P351 + P338, P308 + P310, |
P280, P310, P305 + P351 + P338, P361 , P301 + P330 + P331 , P303 + P361 + P353, |
Крезолы очень чувствительны к воздействию света и воздуха. При температуре выше 80 ° C они образуют с воздухом взрывоопасные смеси. Они плохо растворяются в воде и при горении образуют много сажи.
pK A
Метильная группа имеет (слабый) индуктивный донорный эффект (+ I), который снижает полярность связи ОН фенольной группы и снижает ее кислотный характер ; это объясняет, почему pK A крезолов немного выше 10 по сравнению с 9,99 для фенола, причем этот эффект, как обычно, сильнее для орто- и пара- соединений .
Реактивность
Помимо слабого индуктивного донорного (+ I) эффекта метильной группы, гидроксильная группа производит мезомерный донорный эффект (+ M), который имеет гораздо большее влияние на реакционную способность крезолов (а также индуктивный эффект притяжения (-I). ) у кого почти нет). Эти два эффекта (+ I и + M) увеличивают электронную плотность в цикле и делают крезолы легко реакционноспособными соединениями за счет ароматического электрофильного замещения .
Крезолы могут давать простые и сложные эфиры (свойства, общие для других фенолов), а также галогенированные заменители .
Применение
В настоящее время фенол преимущественно используется для изготовления фенольных смол, которые находят самое широкое применение в строительной отрасли. Они используются в качестве связующих веществ и наполнителей в деревянных изделиях, таких как фанера, ДСП, мебель и панели. Феноловые смолы пропитываются бумагой, которая после затвердевания дает листы, которые можно склеивать, чтобы сформировать ламинат для использования в стеновых панелях и столешницах.
Как мощный бактерицид, фенол можно найти во многих потребительских товарах, включая жидкости для полоскания рта, антисептические мази, леденцы для горла, освежители воздуха, ушные капли и бальзамы для губ.
Фенол продолжает оставаться основным химическим веществом, используемым для производства термореактивных смол. Эти смолы производятся путем объединения фенола с альдегидами, такими как формальдегид.
Помимо строительной промышленности, фенол находит множество других применений. Он используется в фармацевтике, в гербицидах, пестицидах и красках. Его можно использовать для производства капролактама, который является мономером, используемым при производстве нейлона. Другим важным промышленным соединением, получаемым из фенола, является бисфенол А, который производится из фенола и ацетона. Бисфенол А используется при производстве поликарбонатных смол, для дпльнейшего использования в различных продуктах, таких как автомобильные детали, электротехнические изделия и потребительские товары: компакт-диски, очки для чтения, солнцезащитные очки и бутылки с водой.
Фенол используется для производства множества органических соединений, таких как пирокатехин, резорцин, анилин, салициловая кислота, пикриновая кислота, адипиновая кислота, пластмасс, фенольных смол, фенолфталеина (индикатор), пикриновой кислоты, фармацевтических препаратов, инсектицидов, консервантов для древесины, взрывчатых веществ, дубильных веществ и многого другого.
Широко используется в качестве дезинфицирующего средства в нефтяной, кожевенной, бумажной, мыльной, игрушечной, кожевенной, красильной и сельскохозяйственной промышленности.
В микроскопии он используется для производства фенольной воды, состоящей из десяти частей фенола и одной части воды.
Применение
По данным на 2006 год мировое потребление фенола имеет следующую структуру:
- 44 % фенола расходуется на производство бисфенола А, который, в свою очередь, используется для производства поликарбонатов и эпоксидных смол;
- 30 % фенола расходуется на производство фенолформальдегидных смол;
- 12 % фенола гидрированием превращается в циклогексанол, используемый для получения искусственных волокон — нейлона и капрона;
- в России большое количество фенола используется в нефтепереработке, в частности для селективной очистки масел на технологических установках типа 37/1 и А-37/1. Фенол проявляет высокую селективность и эффективность при удалении из масел смолистых веществ, различных полициклических ароматических углеводородов с короткими боковыми цепями, а также соединений, содержащих серу;
- остальной фенол расходуется на другие нужды, в том числе на производство антиоксидантов (ионол), неионогенных ПАВ — полиоксиэтилированных алкилфенолов (неонолы), других фенолов (крезолов), лекарственных препаратов (аспирин), антисептиков (ксероформа) и пестицидов. Раствор 1,4 % фенола применяется в медицине (орасепт) как обезболивающее и антисептическое средство.
Фенол и его производные обусловливают консервирующие свойства коптильного дыма.
Также фенол используют в качестве консерванта в вакцинах. Пример использования, в качестве антисептика — препарат «Орасепт» и «Фукорцин». В косметологии как химический пилинг (токсично).
- в скотоводстве: дезинфекция животных растворами фенола и его производных.
- в косметологии для проведения глубокого пилинга.
Токсические свойства [ править | править код ]
Фенол ядовит. Относится к высокоопасным веществам (Класс опасности II). При вдыхании вызывает нарушение функций нервной системы. Пыль, пары и раствор фенола раздражают слизистые оболочки глаз, дыхательных путей, кожу, вызывая химические ожоги. Доказательства канцерогенности фенола для людей отсутствуют .
Попадая на кожу, фенол очень быстро всасывается даже через неповреждённые участки и уже через несколько минут начинает воздействовать на ткани головного мозга. Сначала возникает кратковременное возбуждение, а потом и паралич дыхательного центра. Даже при воздействии минимальных доз фенола наблюдается чихание, кашель, головная боль, головокружение, бледность, тошнота, упадок сил. Тяжелые случаи отравления характеризуются бессознательным состоянием, синюшностью, затруднением дыхания, нечувствительностью роговицы, скорым, едва ощутимым пульсом, холодным потом, нередко судорогами. Смертельная доза для человека при попадании внутрь 1—10 г, для детей 0,05—0,5 г .
Охрана труда
При ПДК в воздухе рабочей зоны 1 мг/м³ (максимально-разовая) и 0,3 мг/м³ (среднесменная). Порог восприятия запаха фенола у разных людей разный; и он может достигать (среднее значение в группе) 5,8-7,5 мг/м³ . А у отдельных работников он может быть значительно больше среднего значения. По этой причине можно ожидать, что использование широко распространённых фильтрующих СИЗОД в сочетании с «заменой фильтров по появлении запаха под маской» (как это почти всегда рекомендуется в РФ поставщиками) приведёт к чрезмерному воздействию паров фенола на, по крайней мере, часть работников, и причинить вред их здоровью — из-за запоздалой замены противогазных фильтров. Для защиты от фенола следует использовать более эффективные изменение технологии и средства коллективной защиты.
Фенольная катастрофа в Уфе
Наглядным примером воздействия фенола на окружающую среду стал случай весной 1990 года в Уфе. В результате техногенной аварии на предприятии ПО «Уфахимпром» произошла утечка большого количества фенола в речку Шугуровка, впадающую в более крупную реку Уфу, являющуюся источником хозяйственно-питьевого водоснабжения города Уфы. Загрязнение воды в районе Южного водозабора превышало ПДК более чем в 100 раз. Опасность загрязнения питьевой воды фенолом проявляется в том, что при очистке вод использовался хлор, который, взаимодействуя с фенолом, образовывал хлорпроизводные (смесь хлорфенолов) — более токсичные вещества (некоторые в 100—250 раз превышают токсичность самого фенола). Население Уфы было оповещено об опасности употребления водопроводной воды для питья. Общая численность населения, потреблявшего питьевую воду, загрязненную фенолом из Южного водозабора Уфы, составила 672 876 человек .
“>
Оценка рисков
В 2012 году п- Крезол был включен в текущий план действий ЕС ( CoRAP ) в соответствии с Регламентом (ЕС) № 1907/2006 (REACH) как часть оценки вещества . Воздействие на здоровье человека и окружающую среду повторно оценивается и, при необходимости, принимаются последующие меры. Причинами потребления п- крезола были опасения по поводу его использования потребителями , высокий (совокупный) тоннаж и широкое использование, а также опасности, возникающие из-за возможного отнесения к группе веществ CMR и в качестве потенциального эндокринного разрушителя . Повторная оценка проводилась с 2015 года в Соединенном Королевстве . Затем был опубликован окончательный отчет.
Вред фенолов для человека
Это вещество и все его производные легко проникают в организм через кожу и легкие. В крови фенол образует соединения с другими веществами и становится еще более токсичным. Чем выше его концентрация в организме, тем больший вред он может нанести. Фенол нарушает деятельность нервной и сердечно-сосудистой системы, поражает печень и почки. Он разрушает эритроциты, вызывает аллергические реакции и появление язв.
Чаще всего отравление фенолом происходит через питьевую воду, а также через воздух в помещениях, в которых использовались его производные при строительстве, производстве краски или мебели.
При вдыхании его соединений происходит ожог дыхательных путей, раздражение носоглотки и даже отек легких. Если фенол попал на кожу, получается сильный химический ожог, после которого развиваются плохо заживающие язвы. А если поражено более четверти кожных покровов человека, это приводит к его смерти. При случайном заглатывании небольших доз фенола, например, с зараженной водой, развивается язва желудка, нарушение координации движений, бесплодие, сердечная недостаточность, кровотечения и раковые опухоли. Большие дозы сразу приводят к смерти.

Роль фенолов в природе
Эти вещества находятся во многих растениях. Они участвуют в создании их окраски и аромата. Капсаицин придает остроту горькому перцу. Антоцианы и флавоноиды окрашивают кору деревьев, а кетол или эвгенол обеспечивают наличие аромата у цветов. В некоторых растениях содержатся полифенолы, вещества, образованные соединением нескольких молекул фенола. Они полезны для здоровья человека. К полифенолам относятся лигнины, флавоноиды и другие. Эти вещества есть в оливковом масле, фруктах, орехах, чае, шоколаде и других продуктах. Считается, что некоторые из них обладают омолаживающим эффектом и защищают организм от рака. Но есть и ядовитые соединения: танины, урушиол, карболовая кислота.
Свойства фенола
Свежеперегнанный фенол представляет собой бесцветные игольчатые кристаллы с температурой плавления 41 °С и температурой кипения 182 °С. При хранении, особенно во влажной атмосфере и в присутствии небольших количеств солей железа и меди, он быстро приобретает красную окраску. Фенол смешивается в любых соотношениях со спиртом, водой (при нагревании свыше 60 °С), хорошо растворим в эфире, хлороформе, глицерине, сероуглероде.
Из-за наличия -OH гидроксильной группы, фенол имеет химические свойства характерные для спиртов, так и ароматических углеводородов.
По гидроксильной группе фенол вступает в следующие реакции:
Так как фенол обладает немного более сильными кислотными свойствами, чем у спирты, то под воздействием щелочей он образует соли — феноляты (к примеру, фенолят натрия — C6H5ONa):
C6H5OH + NaOH -> C6H5ONa + H2O
В результате взаимодействия фенола с металлическим натрием также получается фенолят натрия:
2C6H5OH + 2Na -> 2C6H5ONa + H2
Фенол непосредственно не этерифицируется карбоновыми кислотами, получение эфиров осуществляют путем взаимодействия фенолятов с ангидридами или галогенангидридами кислот:
C6H5OH + CH3COOH -> C6H5OCOCH3 + NaCl
При перегонке фенола с цинковой пылью идет реакция замещения гидроксильной группы водородом:
C6H5OH + Zn -> C6H6 + ZnO
Реакции фенола по ароматическому кольцу:
Фенол вступает в реакции электрофильного замещения по ароматическому кольцу. Группа ОН, являясь одной из самых сильных донорных групп (вследствие уменьшении электронной плотности на функциональной группе), увеличивает реакционную способность кольца к этим реакциям и направляет замещение в орто- и пара-положения. Фенол легко алкилируется, ацилируется, галогенируется, нитруется и сульфируется.
Реакция Кольбе — Шмитта служит для синтеза салициловой кислоты и её производных (ацетилсалициловой кислоты и других).
C6H5OH + CO2 –NaOH-> C6H4OH(COONa)
C6H4OH(COONa) –H2SO4-> C6H4OH(COOH)
Качественные реакции на фенол:
В результате взаимодействия с бромной водой:
C6H5OH + 3Br2 -> C6H2Br3OH +3HBr
- образуется 2,4,6-трибромфенол — твёрдое вещество белого цвета.
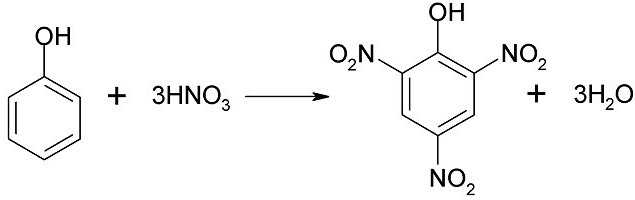
С концентрированной азотной кислотой:
C6H5OH + 3HNO3 -> C6H2(NO2)3OH + 3H2O
С хлоридом железа(III) (качественная реакция на фенол):
C6H5OH + FeCl3 -> ⌈Fe(C6H5OH)6⌉Cl3
Реакция присоединения
Гидрированием фенола в присутствии металлических катализаторов Pt/Pd, Pd/Ni, получают циклогексиловый спирт:
C6H5OH -> C6H11OH
Окисление фенола
Вследствие наличия гидроксильной группы в молекуле фенола, устойчивость к окислению много ниже нежели, чем у бензола. В зависимости от природы окислителя и условия проведения реакции получаются различные продукты.
Так под действием перекиси водорода в присутствии железного катализатора образуется небольшое количество двухатомного фенола — пирокатехина:
C6H5OH + 2H2O2 – Fe> C6H4(OH)2
При взаимодействии более сильных окислителей (хромовая смесь, диоксид марганца в кислой среде) образуется пара-хинон.
токсикология
Отравление крезолом вызывает довольно неспецифические симптомы. Признаками хронического отравления являются головные боли, кашель и тошнота, потеря аппетита, а также утомляемость и бессонница. Всасывание через кожу происходит очень быстро. Это может привести к острому отравлению с поражением почек и расстройствам центральной нервной системы, таким как судороги, потеря сознания и паралич дыхания . Крезолы считаются канцерогенными .
Как и в случае с фенолами в целом, при пероральном приеме возникают (беловатые) химические ожоги, которые безболезненны, поскольку фенолы обладают обезболивающим действием. Симптомы отравления возникают у людей примерно от 3 г, примерно от 10 г есть вероятность смертельного шока.
Кроме того, фенолы и особенно крезолы обладают сильным разрушающим действием на белок. Поскольку они очень едкие, они вызывают острое повреждение кожи при контакте с кожей, разрушают белок в клетках кожи и почти сразу же преодолевают защитный механизм кожи, который является слабокислым. Если открытые слизистые оболочки (полость рта, нос, задний проход) загрязнены , они попадают прямо в кровь, где быстро распределяются по организму и приводят к множественному повреждению белков внутренних органов. Без немедленных мер противодействия крезолы могут иметь опасные для жизни последствия даже в небольших количествах.
Химические свойства
Уникальные свойства фенола объясняются его внутренней структурой. В молекуле этого химического вещества р-орбиталь кислорода образует единую п-систему с бензольным кольцом. Такое плотное взаимодействие повышает электронную плотность ароматического кольца и понижает этот показатель у атома кислорода. При этом полярность связей гидроксогруппы значительно увеличивается, и водород, входящий в ее состав, легко замещается любым щелочным металлом. Так образуются различные феноляты. Эти соединения не разлагаются водой, как алкоголяты, но их растворы очень похожи на соли сильных оснований и слабых кислот, поэтому они имеют достаточно выраженную щелочную реакцию. Феноляты взаимодействуют с различными кислотами, в результате реакции восстанавливаются фенолы. Химические свойства этого соединения позволяют ему взаимодействовать с кислотами, образуя при этом сложные эфиры. Например, взаимодействие фенола и уксусной кислоты приводит к образованию финилового эфира (фениацетата).
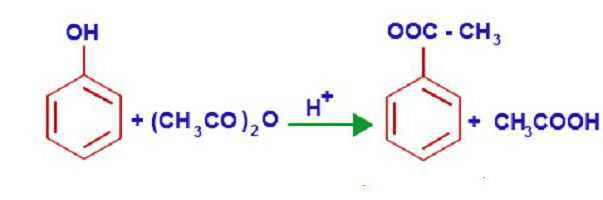
Широко известна реакция нитрирования, в которой под воздействием 20% азотной кислоты фенол образует смесь пара- и ортонитрофенолов. Если воздействовать на фенол концентрированной азотной кислотой, то получается 2,4,6-тринитрофенол, который иногда называют пикриновой кислотой.
Историческая справка
Фенол был открыт Фридлибом Фердинандом Рунге в 1834 году при перегонке каменноугольной смолы. Он назвал ее карболовой кислотой или угольной кислотой (карбон = уголь, олеум = масло) из-за ее кислотного действия в водном растворе.
Первое значительное применение фенола принадлежит английскому хирургу Джозефу Листеру (1827-1921). Листера вдохновила микробная теория болезней Луи Пастера (1822–1895) и он начал использовать антисептические методы во время своих операций в 1860-х годах. В своей борьбе с раневыми инфекциями, которые часто возникали после операций, он применил так называемую «карболовую повязку» в 1865 году. Это позволило ему в значительной степени предотвратить серьезные и опасные для жизни нагноения хирургических ран. Листер также разработал основы больничной гигиены. Частое мытье рук врачами и медперсоналом раствором фенола и использование резиновых перчаток дали прекрасные результаты и смертность пациентов резко упала. В истории медицины Листер считается «отцом антисептики».
В молекулярной биологии экстракция органических тканей смесями фенола, хлороформа и изоамилового спирта была одним из первых методов получения ДНК высокой чистоты.





























