Относительное содержание ГЦ-пар в ДНК
Относительное содержание ГЦ-пар в ДНК – это стабильный признак бактерий. Он не зависит от возраста, условий культивирования, отдельных перестроек генов в хромосоме. Данное свойство не изменяется под влиянием большинства мутаций. Эту величину рассматривают как один из важных признаков вида.
Молекулы ДНК разных микроорганизмов отличны друг от друга относительным содержанием пуриновых и пиримидовых оснований, формирующих комплементарные пары или ГЦ-пары в антипараллельных цепях ДНК.
Близкородственные микроорганизмы имеют идентичное или сходное содержание ГЦ-пар в ДНК. Далеко отстоящие в генетическом отношении микроорганизмы, сильно отличаются по относительному содержанию этих азотистых оснований.
Молекулярное содержание ГЦ-оснований у прокариот колеблется в широких пределах: от 25 до 80 мол %. Однако, у разных видов бактерий рода Pseudomonas, количество ГЦ-пар в ДНК характеризуется близкими величинами (61,8 – 69,5 мол % от общего количества оснований). То есть для каждого вида бактерий существует определенное среднее содержание ГЦ-пар.
Метод
- Рестрикция эндонуклеазами рестрикции для разрезания высокомолекулярной ДНК на более мелкие фрагменты.
- Фрагменты ДНК подвергаются электрофорезу в агарозном геле для разделения по длине.
- В случае, если некоторые фрагменты ДНК длиннее 15 кб, перед переносом гель обрабатывают, например, соляной кислотой , которая вызывает депуринизацию ДНК и облегчает перенос на мембрану.
- В случае, когда используют щелочной метод переноса, агарозный гель помещают в щелочной раствор, при этом двойная спираль ДНК денатурирует и облегчает связывание отрицательно заряженной ДНК с положительно заряженной мембраной для дальнейшей гибридизации. При этом разрушаются и остатки РНК .
- Листок нитроцеллюлозной (или нейлоновой) мембраны помещают сверху или снизу от агарозного геля. Давление осуществляют непосредственно на гель или через несколько слоев бумаги. Для успешного переноса необходим плотный контакт геля и мембраны. Буфер переносится капиллярными силами из участка с высоким содержанием воды в зону с низким содержанием воды (мембрана). При этом осуществляется перенос ДНК из геля на мембрану. Полианионная ДНК связывается с положительно заряженной мембраной силами ионообменных взаимодействий.
- Для окончательного закрепления ДНК на мембране, последняя нагревается в вакууме до температуры 80 °C в течение двух часов или освещается ультрафиолетовым излучением (в случае нейлоновых мембран).
- Осуществляют гибридизацию радиоактивно (флюоресцентно) меченной пробы с известной последовательностью ДНК с мембраной.
- После гибридизации избыток пробы отмывают с мембраны и визуализируют продукты гибридизации путём авторадиографии (в случае радиоактивной пробы) или оценивают окраску мембраны (в случае использования хромогенного окрашивания).
Основы молекулярной биологии. Часть 2: Молекулярные генетические механизмы — А.Н. Огурцов 2011
Скрининг библиотек ДНКГибридизация с ДНК-зондами
И геномные библиотеки, и библиотеки комплементарных ДНК (кДНК) содержат сотни тысяч и даже миллионы (в случае высших эукариот) клонов. Для обнаружения определённого гена или какого-либо другого участка ДНК используется два принципиально различных подхода.
Первый способ обнаружения (скрининг) основан на использовании олигонуклеотидных ДНК-зондов, которые связываются с исследуемыми клонами.
Второй способ скрининга основан на экспрессии белков, кодируемых данным клоном.
Рассмотрим первый метод.
В основе метода скрининга с использованием олигонуклеотидных зондов лежит гибридизация — способность комплементарных молекул ДНК или РНК специфично связываться (гибридизироваться) между собой посредством образования комплементарных пар нуклеотидов.
Двойная спираль ДНК денатурирует (плавится) при повышении температуры (рисунок 4) в слабом солевом растворе. Если затем понизить температуру и/или повысить концентрацию ионов в растворе, то комплементарные одиночные нити ДНК заново объединятся друг с другом (гибридизируются), вновь образуя двойную спираль (ренатурация двух цепей ДНК в двойную цепь).
В смеси нуклеиновых кислот только комплементарные одиночные цепи ДНК самопроизвольно ренатурируют, более того, такая ренатурация практически не зависит от присутствия в растворе других, некомплементарных, цепей.
На рисунке 92 представлена схема анализа методом мембранной гибридизации.
Сначала исследуемая ДНК денатурируется и одиночные цепи ДНК необратимо присоединяют к твердой подложке — обычно к нитроцеллюлозному фильтру или нейлоновой мембране.
Затем фильтр инкубируют в растворе, содержащем радиоактивномеченые одноцепочечные ДНК-зонды. При благоприятных для гибридизации условиях (нейтральном значении pH; Т=40-65°С; 0,3-0,6 М NaCl), происходит присоединение зондов к комплементарным нитям ДНК, связанным с мембраной. Оставшиеся несвязанными зонды смывают с фильтра, и радиоактивно меченые гибриды детектируются ауторадиографией. Ауторадиография (autoradiography, или радиоавтография) — метод визуализации распределения радиоактивных зон, образовавшихся после электрофоретического разделения смеси макромолекул взятых из клетки, со среза ткани или с пластинки геля после присоединения к ним радиоактивных зондов.
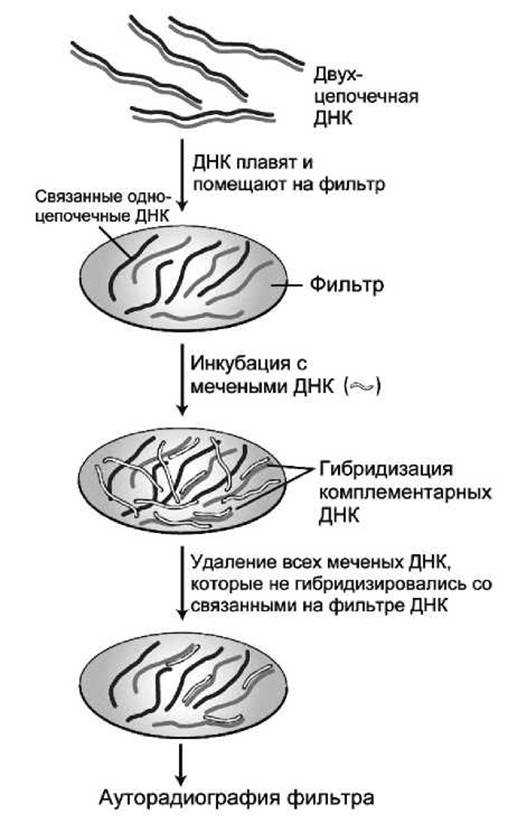
Рисунок 92 — Детектирование ДНК методом анализа мембранной гибридизации
Для регистрации радиоактивных зон на исследуемый образец накладывают рентгеновскую пленку, которая засвечивается именно в тех областях, где сконцентрированы радиоактивные зонды.
Анализ методом мембранной гибридизации может быть проведен как для ДНК, так и для РНК, и радиоактивно меченые комплементарные зонды должны быть или ДНК или РНК, соответственно.
Применение такой методики скрининга λ-кДНК библиотеки показано на рисунке 93.
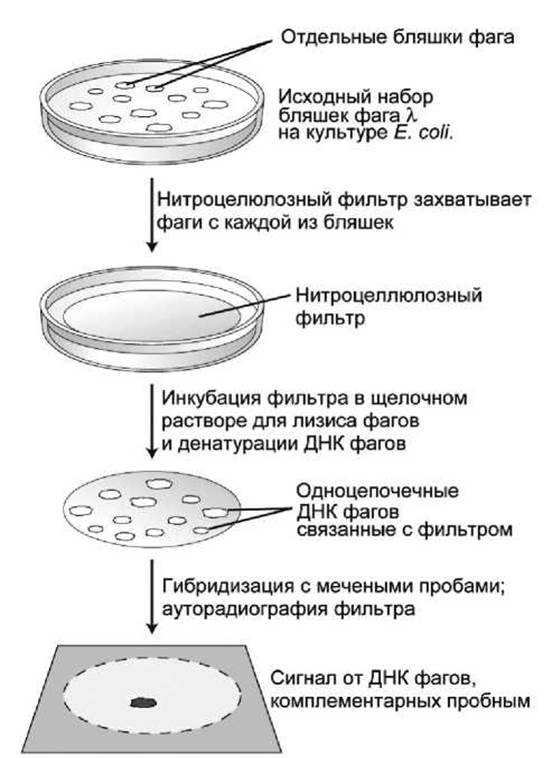
Рисунок 93 — Скрининг кДНК библиотеки радиоактивными зондами
Реплика чашки Петри, содержащая большое число λ-клопов, сначала воспроизводится на поверхности нитроцеллюлозной мембраны.
Затем мембрана анализируется, используя радиоактивно меченые зонды, специфические для рекомбинантной ДНК, содержащей искомый фрагмент.
Метод мембранной гибридизации с радиоактивно мечеными олигонуклеотидами обычно используется для скрининга λ-кДНК библиотек. Как только получен кДНК клон, кодирующий определённый белок, вся полноразмерная кДНК может быть помечена радиоактивными изотопами и использована в качестве зонда для определения наличия в геномной библиотеке клонов, содержащих фрагменты соответствующего гена.
ПредыдущаяСледующая
Этапы гибридизации зонда
-
- Сначала вкусовая последовательность ДНК расщепляется эндонуклеазой рестрикции.
- Затем переваренным фрагментам дают иммобилизоваться на нитроцеллюлозной мембране.
- После этого выбранный комплементарный зонд метят, а затем денатурируют.
- Зонды денатурации добавляют к нитроцеллюлозной бумаге и позволяют им связываться с комплементарной последовательностью, если присутствует какая-либо комплементарная ДНК, то эти зонды будут связываться с ними.
- После этого несвязанные зонды удаляют с нитроцеллюлозной бумаги с помощью промывочного буфера.
- Затем наличие гибридизации подтверждают методом авторадиографии.
Использование или применение гибридизационных зондов
-
- Используется в медицинской промышленности, пищевой промышленности, идентификации микробов и науке об окружающей среде для обнаружения различных нуклеиновых кислот, присутствующих в любом биологическом образце.
- Идентификация рекомбинантного клона, несущего желаемую вставку ДНК, с помощью методов гибридизации ДНК.
- Подтверждение интеграции вставки ДНК в геном хозяина.
- Разработка «Полиморфизма длин рестрикционных фрагментов (ПДРФ)».
- Гибридизация in situ для определения местоположения конкретной последовательности в конкретной хромосоме.
- Составление карты генома эукариот.
- Диагностика заболеваний, вызываемых паразитарными возбудителями вирусов.
Гибридизация нуклеиновых кислот
Метод молекулярной гибридизации нуклеиновых кислот – более тонкий метод оценки генетического сходства организмов. При помощи данного метода определяют число и степень сходства гомологичных участков в геномах сравниваемых видов. При помощи гибридизации нуклеиновых кислот впервые произведена количественная оценка родства микроорганизмов. В основе метода лежит способность одноцепочечных ДНК в определенных условиях соединяться с образованием двухцепочечных молекул ДНК.
При определении степени генетического родства данным методом ДНК, выделенную из клеток одного микроорганизма, денатурируют при помощи нагревания. Клетки второго штамма выращивают в среде, содержащей радиоактивный предшественник ДНК. В результате этого ДНК становится меченой. Из клеток меченого штамма выделяют ДНК, денатурируют и смешивают с денатурированной ДНК первого штамма. Раствор выдерживается при температуре ниже плавления ДНК. При этом происходит «отжиг» или реассоциация комплементарных цепей с образованием гибридных двухцепочечных молекул ДНК. Одноцепочечные молекулы удаляют.
Подобный эксперимент с препаратами ДНК неродственных бактерий, не выявляет ни какой гибридизации. Двойные спирали могут формироваться только при специфическом спаривании цепей, полученных из одной и той же молекулы ДНК.
Определение нуклеотидных последовательностей (секвенирование)
Определение нуклеотидных последовательностей (секвенирование) – метод, позволяющий проводить сопоставительный анализ последовательностей в различных молекулах РНК и ДНК. Секвенирование всего генома бактерии – трудоемкая и дорогостоящая процедура. В этой связи чаще всего анализируются нуклетотидные последовательности рибосомных РНК– 16S-рРНК.
Установлено, что 16S-рРНК универсально распространена, функционально постоянна и достаточно консервативна. Чем больше различий в последовательности нуклеотидов данной РНК двух бактерий, тем раньше началось расхождение между ними и тем дальше отстоят они друг от друга в филогенетических отношениях.
ДНК-полимеразная реакция (ПРЦ)
Полимеразная цепная реакция (ПЦР) – экспериментальный метод молекулярной биологии, при котором малые концентрации определенных фрагментов нуклеиновых кислот в биологической пробе многократно увеличиваются. Это позволяет точнее определить вид или другую систематическую категорию исследуемого биологического объекта.
Применение ДНК-полимеразной реакции позволяет значительно увеличить точность метода ДНК-зондов. В основе полимеразной цепной реакции (ПЦР) лежит многократный процесс удвоения специфического участка нуклеотидной последовательности, ускоряемое по принципу катализа ДНК-зависимой ДНК-полимеразой, а так же применение соответствующего праймера.
Праймер – это фрагмент ДНК, несущий наиболее специфичную для данного микроорганизма нуклеотидную последовательность участка гена или гена в целом. С помощью праймера обнаруживают искомый фрагмент идентифицируемого микроорганизма.
Типы гибридизационных зондов
Гибридизационный зонд бывает двух типов, например;
-
-
- ДНК-зонд
- РНК-зонд
-
1. ДНК-зонд
-
- ДНК-зонд представляет собой фрагмент ДНК, который имеет нуклеотидную последовательность, специфичную для интересующего гена или хромосомной области. ДНК-зонды используют гибридизацию нуклеиновых кислот со специально помеченными последовательностями для быстрого обнаружения комплементарных последовательностей в тестируемом образце.
- Зонды гибридизации ДНК в основном используются для обнаружения комплементарной ДНК в исследуемом образце.
- Размер зонда для гибридизации ДНК варьируется от 100 до 10000 пар оснований.
- ДНК-зонды могут быть получены с использованием химического метода или метода амплификации или с использованием библиотеки кДНК.
Пример ДНК-зонда:
A. Зонд TaqMan:
-
- Зонд TaqMan впервые обнаружен Кэри Маллис.
- TaqMan представляет собой тип зонда для гидролиза, который используется в ПЦР в реальном времени.
- На 5′-конце этого зонда содержится флуорофор, а на 3′-конце — тушитель. молекула что является близостью флуорофора.
- Зонды TaqMan используются для количественного определения ДНК или генов и исследований экспрессии генов.
Механизм зонда Taqman:
-
-
- Как только зонд Taqman связывается со своей комплементарной последовательностью, ДНК-полимераза фермент начнет синтезировать новую цепь, но в то же время он удалит зонд за счет экзонуклеазной активности от 3 ‘до 5’.
- После этого зонд не гасится, а флуорофоры отрываются от молекулы гасителя и испускают флуоресценцию.
- Затем зонд TaqMan гидролизуется и начинает излучать флуоресценцию, которую измеряет детектор.
-
B. Молекулярный маяк:
-
- Молекулярный маяк — это тип шпилечного зонда, который используется в количественном анализе.
- Молекулярные маяки содержат два комплементарных конца, которые присоединены друг к другу с помощью флуорофора на одном конце и молекулы гасителя на другом конце.
- Краситель-гаситель находится близко к флуоресцентной молекуле. Вот почему флуорофор не может излучать флуоресценцию.
2. РНК-зонд
-
- РНК-зонды представляют собой участки одноцепочечной РНК, используемые для обнаружения наличия комплементарных последовательностей нуклеиновых кислот (последовательностей-мишеней) путем гибридизации.
- РНК-зонды обычно метят, например, радиоизотопами, эпитопами, биотином или флуорофорами, чтобы обеспечить их обнаружение.
- Эти зонды синтезируются путем транскрипции in vitro и могут быть заменены ДНК-зондами почти во всех приложениях.
- РНК-зонды, также известные как рибозонды или кРНК-зонды.
- РНК-зонды используются для обнаружения мРНК в тестируемом образце.
- После того, как РНК-зонды будут сконструированы для нозерн-блот-гибридизации, они будут использованы для гибридизации на нитроцеллюлозной бумаге.
- Затем сигнал гибридизации на нитроцеллюлозной бумаге с иммобилизованной одноцепочечной нуклеиновой кислотой-мишенью можно обнаружить с помощью авторадиографии.
РИСУНОК: Связывание молекулярного маяка с комплементарной последовательностью и не комплементарной последовательностью. | Источник изображения: geneticeducation.co.in
Использование в микробной экологии
В области микробная экология олигонуклеотидные зонды используются для определения присутствия микробных видов, родов или микроорганизмов, классифицированных на более широком уровне, например бактерии, археи, и эукариоты через флуоресценция in situ гибридизация (РЫБЫ). Зонды рРНК позволили ученым визуализировать микроорганизмы, которые еще предстоит культивировать в лабораторных условиях, путем извлечения последовательностей рРНК непосредственно из окружающей среды. Примеры этих типов микроорганизмов включают:
- Невская Рамоса: N. ramosa бактерия-нейстон, образующая типичные дихотомически разветвленные розетки на поверхности мелководных пресноводных местообитаний.
- Ахроматиум оксалиферум: Эта огромная бактерия (длина клеток до> 100 мкм, диаметр до 50 мкм) содержит глобулы серы и массивные включения кальцита и обитает в верхних слоях пресноводных отложений. Он виден невооруженным глазом и из-за своей устойчивости к выращиванию озадачил поколения микробиологов.
Ограничения
В некоторых случаях различие между видами может быть проблематичным при использовании 16S рРНК последовательности из-за сходства. В таких случаях 23S рРНК может быть лучшей альтернативой. Глобальная стандартная библиотека последовательностей рРНК постоянно увеличивается и постоянно обновляется, и, следовательно, возможность случайного события гибридизации между специально разработанным зондом (на основе полных и текущих данных от ряда тестовых организмов) и нежелательным / неизвестным целевой организм не может быть легко отклонен. Напротив, вполне вероятно, что существуют микроорганизмы, которые еще предстоит идентифицировать, которые филогенетически являются членами целевой группы зонда, но имеют частичные или почти идеальные сайты-мишени. обычно применяется при разработке зондов для конкретных групп.
Вероятно, самым большим практическим ограничением этого метода является отсутствие доступной автоматизации.






























