Влияние условий среды на активность ферментов
Биохимические реакции необходимы для роста, восстановления поврежденных тканей и получения энергии, и они происходят в телах всех живых организмов. Эти реакции называются метаболизмом, и они постоянно происходят в живых организмах. Если они перестают работать, это приводит к гибели организма.
Для всех реакций, происходящих в живых организмах, требуется высокая энергия активации. Чтобы уменьшить потребление энергии клеткой, существует катализатор, обеспечивающий быстрое протекание химических реакций и уменьшающий активацию энергии. Этим катализатором являются ферменты.
Существует несколько факторов, влияющих на скорость действия фермента, таких как концентрация фермента, концентрация субстрата, температура, концентрация ионов водорода (рН) и присутствие ингибиторов.
Каждый фермент имеет значение рН, при котором он работает с максимальной эффективностью, называемое оптимальным рН. Если рН ниже или выше оптимального, активность фермента снижается до тех пор, пока он не перестанет работать. Например, пепсин работает при низком рН, то есть он очень кислый, в то время как трипсин работает при высоком рН, то есть он основной. Большинство ферментов работают при нейтральном рН 7,4.
Что такое липаза и для чего она нужна?
Это сложное соединение является активной фракцией фермента. Липаза способна расщеплять сложные жировые вещества на триглицериды, в дальнейшем — на жирные кислоты, которые в итоге идут на обеспечение энергетического обмена.
Помимо выработки энергии, липаза также принимает участие в усвоении полиненасыщенных жирных кислот и жирорастворимых витаминов А, D, E, F, K.
Секреция фермента
Липаза — это фермент, который секретируется во многих органах, но в разных количествах.
дольки гепатоцитов; желудочные клетки; энтероциты кишечника; легочная ткань; белые кровяные тельца — лейкоциты; ротовая полость младенца во время грудного вскармливания.
Принципы действия липазы
Основную роль, заключающуюся в расщеплении сложных жиров на простые вещества, обеспечивает панкреатическая липаза. Для ее активации требуется определенная последовательность. Именно панкреатическая липаза является той фракцией фермента, которую определяет анализ крови.
В желудочно-кишечный тракт фермент попадает в виде неактивной фракции пролипазы. После воздействия на него желчных кислот и ко-липазы (еще один фермент, который вырабатывается поджелудочной железой), пролипаза превращается в активную форму и начинает выполнять свою функцию. Она приступает к расщеплению тех жиров, которые уже были подвержены химическому влиянию и эмульгированы желчными кислотами.
Помимо основного действия, имеется второстепенная роль того небольшого количества фермента, фракции которого вырабатываются другими органами.
Лингвальная липаза, которая вырабатывается специальными железами новорожденных обеспечивает начало пищеварительного процесса с расщеплением жиров в грудном молоке уже в ротовой полости. Это возможно объяснить тем, что панкреатическая ферментативная активность в первый год жизни слабо развита и не позволяет полностью усваивать необходимые для обеспечения энергетического баланса вещества.
Печеночная липаза выступает ответственной за контроль содержания липидов в плазме крови. Она регулирует поступление и баланс липопротеидов низкой плотности и хиломикронов. Интересно, что высокое содержание данных веществ способствует развитию атеросклеротического поражения сосудов. То есть, косвенно, нормальный уровень печеночной липазы выступает фактором профилактики развития атеротромбоза.
Кишечная липаза после выброса и объединения в полости ЖКТ с панкреатической фракцией обеспечивает расщепление и усвоение жирорастворимых витаминов.
Для чего берут кровь на липазу?
В биохимическом анализе крови можно уточнить содержание только панкреатической фракции, так как остальные даже не определятся количественно из-за очень малого персистирующего объема в кровяном русле.
Поэтому причиной забора крови чаще всего является специфическая диагностика заболеваний поджелудочной железы — чаще всего, хронического панкреатита. Иногда проводят несколько процедур в различные сроки, чтобы выяснить динамику течения процесса и эффективность назначенного лечения.
Ферментная избирательность
Одним из наиболее важных отличий ферментов от неорганических катализаторов является их избирательное отношение к субстрату. Механизм действия ферментов таков, что они могут ускорять реакцию только с определенным субстратом или группой сходных по строению субстратов.
Например, в организме животных и человека отсутствует фермент, расщепляющий целлюлозу, но вот крахмал легко подвергаются гидролизу ферментом амилазой. Разница в строении этих углеводов состоит только лишь в том, что молекула первого вещества состоит из остатков β-глюкозы, а молекула другого — из остатков а-глюкозы. Фермент амилаза действует на α-гликозидную связь в молекуле крахмала, но не действует на β-гликозидную связь в целлюлозе.
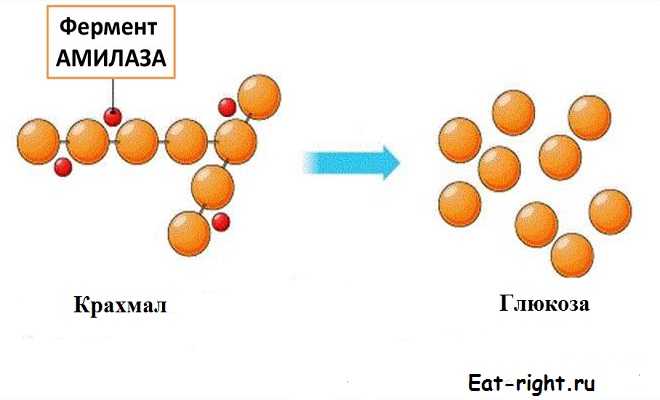
Другой пример — фермент трипсин расщепляет разные виды белков, т.к. действует на пептидную связь. Этот фермент обладает групповой специфичностью, так как действует на вещества с одинаковой связью.
Но есть такие ферменты, которые катализируют реакцию только с одним-единственным веществом.
Механизм действия ферментов
Акт катализа складывается из трех последовательных
этапов.
1.Образование
фермент-субстратного комплекса при взаимодействии через активный центр.
2.Связывание
субстрата происходит в нескольких точках активного центра, что приводит к
изменению структуры субстрата, его деформации за счет изменения энергии связей
в молекуле. Это вторая стадия и называется она активацией субстрата. При этом
происходит определенная химическая модификация субстрата и превращение его в
новый продукт или продукты.
3.В
результате такого превращения новое вещество (продукт) утрачивает способность
удерживаться в активном центре фермента и фермент-субстратный, вернее уже
фермент-продуктный комплекс диссоциирует (распадается).
Виды каталитических реакций:
А+Е = АЕ = БЕ = Е + Б
А+Б +Е = АЕ+Б = АБЕ = АБ + Е
АБ+Е = АБЕ = А+Б+Е,где Е — энзим, А и Б — субстраты, либо
продукты реакции.
Ферментативные эффекторы — вещества, изменяющие
скорость ферментативного катализа и регулирующие за счет этого метаболизм.
Среди них различают ингибиторы — замедляющие скорость реакции и активаторы
— ускоряющие ферментативную реакцию.
В зависимости от механизма торможения реакции
различают конкурентные и неконкурентные ингибиторы. Строение молекулы
конкурентного ингибитора сходно со структурой субстрата и совпадает с
поверхностью активного центра как ключ с замком (или почти совпадает). Степень
этого сходства может даже быть выше чем с субстратом.
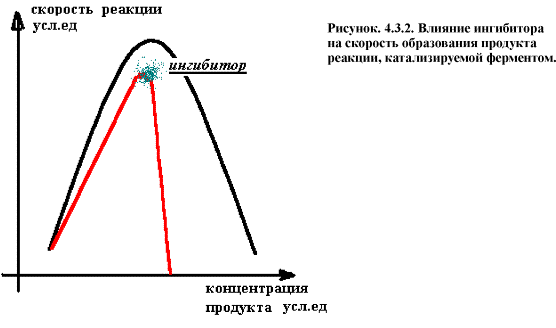
Если А+Е = АЕ = БЕ = Е + Б ,
тоИ+Е = ИЕ ¹
Концентрация способного к катализу фермента при этом
снижается и скорость образование продуктов реакции резко падает (рис. 4.3.2.).
В качестве конкурентных ингибиторов выступает большое
число химических веществ эндогенного и экзогенного происхождения (т.е.
образующихся в организме и поступающих извне – ксенобиотики, соответственно).
Эндогенные вещества являются регуляторами метаболизма и называются
антиметаболитами. Многие из них используют при лечении онкологических и
микробных заболеваний, тк. они ингибируют ключевые метаболичекие реакции
микроорганизмов (сульфаниламиды) и опухолевых клеток. Но при избытке субстрата
и малой концентрации конкурентного ингибитора его действие отменяется.
Второй вид ингибиторов — неконкурентные. Они
взаимодействую с ферментом вне активного центра и избыток субстрата не влияет
на их ингибирующую способность, как в случае с конкурентными ингибиторами. Эти
ингибиторы взаимодействуют или с определенными группами фермента (тяжелые
металлы связываются с тиоловыми группами Цис) или чаще всего регуляторным
центром, что снижает связывающую способность активного центра. Собственно
процесс ингибирования — это полное или частичное подавление активности фермента
при сохранении его первичной и пространственной структуры.
Различают также обратимое и необратимое
ингибирование. Необратимые ингибиторы инактивируют фермент, образуя с его АК
или другими компонентами структуры химическую связь. Обычно это ковалентная связь
с одним из участков активного центра. Такой комплекс практически недиссоциирует
в физиологических условиях. В другом случае ингибитор нарушает конформационную
структуру молекулы фермента — вызывает его денатурацию.
Действие обратимых ингибиторов может быть снято при
переизбытке субстрата или под действием веществ, изменяющих химическую
структуру ингибитора. Конкурентные и неконкурентные ингибиторы относятся в
большинстве случаев к обратимым.
Помимо ингибиторов известны еще активаторы
ферментативного катализа. Они:
1)защищают
молекулу фермента от инактивирующих воздействий,
2)образуют
с субстратом комплекс, который более активно связывается с активным центром Ф,
3)взаимодействуя
с ферментом, имеющим четвертичную структуру, разъединяют его субъединицы и тем
самым открывают доступ субстрату к активному центру.
Классификация
В зависимости от роли в химических реакциях, различаются такие классы ферментов:
|
Классы |
Особенности |
|
Оксиредуктазы |
Катализируют окисление своих субстратов, перенося электроны или атомы водорода |
|
Трансферазы |
Участвуют в переносе химических групп из одного вещества в другое |
|
Гидролазы |
Расщепляют крупные молекулы на более мелкие, добавляя к ним молекулы воды |
|
Лиазы |
Катализируют расщепление молекулярных связей без процесса гидролиза |
|
Изомеразы |
Активируют перестановку атомов в молекуле |
|
Лигазы (синтетазы) |
Образуют связи с атомами углерода, используя энергию АТФ. |
В живом организме все ферменты делятся на внутри- и внеклеточные. К внутриклеточным относятся, например, ферменты печени, участвующие в реакциях обезвреживания различных веществ, поступающих с кровью. Они обнаруживаются в крови при повреждении органа, что помогает в диагностике его заболеваний.
Внутриклеточные ферменты, которые являются маркерами повреждения внутренних органов:
- печень – аланинаминотрансефраза, аспартатаминотрансфераза, гамма-глютамилтранспептидаза, сорбитдегидрогеназа;
- почки – щелочная фосфатаза;
- предстательная железа – кислая фосфатаза;
- сердечная мышца – лактатдегидрогеназа
Внеклеточные ферменты выделяются железами во внешнюю среду. Основные из них секретируются клетками слюнных желез, желудочной стенки, поджелудочной железы, кишечника и активно участвуют в пищеварении.
Распределение ферментов в организме
Ферменты, участвующие в синтезе белков, нуклеиновых
кислот и ферменты энергетического обмена присутствуют во всех клетках
организма. Но клетки, которые выполняют специальные функции содержат и
специальные ферменты. Так клетки островков Лангерганса в поджелудочной железе
содержат ферменты, катализирующие синтез гормонов инсулина и глюкагона.
Ферменты, свойственные только клеткам определенных органов называют
органоспецифическими: аргиназа и урокиназа —
печень, кислая фосфатаза
— простата. По изменению концентрации таких ферментов в крови судят о наличии
патологий в данных органах.
В клетке отдельные ферменты распределены по всей
цитоплазме, другие встроены в мембраны митохондрий и эндоплазматического
ретикулума, такие ферменты образуют компартменты, в которых происходят
определенные, тесно связанные между собой этапы метаболизма.
Многие ферменты образуются в клетках и секретируются
в анатомические полости в неактивном состоянии — это проферменты. Часто в виде
проферментов образуются протеолитические ферменты (расщепляющие белки). Затем
под воздействием рН или других ферментов и субстратов происходит их химическая
модификация и активный центр становится доступным для субстратов.
Существуют также изоферменты — ферменты,
отличающиеся по молекулярной структуре, но выполняющие одинаковую функцию.
Механизм действия ферментов
Рассмотрим общий механизм действия ферментов. В начале реакции происходит соединение фермента (A) с субстратом (B), в результате образуется фермент-субстратный комплекс (A — B). Далее в активном центре фермента происходят преобразования субстрата, изменяются связи в молекуле субстрата, конфигурация фермента. На первом этапе образуется комплекс фермента с видоизмененным субстратом (A* — B*). Далее в активном центре происходит собственно реакция и образуется фермент-продуктный комплекс (A* — C). После окончания реакции комплекс распадается, освобождается продукт (C), а фермент вновь восстанавливается, каким был до начала реакции (A). Теперь он готов к новой реакции.
Процесс можно представить в виде схемы:
фермент + субстрат фермент-субстрат фермент-продукт фермент + продукт
A + B A — B A* — B* A* — C A + C
А теперь, для наглядности, представим механизм действия ферментов в виде рисунка:
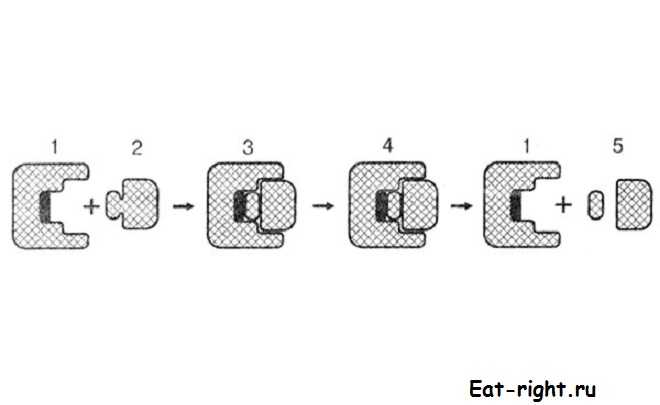
Механизм действия фермента: 1 — фермент; 2 — субстрат; 3 — фермент-субстратный комплекс; 4 — фермент-продуктный комплекс; 5 — освобожденный продукт
На скорость ферментативных реакций могут оказывать влияние различные факторы:
Известно, что скорость химических реакций зависит, прежде всего, от концентрации веществ. Но у ферментативных реакций есть своя особенность. Их скорость зависит не столько от концентрации субстрата, сколько от концентрации фермента. Скорость реакции прямо пропорциональна концентрации фермента. Чем больше количество молекул фермента, тем быстрее будет протекать реакция.
Помимо этого скорость реакции и активность фермента зависят от температуры, причем она уменьшается как при низких, так и при высоких температурах. При низких температурах слишком мала энергия активации молекул субстрата и фермента. При высоких температурах белки-ферменты денатурируют, т. е. сворачиваются и полностью разрушаются. Оптимальным считается температурный интервал от 25 до 40 °C.
Также на активность фермента и скорость реакции влияет различная концентрация ионов H+ и OH—, т. е. pH среды. Большинство ферментов активны в узких пределах pH, чаще всего в нейтральной среде. Сдвиг концентрации ионов водорода может изменить электрический заряд белка-фермента, что приведет к изменению конфигурации молекулы и падению активности. Некоторые ферменты могут катализировать реакции в слабощелочной среде, например амилаза слюны, а другие — в кислой среде, например фермент желудка пепсин. Перепады pH среды также вызывают денатурацию фермента, но она, как правило, обратима.
На скорость реакции и активность ферментов могут влиять и различные низкомолекулярные вещества:
Существуют активаторы ферментов — те, которые повышают их активность и ингибиторы — те, которые либо замедляют действие ферментов, либо совсем его прекращают. Это отдельная, большая тема о которой мы поговорим уже в следующей статье.
Общие свойства ферментов
Ферменты представляют собой молекулы белковой природы, которые взаимодействуют с различными веществами, ускоряя их химическое превращение по определенному пути. При этом они не расходуются. В каждом ферменте есть активный центр, присоединяющийся к субстрату, и каталитический участок, запускающий ту или иную химическую реакцию. Эти вещества ускоряют протекающие в организме биохимические реакции без повышения температуры.
Основные свойства ферментов:
- специфичность: способность фермента действовать только на специфический субстрат, например, липазы – на жиры;
- каталитическая эффективность: способность ферментативных белков ускорять биологические реакции в сотни и тысячи раз;
- способность к регуляции: в каждой клетке выработка и активность ферментов определяется своеобразной цепью превращений, влияющей на способность этих белков вновь синтезироваться.
Роль ферментов в организме человека невозможно переоценить. В то время, когда еще только открыли структуру ДНК, говорили, что один ген отвечает за синтез одного белка, который уже определяет какой-то определенный признак. Сейчас это утверждение звучит так: «Один ген – один фермент – один признак». То есть без активности ферментов в клетке жизнь не может существовать.
Пищеварительные ферменты
Пищеварительные ферменты – это белки, которые ускоряют расщепление крупных молекул, входящих в состав пищи. Они разделяют такие молекулы на более мелкие фрагменты, которые легче усваиваются клетками. Основные типы пищеварительных ферментов – протеазы, липазы, амилазы.
Основная пищеварительная железа – поджелудочная. Она вырабатывает большинство этих ферментов, а также нуклеаз, расщепляющих ДНК и РНК, и пептидаз, участвующих в образовании свободных аминокислот. Причем незначительное количество образующихся ферментов способно «обработать» большой объем пищи.
При ферментативном расщеплении питательных веществ выделяется энергия, которая расходуется для процессов обмена веществ и жизнедеятельности. Без участия ферментов, подобные процессы происходили бы слишком медленно, не обеспечивая организм достаточным энергетическим запасом.
Кроме того, участие ферментов в процессе пищеварения обеспечивает распад питательных веществ до молекул, способных проходить через клетки кишечной стенки и поступать в кровь.
Амилаза
Амилаза вырабатывается слюнными железами. Она действует на крахмал пищи, состоящий из длинной цепи молекул глюкозы. В результате действия этого фермента образуются участки, состоящие из двух соединенных молекул глюкозы, то есть фруктоза, и другие короткоцепочечные углеводы. В дальнейшем они метаболизируются до глюкозы в кишечнике и оттуда всасываются в кровь.
Слюнные железы расщепляют только часть крахмала. Амилаза слюны активна в течение короткого времени, пока пища прожевывается. После попадания в желудок фермент инактивируется его кислым содержимым. Большая часть крахмала расщепляется уже в 12-перстной кишке под действием панкреатической амилазы, вырабатываемой поджелудочной железой.
Рис. 2 — Амилаза начинает расщепление крахмала
Короткие углеводы, образовавшиеся под действием панкреатической амилазы, попадают в тонкий кишечник. Здесь с помощью мальтазы, лактазы, сахаразы, декстриназы они расщепляются до молекул глюкозы. Нерасщепляющаяся ферментами клетчатка выводится из кишечника с каловыми массами.
Протеазы
Белки или протеины — существенная часть человеческого рациона. Для их расщепления необходимы ферменты – протеазы. Они различаются по месту синтеза, субстратам и другим характеристикам. Некоторые из них активны в желудке, например, пепсин. Другие вырабатываются поджелудочной железой и активны в просвете кишечника. В самой железе выделяется неактивный предшественник фермента – химотрипсиноген, который начинает действовать только после смешивания с кислым пищевым содержимым, превращаясь в химотрипсин. Такой механизм помогает избежать самоповреждения протеазами клеток поджелудочной железы.
Рис. 3 — Ферментативное расщепление белков
Протеазы расщепляют пищевые белки на более мелкие фрагменты – полипептиды. Ферменты – пептидазы разрушают их до аминокислот, которые усваиваются в кишечнике.
Липазы
Пищевые жиры разрушаются ферментами-липазами, которые также вырабатываются поджелудочной железой. Они расщепляют молекулы жира на жирные кислоты и глицерин. Такая реакция требует наличия в просвете 12-перстной кишки желчи, образующейся в печени.
Рис. 4 — Ферментативный гидролиз жиров
Роль заместительной терапии препаратом «Микразим»
Для многих людей с нарушением пищеварения, прежде всего с заболеваниями поджелудочной железы, назначение ферментов обеспечивает функциональную поддержку органа и ускоряет процессы выздоровления. После купирования приступа панкреатита или другой острой ситуации прием ферментов можно прекратить, так как организм самостоятельно восстанавливает их секрецию.
Длительный прием ферментативных препаратов необходим лишь при тяжелой внешнесекреторной недостаточности поджелудочной железы.
Одним из наиболее физиологичных по своему составу является препарат «Микразим». В его состав входят амилаза, протеазы и липаза, содержащиеся в панкреатическом соке. Поэтому нет необходимости отдельно подбирать, какой фермент нужно использовать при разнообразных болезнях этого органа.
Показания для использования этого лекарства:
- хронический панкреатит, муковисцидоз и другие причины недостаточной секреции ферментов поджелудочной железы;
- воспалительные заболевания печени, желудка, кишечника, особенно после операций на них, для более быстрого восстановления пищеварительной системы;
- погрешности в питании;
- нарушение функции жевания, например, при стоматологических заболеваниях или малоподвижности пациента.
Прием пищеварительных ферментов с заместительной целью помогает избежать вздутия живота, жидкого стула, болей в животе. Кроме того, при тяжелых хронических заболеваниях поджелудочной железы Микразим полностью принимает на себя функцию по расщеплению питательных веществ. Поэтому они могут беспрепятственно усваиваться в кишечнике
Это особенно важно для детей, страдающих муковисцидозом
Важно: перед применением ознакомьтесь с инструкцией или проконсультируйтесь с лечащим врачом
Механизм действия ферментов
Молекулярный вес высокомолекулярных энзимов достигает нескольких миллионов. Молекулы субстратов, взаимодействующих с ними, гораздо меньше по размеру. Поэтому с субстратом они взаимодействуют не всей молекулой, а только ее частью, активным центром.
Механизм действия заключается в следующем. При соединении субстрата с ферментом образуется нестойкий фермент субстратный комплекс. В нем происходит активация молекулы субстрата за счет:
- поляризации химических связей в молекуле субстрат и перераспределение электронной плотности;
- деформации связей, вовлекаемых в реакцию;
- сближения и необходимой взаимной ориентации молекул субстрата.
Молекула субстрат фиксируется в активном центре фермента в напряженной конфигурации, в деформированном состоянии, что приводит к ослаблению прочности химических связей и снижает уровень энергетического барьера — субстрат активизируется.
В процессе ферментативной реакции различают четыре этапа.
- Присоединение субстрата к энзиму, вследствие чего формируется фермент-субстратный комплекс.
- Преобразование полученного комплекса в один или сразу несколько переходных комплексов.
- Образование комплекса фермент-продукт.
- Разделение конечного продукта реакции и фермента, остающегося в неизменном виде.
Действие ферментов может происходить с участием различных механизмов катализа. Выделяют два типа катализа:
- Кислотно-основной. В реакции участвуют энзимы, содержащие в своем активном центре специфические остатки аминокислот.
- Ковалентный. В реакции участвуют энзимы, которые при контакте с субстратами формируют нестабильные комплексы. В результате продукты образуются посредством внутримолекулярных перестроек.
Ферментативные реакции могут иметь три вида.
- «Пинг-понг». Взаимодействия, при которых энзим соединяется с одним субстратом и заимствует у него определенные вещества, а потом соединяется с другим субстратом и отдает ему полученные химические группы.
- Последовательные взаимодействия, когда к энзиму поочередно присоединяется сначала один, а потом и другой субстрат, в результате чего формируется так называемый «тройной комплекс», в котором и происходит катализ.
- Случайные взаимодействия, при которых субстраты реагируют с энзимом неупорядоченно, а после катализа также и отщепляются.
Строение ферментов
Каждый фермент имеет определенное строение. Результаты исследований показали, что молекулы ферментов во много раз больше, чем молекулы веществ, которые они активируют в реакциях.
В ферменте различают три центра: субстратный, активный и регуляторный.
Непосредственно в реакции участвует лишь небольшая часть белковой молекулы. Это каталитический, или активный, центр фермента. Активный центр является главной частью фермента. Здесь происходит видоизменение субстрата, собственно реакция, образуются продукты или продукт.
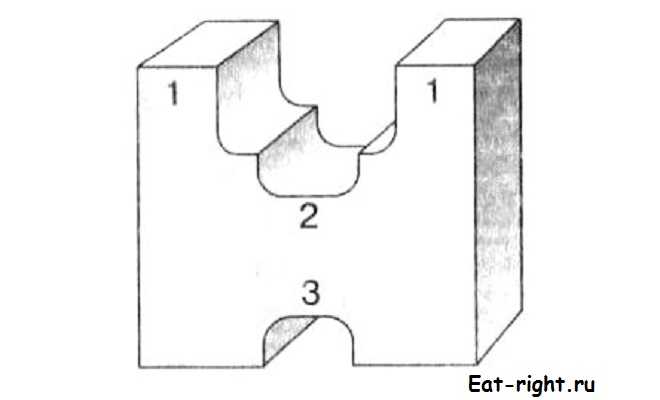
Строение фермента: 1 — субстратный центр; 2 — активный центр; 3 — регуляторный центр
Субстратный центр служит «якорной» площадкой для соединения фермента с субстратом. При этом между ними возникают определенные связи, позволяющие ферменту удерживать субстрат. Активный и субстратный центры ферментов часто находятся рядом или вовсе совпадают.
Для работы этих центров, т.е. присоединения субстрата и катализа реакции, необходима определенная форма белка-фермента. Фермент сохраняет свою активность до тех пор, пока в нем поддерживается специфическая конфигурация каталитического центра.
Конфигурация белковой молекулы может изменяться таким образом, чтобы обеспечить быстрый доступ веществ в активный центр или, наоборот, затормозить реакцию. Эту функцию выполняет регуляторный центр фермента. К нему могут присоединяться ионы других веществ, которые видоизменяют форму молекулы фермента таким образом, чтобы способствовать быстрому соединению с субстратом или, наоборот, невозможности соединения.
Номенклатура и классификация ферментов
Название фермента
формируется из следующих частей:
1.название
субстрата с которым он взаимодействует
2.характер
катализируемой реакции
3.наименование
класса ферментов (но это необязательно)
4.суффикс
-аза-
пируват — декарбоксил — аза,сукцинат — дегидроген — аза
Посколькууже известно порядка 3 тыс. ферментов их необходимо классифицировать. В
настоящее время принята международная классификация ферментов, в основу которой
положен тип катализируемой реакции. Выделяют 6 классов, которые в свою очередь
делятся на ряд подклассов (в данной книге представлены только выборочно):
1.Оксидоредуктазы. Катализируют окислительно-восстановительные
реакции. Делятся на 17 подклассов. Все ферменты содержат небелковую часть в
виде гема или производных витаминов В2, В5. Субстрат,
подвергающийся окислению выступает как донор водорода.
1.1.Дегидрогеназы отщепляют от одного субстрата
водород и переносят на другие субстраты. Коферменты НАД, НАДФ, ФАД, ФМН. Они
акцептируют на себе отщепленный ферментом водород превращаясь при этом в
восстановленную форму (НАДН, НАДФН, ФАДН) и переносят к другому
фермент-субстратному комплексу, где его и отдают.
1.2.Оксидазы — катализирует перенос водорода на
кислород с образованием воды или Н2О2. Ф. Цитохромокисдаза
дыхательной цепи.
RH + NAD H + O2 = ROH + NAD + H2O
1.3.Монооксидазы — цитохром
Р450. По своему строению одновременно гемо- и флавопротеид. Он
гидроксилирует липофильные ксенобиотики (по вышеописанному механизму).
1.4.Пероксидазы и каталазы —
катализируют разложение перекисиводорода, которая образуется в ходе метаболических реакций.
1.5.Оксигеназы — катализируют реакции
присоединения кислорода к субстрату.
2.Трансферазы — катализируют перенос различных радикалов от молекулы донора к
молекуле акцептору.
Аа + Е + В = Еа + А + В = Е + Ва + А
2.1.Метилтрансферазы (СН3-).
2.2.Карбоксил- и карбамоилтрансферазы.
2.2.Ацилтрансферазы – Кофермент А (перенос
ацильной группы -R-С=О).
Пример: синтез
нейромедиатора ацетилхолина (см.главу
«Обмен белков»).
2.3.Гексозилтрансферазы- катализируют перенос гликозильных остатков.
Пример: отщепление молекулы глюкозы от гликогена под действием фосфорилазы.
2.4.Аминотрансферазы — перенос аминогрупп
R1- CO — R2 + R1 — CH-NH3 — R2 = R1 — CH-NH3 — R2 + R1- CO — R2
Играют важную роль в превращении
АК. Общим коферментом являнтся пиридоксальфосфат.
Пример: аланинаминотрансфераза
(АлАТ): пируват + глутамат = аланин + альфа-кетоглутарат (см.главу «Обмен белков»).
2.5.Фосфотрансфереза (киназа) — катализируют
перенос остатка фосфорной кислоты. В большинстве случает донором фосфата
является АТФ. В процессе расщепления глюкозы в основном принимают участие
ферменты этого класса.
Пример: Гексо (глюко)киназа.
3.Гидролазы — катализируют реакции
гидролиза, т.е. расщепление веществ с присоединением по месту разрыва связи
воды. К этому классу относятся преимущественно пищеварительные ферменты, они
однокомпонентные (не содержат небелковой части)
R1-R2 +H2O = R1H + R2OH
3.1.Эстеразы — расщепляют эфирные связи. Это большой
подкласс ферментов, катализирующих гидролиз тиоловых эфиров, фосфоэфиров.
Пример: липаза.
3.2.Гликозидазы
— расщепляют гликозидные связи в молекулах поли- и олигосахаридов.
Пример: амилаза, сахараза, мальтаза.
3.3.Пептидазы
— катализируют гидролиз пептидных связей.
Пример:
карбоксипептидаза, химотрипсин, трипсин.
3.5.Амидазы
— расщепляют амидные связи (СО-NH2).
Пример: аргиназа
(цикл мочевины).
4.Лиазы — катализируют реакции расщепления молекул без присоединения воды. Эти
ферменты имеют небелковую часть в виде тиаминпирофосфата (В1) и
пиридоксальфосфата (В6).
4.1.Лиазы
связи С-С. Их обычно называют декарбоксилазами.
Пример: пируватдекарбоксилаза.
4.2.Лиазы
связи (гидратазы-дегидратазы) С-О.
Примеренолаза.
4.3.Лиазы
связи С-N.
4.4.Лиазы
связи С-S.
5.Изомеразы — катализируют реакции изомеризации.
Пример: фосфопентозоизомераза, пентозофосфатизомераза(ферменты
неокислительной ветви пентозофосфатного пути).
6.Лигазы катализируют реакции синтеза более сложных веществ из простых. Такие
реакции идут с затратой энергии АТФ. К названию таких ферментов прибавляют
«синтетаза».
ЛИТЕРАТУРА К ГЛАВЕIV.3.
1. Бышевский А. Ш., Терсенов
О. А. Биохимия для врача // Екатеринбург: Уральский рабочий, 1994, 384 с.;
2. Кнорре Д. Г., Мызина С.
Д. Биологическая химия. – М.: Высш. шк. 1998, 479 с.;
3. Филиппович Ю. Б., Егорова
Т. А., Севастьянова Г. А. Практикум по общей биохимии // М.: Просвящение, 1982,
311с.;
4. Ленинджер А. Биохимия. Молекулярные основы
структуры и функций клетки // М.: Мир, 1974, 956 с.;
5. Пустовалова Л.М. Практикум по биохимии //
Ростов-на Дону: Феникс, 1999, 540 с.
Что такое ферменты в биологии — общее определение
Ферменты, или энзимы — это белковые молекулы, которые синтезируются живыми клетками и играют важную роль в биохимических процессах организма.
На латинском «fermentum» означает «брожение», «бродильное начало», в переводе с греческого «энзимы» означают «закваска».
В настоящее время известны более двух тысяч их видов.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут
Энзимы участвуют в переваривании пищевых продуктов, стимуляции деятельности головного мозга, процессах энергообеспечения клеток, восстановлении органов и тканей.
Особенность специфических белков — запуск биохимических реакций в организме, большинство из которых идет только в присутствии соответствующих энзимов. Каждый из них активизирует только один биохимический процесс. Поэтому в организме существует огромное их количество: не менее сотни в каждой клетке.
Примечание
Биологические катализаторы, коими являются ферменты, облегчают протекание химической реакции и за счет этого увеличивают ее скорость. Как катализаторы, они не изменяют ее направление и не расходуются в процессе реакции, не входят в состав ее конечных продуктов. Без них реакции в живых организмах протекали бы очень медленно и не могли бы поддерживать его жизнеспособность.
В зависимости от того, какие виды реакций организма катализируют энзимы, они выполняют различные функции. Чаще всего их подразделяют на две основные группы.
- Пищеварительные. Вырабатываются поджелудочной железой, разрушают питательные вещества, способствуют их абсорбции в системный кровоток. Различают три основные категории таких белковых веществ:
- амилаза — расщепляет углеводы, находится в слюне, панкреатическом секрете и в содержимом кишечника;
- протеаза — помогает переваривать белки, находится в желудочном соке, панкреатическом секрете и в содержимом кишечника;
- липаза — расщепляет жиры, находится в желудочном соке и панкреатическом секрете.
- Метаболические. Катализируют биохимические процессы внутри клеток. Каждый орган или ткань организма имеет свою сеть ферментов.
Пример
сладковатый вкус во рту человека возникает при пережевывании риса или картофеля, содержащих сложный углевод крахмал. Присутствующая в слюне амилаза расщепляет безвкусный полисахарид на сладкие на вкус моносахариды с меньшей молекулярной массой — декстрин, мальтозу, глюкозу.
По строению биокатализаторы могут быть:
- простыми, состоящими только из белка и распадающимися только на аминокислоты. К числу простых относятся гидролитические ферменты типа пепсин, трипсин, уреаза;
- сложными, состоящими из белковой части, апофермента, и небелковой, кофактора. Роль кофакторов в двухкомпонентных энзимах играют большинство витаминов, липоевая кислота, многие двухвалентные металлы.












![Общие представления о механизме действия ферментов [1974 ермолаев м.в. - биологическая химия]](http://lesniepolyani.ru/wp-content/uploads/4/4/0/440ae5cfb2410e879e0d375e5d749b40.jpeg)












![Общие представления о механизме действия ферментов [1974 ермолаев м.в. - биологическая химия]](http://lesniepolyani.ru/wp-content/uploads/7/2/e/72eb95194679693c1bde1982d28b4482.webp)




