Номенклатура и классификация ферментов
Название фермента
формируется из следующих частей:
1.название
субстрата с которым он взаимодействует
2.характер
катализируемой реакции
3.наименование
класса ферментов (но это необязательно)
4.суффикс
-аза-
пируват — декарбоксил — аза,сукцинат — дегидроген — аза
Посколькууже известно порядка 3 тыс. ферментов их необходимо классифицировать. В
настоящее время принята международная классификация ферментов, в основу которой
положен тип катализируемой реакции. Выделяют 6 классов, которые в свою очередь
делятся на ряд подклассов (в данной книге представлены только выборочно):
1.Оксидоредуктазы. Катализируют окислительно-восстановительные
реакции. Делятся на 17 подклассов. Все ферменты содержат небелковую часть в
виде гема или производных витаминов В2, В5. Субстрат,
подвергающийся окислению выступает как донор водорода.
1.1.Дегидрогеназы отщепляют от одного субстрата
водород и переносят на другие субстраты. Коферменты НАД, НАДФ, ФАД, ФМН. Они
акцептируют на себе отщепленный ферментом водород превращаясь при этом в
восстановленную форму (НАДН, НАДФН, ФАДН) и переносят к другому
фермент-субстратному комплексу, где его и отдают.
1.2.Оксидазы — катализирует перенос водорода на
кислород с образованием воды или Н2О2. Ф. Цитохромокисдаза
дыхательной цепи.
RH + NAD H + O2 = ROH + NAD + H2O
1.3.Монооксидазы — цитохром
Р450. По своему строению одновременно гемо- и флавопротеид. Он
гидроксилирует липофильные ксенобиотики (по вышеописанному механизму).
1.4.Пероксидазы и каталазы —
катализируют разложение перекисиводорода, которая образуется в ходе метаболических реакций.
1.5.Оксигеназы — катализируют реакции
присоединения кислорода к субстрату.
2.Трансферазы — катализируют перенос различных радикалов от молекулы донора к
молекуле акцептору.
Аа + Е + В = Еа + А + В = Е + Ва + А
2.1.Метилтрансферазы (СН3-).
2.2.Карбоксил- и карбамоилтрансферазы.
2.2.Ацилтрансферазы – Кофермент А (перенос
ацильной группы -R-С=О).
Пример: синтез
нейромедиатора ацетилхолина (см.главу
«Обмен белков»).
2.3.Гексозилтрансферазы- катализируют перенос гликозильных остатков.
Пример: отщепление молекулы глюкозы от гликогена под действием фосфорилазы.
2.4.Аминотрансферазы — перенос аминогрупп
R1- CO — R2 + R1 — CH-NH3 — R2 = R1 — CH-NH3 — R2 + R1- CO — R2
Играют важную роль в превращении
АК. Общим коферментом являнтся пиридоксальфосфат.
Пример: аланинаминотрансфераза
(АлАТ): пируват + глутамат = аланин + альфа-кетоглутарат (см.главу «Обмен белков»).
2.5.Фосфотрансфереза (киназа) — катализируют
перенос остатка фосфорной кислоты. В большинстве случает донором фосфата
является АТФ. В процессе расщепления глюкозы в основном принимают участие
ферменты этого класса.
Пример: Гексо (глюко)киназа.
3.Гидролазы — катализируют реакции
гидролиза, т.е. расщепление веществ с присоединением по месту разрыва связи
воды. К этому классу относятся преимущественно пищеварительные ферменты, они
однокомпонентные (не содержат небелковой части)
R1-R2 +H2O = R1H + R2OH
3.1.Эстеразы — расщепляют эфирные связи. Это большой
подкласс ферментов, катализирующих гидролиз тиоловых эфиров, фосфоэфиров.
Пример: липаза.
3.2.Гликозидазы
— расщепляют гликозидные связи в молекулах поли- и олигосахаридов.
Пример: амилаза, сахараза, мальтаза.
3.3.Пептидазы
— катализируют гидролиз пептидных связей.
Пример:
карбоксипептидаза, химотрипсин, трипсин.
3.5.Амидазы
— расщепляют амидные связи (СО-NH2).
Пример: аргиназа
(цикл мочевины).
4.Лиазы — катализируют реакции расщепления молекул без присоединения воды. Эти
ферменты имеют небелковую часть в виде тиаминпирофосфата (В1) и
пиридоксальфосфата (В6).
4.1.Лиазы
связи С-С. Их обычно называют декарбоксилазами.
Пример: пируватдекарбоксилаза.
4.2.Лиазы
связи (гидратазы-дегидратазы) С-О.
Примеренолаза.
4.3.Лиазы
связи С-N.
4.4.Лиазы
связи С-S.
5.Изомеразы — катализируют реакции изомеризации.
Пример: фосфопентозоизомераза, пентозофосфатизомераза(ферменты
неокислительной ветви пентозофосфатного пути).
6.Лигазы катализируют реакции синтеза более сложных веществ из простых. Такие
реакции идут с затратой энергии АТФ. К названию таких ферментов прибавляют
«синтетаза».
ЛИТЕРАТУРА К ГЛАВЕIV.3.
1. Бышевский А. Ш., Терсенов
О. А. Биохимия для врача // Екатеринбург: Уральский рабочий, 1994, 384 с.;
2. Кнорре Д. Г., Мызина С.
Д. Биологическая химия. – М.: Высш. шк. 1998, 479 с.;
3. Филиппович Ю. Б., Егорова
Т. А., Севастьянова Г. А. Практикум по общей биохимии // М.: Просвящение, 1982,
311с.;
4. Ленинджер А. Биохимия. Молекулярные основы
структуры и функций клетки // М.: Мир, 1974, 956 с.;
5. Пустовалова Л.М. Практикум по биохимии //
Ростов-на Дону: Феникс, 1999, 540 с.
Функции ферментов
В настоящее время установлено, что ферменты ускоряют химические реакции в организмах, путем понижения свободной энергии активации (количество энергии необходимое для перевода при данной температуре всех молекул одного моля вещества в активное состояние).
Все обменные процессы в клетках микроорганизмов идут с участием ферментов. Они являются биокатализаторами всех химических процессов бактериальной клетки. Данные соединения значительно ускоряют химические реакции. При этом они не расходуются и не входят в состав конечных продуктов.
Ферменты в клетках бактерий присутствуют в незначительных концентрациях, но все они обладают высокими числами оборачиваемости, которые указывают на возможность молекулы фермента катализировать следующие одна за другой реакции тысяч молекул субстрата в минуту.
Установлено, что каждый фермент катализирует только одну реакцию, что обусловливает его специфичность. Обменные процессы микробов протекают с помощью ферментов, набор которых генетически детерминирован и специфичен для каждого вида.
В то же время количество того или иного фермента, содержащееся в бактериальной клетке изменчиво. Приспосабливаемость бактерий к изменяющимся условиям среды обитания сопровождается согласованными изменениями процессов анаболизма и катаболизма. Поскольку регуляция обменных процессов осуществляется с помощью ферментов, то и регуляторные (амфиболические) ферменты воспринимают разнообразные метаболические сигналы и в соответствии с ними изменяют свою каталитическую активность. Выделяют три уровня регуляции ферментативных реакций с учетом потребности клеток в энергии:
- первый – изменение абсолютного количества фермента;
- второй – изменение фона реагирующих веществ, исключая фермент;
- третий – изменение каталитической активности фермента.
Абсолютное количество определенного фермента определяется скоростью его синтеза (Ks) и скоростью распада (Kd) по схеме, приведенной на фото 2.
Количество фермента увеличивается за счет возрастания Ks или уменьшения Kd или уменьшается при соответствующем соотношении данных процессов.
Изменение каталитической активности фермента вызывается:
- ингибированием каталитической активности фермента по типу обратной связи (торможение активности фермента в начале биосинтетического пути конечным продуктом);
- аллостерической активацией (конечный и промежуточный продукт активирует другой, включающий синтез нового вещества);
- воздействием регуляторных белков, которые присоединяются к ферменту, изменяя (усиливая или ослабляя) его активность.
Принципы номенклатуры ферментов
В настоящее время существует три подхода к формированию названий ферментов. В соответствии с ними выделяют следующие типы номенклатуры:
- тривиальная (самая старая система);
- рабочая — удобна в употреблении, очень часто используется в учебной литературе;
- систематическая (или научная) — наиболее подробно и точно характеризует механизм действия фермента, но слишком сложна для повседневного употребления.
Систематическая и рабочая номенклатуры ферментов имеют общую черту, которая заключается в присоединении к концу любого названия суффикса «аза». Последний является своего рода «визитной карточкой» энзимов, выделяющей их из ряда других групп биологических соединений.
Существует еще одна система составления наименований, основанная на строении фермента. Номенклатура в таком случае делает акцент не на тип химической реакции, а на пространственную структуру молекулы.
Кроме собственно названия частью номенклатуры энзимов является их индексация, согласно которой каждому энзиму соответствует свой классификационный номер. В базах данных ферментов обычно указываются их шифр, рабочее и научное названия, а также схема химической реакции.
Современные принципы построения номенклатуры ферментов основаны на трех характеристиках:
- особенности осуществляемой энзимом химической реакции;
- класс фермента;
- субстрат, к которому применяется каталитическая активность.
Особенности раскрытия этих пунктов зависят от типа номенклатуры (рабочая или систематическая) и подкласса фермента, к которому они применяются.
Структура и механизм действия ферментов
Температура влияет на скорость химических и физических процессов. Присутствуют различные типы ферментов, и каждый из них обладает уникальной каталитической активностью или уникальной химической или метаболической реакцией.
Фермент притягивает субстраты к своему активному центру, катализирует химическую реакцию, в результате которой образуются продукты, а затем позволяет продуктам диссоциировать (отделяться от поверхности фермента). Комбинация, образованная ферментом и его субстратами, называется ферментно–субстратным комплексом.
Когда задействованы два субстрата и один фермент, комплекс называется тройным комплексом; один субстрат и один фермент называются бинарным комплексом. Субстраты притягиваются к активному участку электростатическими и гидрофобными силами, которые называются нековалентными связями, поскольку они являются физическими притяжениями, а не химическими связями.
Ковалентные промежуточные соединения между частью субстрата и ферментом возникают во многих ферментативных реакциях, в которых участвуют различные аминокислоты — серин, цистеин, лизин и глутаминовая кислота.
Как работают пищеварительные ферменты
Когда поджелудочная железа естественным образом не выделяет пищеварительные ферменты, это влияет на способность организма расщеплять пищу и усваивать питательные вещества. Это может привести к недоеданию, а также к таким симптомам, как вздутие живота, спазмы, газообразование и диарея.
Заменяющие пищеварительные ферменты заменяют естественные ферменты, помогая расщеплять углеводы, жиры и белки из продуктов. Затем питательные вещества всасываются в организм через стенку тонкого кишечника и распределяются по кровотоку.
В результате замена пищеварительных ферментов может помочь предотвратить нарушение всасывания и связанные с этим расстройства пищеварения.
Поскольку они предназначены для имитации ваших естественных ферментов поджелудочной железы, заменяющие пищеварительные ферменты необходимо принимать непосредственно перед едой. Таким образом, они могут выполнять свою работу, когда пища попадает в желудок и тонкий кишечник.
Продукты с пищеварительными ферментами:
| Пища | Ферменты | Польза |
| Ананас | Протеаза (бромелайн) | Помогает переваривать белки и обладает дополнительными противовоспалительными эффектами |
| Папайя | Протеаза (папаин) | Помогают переваривать белки, особенно мясо |
| Киви | Протеаза (актинидаин) | Помогают переваривать белки и являются популярным смягчителем мяса |
| Манго | Амилаза | Помогают расщеплять углеводы из крахмалов на простые сахара и увеличиваются со временем |
| Банан | Амилаза, глюкозидаза | Работают со сложными углеводами |
| Сырой мед | Амилаза, диастаза, инвертаза, протеаза | Амилазы и диастаза помогают расщеплять крахмалы, инвертазы —сахара, протеазы — белки |
| Авокадо | Липаза | Помогает переваривать и усваивать жир |
| Кефир | Липаза, лактаза, протеаза | Лактоза служит перевариванию кисломолочных продуктов |
| Квашеная капуста, кимчи | Липаза, протеаза | Содержат пробиотики |
| Мисо | Лактаза, липаза, протеаза, амилаза | Они расщепляют лактозу в молочных продуктах, жирах, белках и углеводах |
| Имбирь | Протеаза (зингибаин) | В дополнение к своим ферментам, которые могут помочь расщеплять белок, имбирь также может помочь облегчить тошноту |
Существует три вида непереносимости лактозы:
- Первичный. Человек рождается с геном, который делает его непереносимым к лактозе. Этот ген наиболее распространен у людей африканского, азиатского или испаноязычного происхождения. В детстве у человека внезапно падает уровень лактазы. Тогда он больше не сможет так легко переваривать молочные продукты. Это наиболее распространенный тип непереносимости лактозы.
- Вторичный. Тонкий кишечник вырабатывает меньше лактазы после болезни, травмы или операции. Это также может быть симптомом как целиакии, так и болезни Крона.
- Врожденный или развивающийся. С момента рождения тело не вырабатывает лактазу. Это редкость. Данный признак должен быть унаследован как от своей матери, так и от отца.
Классификация
В зависимости от роли в химических реакциях, различаются такие классы ферментов:
|
Классы |
Особенности |
|
Оксиредуктазы |
Катализируют окисление своих субстратов, перенося электроны или атомы водорода |
|
Трансферазы |
Участвуют в переносе химических групп из одного вещества в другое |
|
Гидролазы |
Расщепляют крупные молекулы на более мелкие, добавляя к ним молекулы воды |
|
Лиазы |
Катализируют расщепление молекулярных связей без процесса гидролиза |
|
Изомеразы |
Активируют перестановку атомов в молекуле |
|
Лигазы (синтетазы) |
Образуют связи с атомами углерода, используя энергию АТФ. |
В живом организме все ферменты делятся на внутри- и внеклеточные. К внутриклеточным относятся, например, ферменты печени, участвующие в реакциях обезвреживания различных веществ, поступающих с кровью. Они обнаруживаются в крови при повреждении органа, что помогает в диагностике его заболеваний.
Внутриклеточные ферменты, которые являются маркерами повреждения внутренних органов:
- печень – аланинаминотрансефраза, аспартатаминотрансфераза, гамма-глютамилтранспептидаза, сорбитдегидрогеназа;
- почки – щелочная фосфатаза;
- предстательная железа – кислая фосфатаза;
- сердечная мышца – лактатдегидрогеназа
Внеклеточные ферменты выделяются железами во внешнюю среду. Основные из них секретируются клетками слюнных желез, желудочной стенки, поджелудочной железы, кишечника и активно участвуют в пищеварении.
Роль заместительной терапии препаратом «Микразим»
Для многих людей с нарушением пищеварения, прежде всего с заболеваниями поджелудочной железы, назначение ферментов обеспечивает функциональную поддержку органа и ускоряет процессы выздоровления. После купирования приступа панкреатита или другой острой ситуации прием ферментов можно прекратить, так как организм самостоятельно восстанавливает их секрецию.
Длительный прием ферментативных препаратов необходим лишь при тяжелой внешнесекреторной недостаточности поджелудочной железы.
Одним из наиболее физиологичных по своему составу является препарат «Микразим». В его состав входят амилаза, протеазы и липаза, содержащиеся в панкреатическом соке. Поэтому нет необходимости отдельно подбирать, какой фермент нужно использовать при разнообразных болезнях этого органа.
Показания для использования этого лекарства:
- хронический панкреатит, муковисцидоз и другие причины недостаточной секреции ферментов поджелудочной железы;
- воспалительные заболевания печени, желудка, кишечника, особенно после операций на них, для более быстрого восстановления пищеварительной системы;
- погрешности в питании;
- нарушение функции жевания, например, при стоматологических заболеваниях или малоподвижности пациента.
Прием пищеварительных ферментов с заместительной целью помогает избежать вздутия живота, жидкого стула, болей в животе. Кроме того, при тяжелых хронических заболеваниях поджелудочной железы Микразим полностью принимает на себя функцию по расщеплению питательных веществ. Поэтому они могут беспрепятственно усваиваться в кишечнике
Это особенно важно для детей, страдающих муковисцидозом
Важно: перед применением ознакомьтесь с инструкцией или проконсультируйтесь с лечащим врачом
↑йКЮЯЯХТХЙЮЖХЪ ТЕПЛЕМРНБ
мЮ ЯЕЦНДМЪЬМХИ ДЕМЭ ХГБЕЯРМН АНКЕЕ 2000 ПЮГКХВМШУ ТЕПЛЕМРНБ. бЯЕ НМХ БЙКЧВЕМШ Б «йЮРЮКНЦ ТЕПЛЕМРНБ» Х ХЛ ОПХЯБНЕМ ЯБНИ СМХЙЮКЭМШИ МНЛЕП, ЯНЯРНЪЫХИ ХГ ВЕРШПЕУ ВХЯЕК, ПЮГДЕКЕММШУ РНВЙЮЛХ. оЕПБЮЪ ЖХТПЮ ЩРНЦН МНЛЕПЮ НАНГМЮВЮЕР ЙКЮЯЯ, Й ЙНРНПНЛС НРМНЯХРЯЪ ТЕПЛЕМР. бРНПЮЪ, РПЕРЭЪ Х ВЕРБЕПРЮЪ ЦПСООЮ ЖХТП НАНГМЮВЮЧР ЯННРБЕРЯРБЕММН ОНДЙКЮЯЯ, ОНДОНДЙКЮЯЯ Х МНЛЕП ТЕПЛЕМРЮ. мЮОПХЛЕП, ТЕПЛЕМР ЙЮРЮКЮГЮ ХЛЕЕР НАНГМЮВЕМХЕ 1.11.1.6, Ю α-ЮЛХКЮГЮ (ТЕПЛЕМР, БУНДЪЫХИ Б ЯНЯРЮБ ЯКЧМШ) – 3.2.1.1.
бЯЕЦН БШДЕКЪЧР ЬЕЯРЭ ЙКЮЯЯНБ ТЕПЛЕМРНБ, ПЮГКХВЮЧЫХУЯЪ ОН ЛЕУЮМХГЛС ЙЮРЮКХГХПСЕЛШУ ХЛХ ПЕЮЙЖХИ:
- нЙЯХДНПЕДСЙРЮГШ – ЙЮРЮКХГХПСЧР НЙХЯКХРЕКЭМН-БНЯЯРЮМНБХРЕКЭМШЕ ПЕЮЙЖХХ (ЯПЕДХ ТЕПЛЕМРНБ ЩРНЦН ЙКЮЯЯЮ ПЮГКХВЮЧР ДЕЦХДПНЦЕМЮГШ, НЙЯХДЮГШ, ЦХДПНЙЯХКЮГШ, ОЕПНЙЯХДЮГШ Х ДП.);
- рПЮМЯТЕПЮГШ – ОЕПЕМНЯЪР ПЮГКХВМШЕ ЦПСООШ НР НДМНЦН ЯСАЯРПЮРЮ МЮ ДПСЦНИ. тЕПЛЕМРШ ЩРНЦН ЙКЮЯЯЮ ЛНЦСР ОЕПЕМНЯХРЭ ЮЛХМНЦПСООШ (ЮЛХМНРПЮМЯТЕПЮГШ), НЯРЮРЙХ ЯЮУЮПНБ (ЦКХЙНГХКРПЮМЯТЕПЮГШ), НЯРЮРЙХ ФХПМШУ ЙХЯКНР (РПЮМЯЮЖХКЮГШ ХКХ РПЮМЯЮЖЕРХКЮГШ), НЯРЮРЙХ ТНЯТНПМНИ ЙХЯКНРШ (ЙХМЮГШ) Х Р.Д.
- цХДПНКЮГШ – НЯСЫЕЯРБКЪЧР ЦХДПНКХРХВЕЯЙНЕ ПЮЯЫЕОКЕМХЕ ПЮГКХВМШУ ЯБЪГЕИ. мЮОПХЛЕП, ОХЫЕБЮПХРЕКЭМШЕ ТЕПЛЕМРШ (РПХОЯХМ, ОЕОЯХМ, УХЛНРПХОЯХМ) ЦХДПНКХГСЧР ОЕОРХДМСЧ ЯБЪГЭ; ТНЯТЮРЮГШ ЙЮРЮКХГХПСЧР НРЫЕОКЕМХЕ ТНЯТЮРМШУ ЦПСОО; ЦКХЙНГХДЮГШ ПЮЯЫЕОКЪЧР ЯЮУЮПЮ; МСЙКЕЮГШ ПЮЯЫЕОКЪЧР МСЙКЕХМНБШЕ ЙХЯКНРШ; КХОЮГШ ЦХДПНКХГСЧР КХОХДШ.
- кХЮГШ – ЙЮРЮКХГХПСЧР МЕЦХДПНКХРХВЕЯЙНЕ НРЫЕОКЕМХЕ ХКХ ОПХЯНЕДХМЕМХЕ НОПЕДЕКЕММШУ ЦПСОО, Б УНДЕ ЙНРНПНЦН ОПНХЯУНДХР КХАН НАПЮГНБЮМХЕ, КХАН ХЯВЕГМНБЕМХЕ ДБНИМШУ ЯБЪГЕИ Б ЯРПСЙРСПЕ ЯСАЯРПЮРЮ. яПЕДХ ТЕПЛЕМРНБ ЩРНЦН ЙКЮЯЯЮ ЕЯРЭ ЦХДПЮРЮГШ (ОПХЯНЕДХМЪЧЫХЕ ЛНКЕЙСКС БНДШ ОН ДБНИМНИ ЯБЪГХ), ЮКЭДНКЮГШ, НАЕЯОЕВХБЮЧЫХЕ ЮКЭДНКЭМНЕ ПЮЯЫЕОКЕМХЕ ЯЮУЮПНБ Х ДП. ТЕПЛЕМРШ.
- хГНЛЕПЮГШ – ЙЮРЮКХГХПСЧР БГЮХЛНОПЕБПЮЫЕМХЕ ПЮГКХВМШУ ХГНЛЕПНБ (ЖХЯ-РПЮМЯ-ХГНЛЕПЮГШ НАЕЯОЕВХБЮЧР ХГНЛЕПХГЮЖХЧ С ДБНИМШУ ЯБЪГЕИ; ЛСРЮГШ, НАЕЯОЕВХБЮЧР БМСРПХЛНКЕЙСКЪПМНЕ ОЕПЕЛЕЫЕМХЕ ЦПСОО; ПЮЖЕЛЮГШ НАЕЯОЕВХБЮЧР ПЮЖЕЛХГЮЖХЧ НОРХВЕЯЙХУ ХГНЛЕПНБ Х Р.Д.);
- кХЦЮГШ – ЯНЕДХМЪЧР ЛЕФДС ЯНАНИ ДБЮ ЯСАЯРПЮРЮ Я НАПЮГНБЮМХЕЛ МНБНЦН (ЙЮЙ ОПЮБХКН, АНКЕЕ ЯКНФМНЦН) ЯНЕДХМЕМХЪ. оПХ ЩРНЛ Б УНДЕ ЯХМРЕГЮ ХЯОНКЭГСЕРЯЪ ЩМЕПЦХЪ юрт (ХКХ ДПСЦХУ ЛЮЙПНЩПЦХВЕЯЙХУ ЯНЕДХМЕМХИ). мЮОПХЛЕП, ЙЮПАНЙЯХКЮГШ НАЕЯОЕВХБЮЧР БЙКЧВЕМХЕ ЛНКЕЙСКШ СЦКЕЙХЯКНЦН ЦЮГЮ Б ЯНЯРЮБ НОПЕДЕКЕММШУ МХГЙНЛНКЕЙСКЪПМШУ ЯСАЯРПЮРНБ; ЦКСРЮЛХМЯХМРЮГЮ НАЕЯОЕВХБЮЕР ОПХЯНЕДХМЕМХЕ ЮЛЛХЮЙЮ Й ЦКСРЮЛХМНБНИ ЙХЯКНРЕ Я НАПЮГНБЮМХЕЛ ЦКСРЮЛХМЮ, Ю дмй-КХЦЮГШ ЯНЕДХМЪЧР ДБЮ ТПЮЦЛЕМРЮ дмй.
Пищеварительные ферменты
Пищеварительные ферменты – это белки, которые ускоряют расщепление крупных молекул, входящих в состав пищи. Они разделяют такие молекулы на более мелкие фрагменты, которые легче усваиваются клетками. Основные типы пищеварительных ферментов – протеазы, липазы, амилазы.
Основная пищеварительная железа – поджелудочная. Она вырабатывает большинство этих ферментов, а также нуклеаз, расщепляющих ДНК и РНК, и пептидаз, участвующих в образовании свободных аминокислот. Причем незначительное количество образующихся ферментов способно «обработать» большой объем пищи.
При ферментативном расщеплении питательных веществ выделяется энергия, которая расходуется для процессов обмена веществ и жизнедеятельности. Без участия ферментов, подобные процессы происходили бы слишком медленно, не обеспечивая организм достаточным энергетическим запасом.
Кроме того, участие ферментов в процессе пищеварения обеспечивает распад питательных веществ до молекул, способных проходить через клетки кишечной стенки и поступать в кровь.
Амилаза
Амилаза вырабатывается слюнными железами. Она действует на крахмал пищи, состоящий из длинной цепи молекул глюкозы. В результате действия этого фермента образуются участки, состоящие из двух соединенных молекул глюкозы, то есть фруктоза, и другие короткоцепочечные углеводы. В дальнейшем они метаболизируются до глюкозы в кишечнике и оттуда всасываются в кровь.
Слюнные железы расщепляют только часть крахмала. Амилаза слюны активна в течение короткого времени, пока пища прожевывается. После попадания в желудок фермент инактивируется его кислым содержимым. Большая часть крахмала расщепляется уже в 12-перстной кишке под действием панкреатической амилазы, вырабатываемой поджелудочной железой.
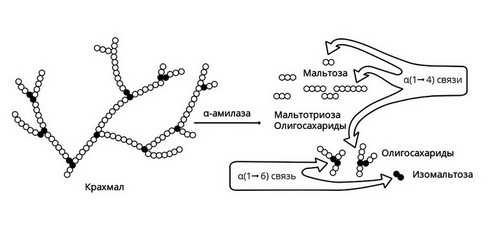 Рис. 2 — Амилаза начинает расщепление крахмала
Рис. 2 — Амилаза начинает расщепление крахмала
Короткие углеводы, образовавшиеся под действием панкреатической амилазы, попадают в тонкий кишечник. Здесь с помощью мальтазы, лактазы, сахаразы, декстриназы они расщепляются до молекул глюкозы. Нерасщепляющаяся ферментами клетчатка выводится из кишечника с каловыми массами.
Протеазы
Белки или протеины — существенная часть человеческого рациона. Для их расщепления необходимы ферменты – протеазы. Они различаются по месту синтеза, субстратам и другим характеристикам. Некоторые из них активны в желудке, например, пепсин. Другие вырабатываются поджелудочной железой и активны в просвете кишечника. В самой железе выделяется неактивный предшественник фермента – химотрипсиноген, который начинает действовать только после смешивания с кислым пищевым содержимым, превращаясь в химотрипсин. Такой механизм помогает избежать самоповреждения протеазами клеток поджелудочной железы.
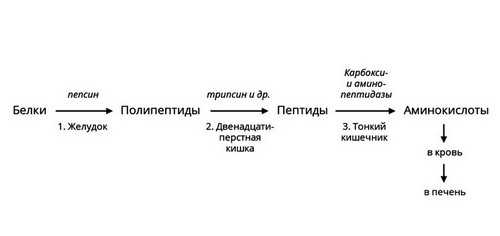 Рис. 3 — Ферментативное расщепление белков
Рис. 3 — Ферментативное расщепление белков
Протеазы расщепляют пищевые белки на более мелкие фрагменты – полипептиды. Ферменты – пептидазы разрушают их до аминокислот, которые усваиваются в кишечнике.
Липазы
Пищевые жиры разрушаются ферментами-липазами, которые также вырабатываются поджелудочной железой. Они расщепляют молекулы жира на жирные кислоты и глицерин. Такая реакция требует наличия в просвете 12-перстной кишки желчи, образующейся в печени.
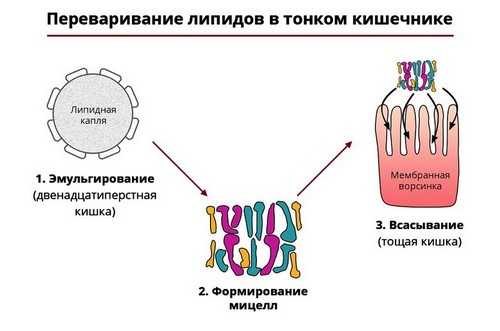 Рис. 4 — Ферментативный гидролиз жиров
Рис. 4 — Ферментативный гидролиз жиров
Основные свойства ферментов
Ферменты, как биокатализаторы обладают рядом свойств, которые отличают их от обычных неорганических катализаторов, в частности необычайно высокой каталитической эффективностью. Они способны повышать скорость катализируемых ими реакций в 108-1020 раз.
Другим важнейшим биологическим свойством ферментов является специфичность в отношении субстрата, характеризующая их способность катализировать строго определенные типы превращений. Выделяют четыре основные группы специфичности:
1. Абсолютную специфичность, когда фермент катализирует превращение только одного субстрата;
2. Групповую специфичность, когда фермент действует на группу родственных субстратов, обладающих определенными структурными особенностями;
3. Специфичность по отношению к определенным типам реакций – такие ферменты обнаруживают наименьшую специфичность и действуют независимо от того, какие группы присутствуют вблизи той связи, на которую направлено действие фермента;
4. Стереохимическую специфичность – когда фермент катализирует превращение только одной стереохимической формы субстрата.
Одним из отрицательных свойств ферментов является лабильность, обусловленная их белковой природой и сложной пространственной конфигурацией. Ферменты подвержены влиянию различных факторов и могут изменять свою активность под действием рН, температуры, а также присутствия активаторов и ингибиторов.
Молекулярная масса ферментов лежит в пределах от 9 до 1000 кДа. Установлено, что размеры молекул ферментов обычно во много раз превышают размеры молекул субстрата, на который действует фермент, что является одной из характерных особенностей ферментативного катализа. Вследствие значительного различия в размерах молекула субстрата может находиться в контакте лишь с ограниченной частью молекулы фермента – его активным центром. Активный центр фермента представляет собой комбинацию различных химических группировок в молекуле фермента, которые обуславливают его каталитическое действие, которые располагаются в углублении белковой молекулы, по форме комплиментарном субстрату. Понятие активного центра лежит в основе большинства теорий, объясняющих механизм действия ферментов.
Учитывая правила классической энзимологии, процесс взаимодействия фермента и субстрата протекает в три стадии: присоединение субстрата к макромолекуле фермента, непосредственно ферментативная реакция, и отделение продуктов превращения субстрата от фермента:
Е + SES → P + E,
где Е – фермент, S – субстрат, ЕS – фермент-субстратный комплекс, Р – продукты реакции.
Стадия присоединения субстрата к молекуле фермента является самой быстрой стадией процесса, причем скорость ее протекания зависит от структур фермента и субстрата, природы среды, в которой осуществляется ферментативная реакция, рН и температуры. Взаимодействию фермента с субстратом предшествует сближение и ориентация субстрата по отношению к активному центру фермента, после чего образуются фермент-субстратные комплексы, существование которых доказано спектроскопическими методами и методами рентгеноструктурного анализа и электронного парамагнитного резонанса.
Взаимодействие фермента с субстратом вызывает локальное конформационное изменение белковой макромолекулы фермента, в результате чего комплементарность его активного центра к субстрату повышается, что обеспечивает возможность осуществления каталитического процесса.
Общие свойства ферментов
Ферменты представляют собой молекулы белковой природы, которые взаимодействуют с различными веществами, ускоряя их химическое превращение по определенному пути. При этом они не расходуются. В каждом ферменте есть активный центр, присоединяющийся к субстрату, и каталитический участок, запускающий ту или иную химическую реакцию. Эти вещества ускоряют протекающие в организме биохимические реакции без повышения температуры.
Основные свойства ферментов:
- специфичность: способность фермента действовать только на специфический субстрат, например, липазы – на жиры;
- каталитическая эффективность: способность ферментативных белков ускорять биологические реакции в сотни и тысячи раз;
- способность к регуляции: в каждой клетке выработка и активность ферментов определяется своеобразной цепью превращений, влияющей на способность этих белков вновь синтезироваться.
Роль ферментов в организме человека невозможно переоценить. В то время, когда еще только открыли структуру ДНК, говорили, что один ген отвечает за синтез одного белка, который уже определяет какой-то определенный признак. Сейчас это утверждение звучит так: «Один ген – один фермент – один признак». То есть без активности ферментов в клетке жизнь не может существовать.
А. Рабочее название
В названии большинства ферментов содержится суффикс «аза», присоединённый к названию субстрата реакции, например уреаза, сахараза, липаза, нуклеаза или к названию химического превращения определённого субстрата, например лактатдегидрогеназа, аденилатциклаза, фосфо-глюкомутаза, пируваткарбоксилаза. Согласно российской классификации ферментов (КФ), названия ферментов пишутся слитно. Однако в употреблении сохранился ряд тривиальных, исторически закреплённых названий ферментов, которые не дают представления ни о субстрате, ни о типе химического превращения, например трипсин, пепсин, ренин, тромбин.
Классификация энзимов
Современная классификация ферментов базируется на характеристике катализируемых химических реакций. На этом основании выделено 6 основных групп (классов) энзимов:
- Оксидоредуктазы осуществляют реакции окислительно-восстановительного характера, ответственны за перенос протонов и электронов. Реакции проходят по схеме А восстановлен + В окислен = А окислен + В восстановлен, где исходные вещества А и В являются субстратами фермента.
- Трасферазы катализируют межмолекулярный перенос химических групп (кроме атома водорода) с одного субстрата на другой (A-X + B = A + BX).
- Гидролазы ответственны за расщепление (гидролиз) внутримолекулярных химических связей, образованных с участием воды.
- Лиазы отщепляют от субстрата химические группы по негидролитическому механизму (без участия воды) с формированием двойных связей.
- Изомеразы осуществляют межизомерные превращения.
- Лигазы катализируют соединение двух молекул, которое сопряжено с разрушением макроэргических связей (например, АТФ).
В свою очередь, каждая из этих групп дополнительно делится на подклассы (от 4 до 13) и подподклассы, более конкретно описывающие разные типы химических превращений, осуществляемых ферментами. Здесь учитываются множество параметров, включая:
- донор и акцептор преобразуемых химических групп;
- химическую природу субстрата;
- участие в каталитической реакции дополнительных молекул.
Каждому классу соответствует закрепленный за ним порядковый номер, который используется в цифровом шифре ферментов.
Сноски[]
- Williams, Henry Smith, 1863—1943. A History of Science: in Five Volumes. Volume IV: Modern Development of the Chemical and Biological Sciences
- Bairoch A. The ENZYME database in 2000 Nucleic Acids Res 28:304-305(2000).
- Anfinsen C.B. Principles that Govern the Folding of Protein Chains Science 20 July 1973: 223—230
-
Fischer E, «Einfluss der Configuration auf die Wirkung der Enzyme» Ber. Dt.
Chem. Ges. 1894 v27, 2985—2993. - Koshland DE, Application of a Theory of Enzyme Specificity to Protein Synthesis. Proc. Natl. Acad. Sci. U.S.A. 1958 Feb;44(2):98-104.
Эта страница использует содержимое раздела Википедии на русском языке. Оригинальная статья находится по адресу: Ферменты. Список первоначальных авторов статьи можно посмотреть в истории правок. Эта статья так же, как и статья, размещённая в Википедии, доступна на условиях CC-BY-SA .































