Дистилляция этанола / воды
Распространенным историческим примером азеотропной перегонки является ее использование для дегидратации смесей этанола и воды. Для этого смесь, близкую к азеотропной, направляют в последнюю колонну, где происходит азеотропная перегонка. Для этого конкретного процесса можно использовать несколько азеуловителей: бензол, пентан, циклогексан, гексан, гептан, изооктан, ацетон и диэтиловый эфир — все варианты в виде смеси. Из них наиболее широко используются бензол и циклогексан. Однако, поскольку было обнаружено, что бензол является канцерогенным соединением, его использование сократилось. Хотя в прошлом этот метод был стандартом для дегидратации этанола, он потерял популярность из-за связанных с ним высоких капитальных и энергетических затрат. Другой благоприятный и менее токсичный метод, чем использование бензола для разрушения азеотропа системы этанол-вода, заключается в использовании вместо него толуола.
Дина-Старк
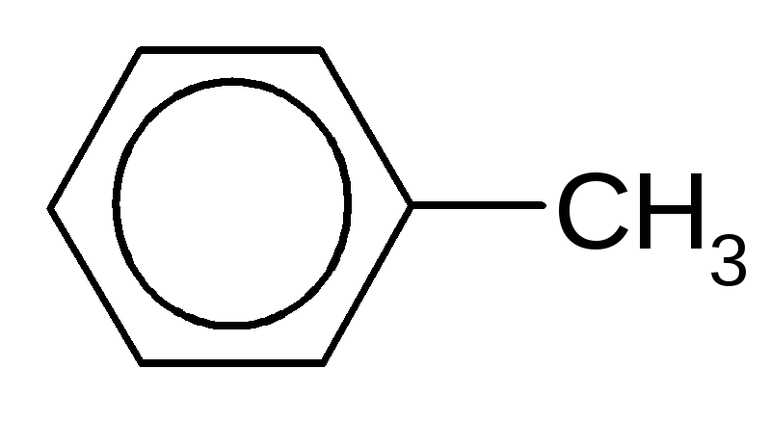
Структурные формулы метилбензола
Электронная плотность между атомами углерода, которые образуют ароматическое ядро, распределяется равномерно. Явление отражается в формуле бензола, толуола и других аренов знаком ароматичности (окружностью в кольце). Отмечается и наличие метильного радикала у одного из атомов углерода в ядре. Связи между всеми частицами показаны черточками. Структурная формула в таком случае отражает состав и основные черты строения молекулы вещества.
Упрощенная формула толуола — шестиугольник с кольцом внутри или черточками, обозначающими двойную связь. Метильная группа может находиться у любого из шести атомов ядра, они равноценны между собой. Недостаток такого способа изображения очевиден. Запись не дает представления о составе вещества и равноценности всех углерод-углеродных связей в кольце.
Область применения
- Разделение жидких смесей веществ, значительно различающихся по температуре кипения (более 60 °С, менее: см. фракционная перегонка, перегонка с водяным паром, перегонка в вакууме). Но с температурой до 200 °С (более 200 °С вещества разлагаются и следует применять перегонку под вакуумом). Пример: разделение смеси эфир (т. кип. 35 °С)/толуол (т. кип. 110 °С).
- Отделение жидкого вещества от нелетучих примесей (твердых компонентов). Пример: перегонка эфира (т. кип. 35 °С) над натрием (нелетуч).
- Наиболее часто простая перегонка используется для очистки продажных растворителей, температуры кипения основных химических растворителей можно посмотреть здесь.
Структурная основа
Состав базового продукта, состоящего лишь только из атомов углерода и водорода, демонстрирует формулу толуола. Между ним и бензолом есть однотипность, которая состоит в кольце из 6 углеродных атомов при гибридизации. В гомологах отличие от составляющих одного и того же соответствующего ряда есть.
Любая из составляющих формирует 3 сигма-связи с примыкающими частичками (2 атома углерода и 1 водорода). Отвесно кольцу есть только 1 система из негибридных P-орбиталей (единственная из 6 углеродных атомов). В итоге вещество получает свои свойства от пройденного цикла.
Уплотнённость между углеродными атомами, компонентами ядра, распределена пропорционально. Наружный вид отражается в бензольной формуле. Ключевая формула в этом случае отражает главные структурированные особенности молекулы. Метильная категория обладает возможностью быть в любом из 6 атомов ядра, они эквивалентны друг другу.
Толуол и безопасность. Как обращаться с продуктами, содержащими это вещество?
Физико-химические свойства толуола позволяют применять его во многих областях, однако следует помнить, что он является высокотоксичным веществом и опасен для здоровья. Воздействие толуола происходит в основном на стадии производства, а также в случае применения продуктов, содержащих это соединение
Особую осторожность следует соблюдать во время нанесения красок и лаков, а также применения чистящих средств
Толуол оказывает вредное воздействие на дыхательную, репродуктивную, кровеносную и нервную системы, а также на печень и почки. Особенно опасны вдыхание, проглатывание и прямой контакт с кожей, в этом случае возможно острое отравление. Люди, контактирующие с толуолом на производстве, например, при изготовлении красок, лаков или моющих средств, также подвержены риску хронического отравления.
В соответствии с действующим в Европейском Союзе регламентом CLP толуол классифицируется как легковоспламеняющийся (F) и вредный (Xn). Кроме того, согласно польскому закону о борьбе с наркоманией, он считается прекурсором наркотиков категории 3. Однако это не означает, что он как-то особо опасен — в эту категорию попадают вещества, обладающие незначительным потенциалом использования для производства наркотиков.
Бензол (C 6 H 6 )
Ароматический бензол отличается от бензола, используемого в автомобилях (бензин), который представляет собой смесь алифатических углеводородов (гептан и октан) и используется в качестве топлива. Хотя свойства и реакции бензола были изучены, определенной формулы бензола еще нет, что соответствует всем этим свойствам.
Определение структурной формулы бензола заняло несколько лет. Он вступает в реакцию путем добавления и замещения, длина связи между атомами углерода является промежуточной между длиной одинарной и двойной связи. много времени.
В 1931 году Кекуле предложил новую идею о связи между атомами углерода в молекуле бензола. Он сказал, что атомы углерода образуют кольцо, в котором происходит обмен одинарными и двойными связями, так что все связи между атомами углерода остаются одинаковыми по длине, образуя гексагональную правильную форму, в которой атомы углерода находятся под каждым углом.
Кекуле открыл гексагональную циклическую форму, в которой обмениваются одинарные и двойные связи. Кольцо указывает на то, что 6 электронов делокализованы на определенных атомах углерода, Арил-радикал (Ar) — это радикал, образующийся при удалении одного атома водорода из ароматического соединения (его символ является Ar). Когда мы удаляем атом водорода из бензола, образующийся радикал называется фенильным радикалом (C 6 H 5 -).
Циклоалканы
Циклоалканы представляют собой насыщенные циклические углеводороды, которые содержат три или более атомов углерода, которые можно найти в циклической структуре. Общая форма циклоалканов — (C n H 2n ), которая совпадает с молекулярной формулой алифатических алкенов , поэтому мы должны различать между им при написании их молекулярной формулы.
Номенклатура циклических алканов подобна открытой цепи алканов , но мы помещаем префикс цикнул в случае циклических алканов, общее число атомов = 3n, Насыщенный циклический углеводород , которые содержат шесть атомов углерода , вл етс циклогексан.
Углы между связями в циклопропане (C 3 H 6 ) равны 60 °, в то время как в циклобутане (C 4 H 8 ) они равны 90 °. Эти небольшие углы приводят к слабому перекрытию атомных орбиталей, поэтому комбинация атомов углерода очень слабый, поэтому они очень активны.
Циклопентан (C 5 H 10 ) и циклогексан (C 6 H 12 ) стабильны, потому что углы между связями около 109,5 °, поэтому перекрытие между атомными орбиталями становится более сильным, поэтому образуются сильные сигма-связи.
Циклопропан с воздухом образует чрезвычайно горючую смесь, в то время как нормальный пропан (линейный пропан) менее активен, циклопропан химически активен из-за малых углов между связями в циклопропане, которые приводят к перекрытию атомных орбиталей, следовательно, сочетание углерода атомы очень слабые, поэтому они очень активны.
Диэтиловый эфир
Диэтиловый эфир (C2H5)2O — бесцветная легкоподвижная летучая жидкость со своеобразным запахом; d20-4 = 0,7135; tкип = 35,6°С; n20-D = 1,3526. Чрезвычайно легко воспламеняется; пары образуют с воздухом взрывоопасные смеси. Пары тяжелее воздуха примерно в 2,6 раза и могут стелиться по поверхности рабочего стола. Поэтому необходимо следить за тем, чтобы поблизости (до 2-3 м) от места работы с эфиром все газовые горелки были потушены, а электроплитки с открытой спиралью отключены от сети.
При хранении диэтилового эфира под действием света и кислорода воздуха в нем образуются взрывчатые перекисные соединения и ацетальдегид. Перекисные соединения являются причиной чрезвычайно сильных взрывов, особенно при попытке перегнать эфир досуха. Поэтому при определении температуры кипения и нелетучего остатка эфир следует предварительно проверить на содержание перекисей. При наличии перекисей эти определения проводить нельзя.
Для обнаружения перекиси в диэтиловом эфире предложены многие реакции.
1. Реакция с йодидом калия KI. Несколько миллилитров эфира встряхивают с равным объемом 2% водного раствора KI, подкисленного 1-2 каплями HCl. Появление коричневого окрашивания указывает на присутствие перекисей.
2. Реакция с титанилсульфатом TiOSO4. Реактив готовят растворением 0,05 г TiOSO4 в 100 мл воды, подкисленной 5 мл разбавленной H2SO4 (1:5). При встряхивании 2-3 мл этого реактива с 5 мл испытуемого эфира, содержащего перекисные соединения, появляется желтая окраска.
3. Реакция с бихроматом натрия Na2Cr2O7. К 3 мл эфира прибавляют 2-3 мл 0,01% водного раствора Na2Cr2O7 и одну каплю разбавленной H2SO4 (1:5). Смесь сильно взбалтывают. Синяя окраска эфирного слоя указывает на присутствие перекисей.
4. Реакция с ферротиоцианатом Fe(SCN)2. Бесцветный раствор Fe(SCN)2 под действием капли жидкости, содержащей перекись, окрашивается в красный цвет вследствие образования ферритиоцианата (Fe2+ > Fe3+). Эта реакция позволяет обнаруживать перекиси в концентрации до 0,001% (масс.). Реактив готовят следующим образом: 9 г FeSO4-7H2O растворяют в 50 мл 18% НСl
К раствору в открытом сосуде добавляют гранулированный цинк и 5 г тиоцианата натрия NaSCN; после исчезновения красного окрашивания добавляют еще 12 г NaSCN, осторожно взбалтывают и раствор отделяют декантацией
Чтобы удалить перекиси, применяют сульфат железа (II). При взбалтывании 1 л эфира обычно берут 20 мл раствора, приготовленного из 30 г FeSO4-7H2O, 55 мл Н2O и 2 мл конц. H2SO4. После промывания эфир встряхивают с 0,5% раствором KMnO4 для окисления ацетальдегида в уксусную кислоту. Затем эфир промывают 5% раствором NaOH и водой, сушат 24 ч над CaCl2 (150-200 г CaCl2 на 1 л эфира). После этого отфильтровывают CaCl2 на большом складчатом бумажном фильтре и собирают эфир в склянку из темного стекла. Склянку плотно закрывают корковой пробкой со вставленной в нее изогнутой под острым углом хлоркальциевой трубкой, наполненной CaCl2 и тампонами из стеклянной ваты. Затем, открыв склянку, быстро вносят в эфир натриевую проволоку, из расчета 5 г на 1 л эфира.
Через 24 ч, когда перестанут выделяться пузырьки водорода, добавляют еще 3 г натриевой проволоки на 1 л эфира и спустя 12 ч эфир переливают в колбу для перегонки и перегоняют над натриевой проволокой. Приемник должен быть защищен хлоркальциевой трубкой с CaCl2. Дистиллят собирают в склянку из темного стекла, которую после внесения 1 г натриевой проволоки на 1 л эфира закрывают корковой пробкой с хлоркальциевой трубкой и хранят в холодном и темном месте.
Если поверхность проволоки сильно изменилась и при добавлении проволоки снова выделяются пузырьки водорода, то эфир следует профильтровать в другую склянку и добавить еще порцию натриевой проволоки.
Удобный и весьма эффективный способ очистки диэтилового эфира от перекисей и одновременно от влаги — пропускание эфира через колонку с активным Al2O3. Колонки высотой 60-80 см и диаметром 2-4 см, заполненной 82 г Al2O3, достаточно для очистки 700 мл эфира, содержащего значительное количество перекисных соединений. Отработанный Al2O3 легко регенерировать, если пропустить через колонку 50% подкисленный водный раствор FeSO4-7H2O, промыть водой, высушить и провести термическую активацию при 400-450 °С.
Абсолютный эфир — весьма гигроскопичная жидкость. О степени поглощения влаги эфиром при его хранении можно судить по посинению безводного белого порошка CuSO4 при внесении его в эфир (образуется окрашенный гидрат CuSO4-5H2O).
Внедрение толуола
Вещество имеет многочисленные коммерческие и промышленные применения и является растворителем в красках, лаках, разбавителях, клеях, корректирующей жидкости для снятия лака, а также используется в процессах печати и дубления кожи.

Толуол химического качества является весомым сырьём для органического синтеза, изготовления высокооктановых составляющих моторных топлив, приготовления взрывчатых веществ, медицинских препаратов, красителей и растворителей. Как ведомый компонент он входит в состав лаков. Толуол молекулярный обширно применяется в качестве начального вещества в органическом синтезе и гидрировании. Это значительный элемент при дегидрировании большого числа веществ.
Использование толуола:
- получение красителя, полимеризация;
- создание пятновыводителей, моющих веществ;
- создание тротила;
- изготовление клеев искусственного происхождения, чистящих на базе растворителя;
- разработка красок;
- продукты для ногтей;
- создание медпрепаратов;
- получение горючего.
Он сокращает микровязкость покрытий, применяется для лаков и красок. Его сочетания могут вступать в реакцию при многих производствах. Растворители присваивают краске особенную густоту, уничтожают твёрдые вещества (сухой лак). Метилбензол растворяет полимер.

Используется вещество в базовом синтезе, парфюмерии и косметологии, военной промышленности, топливной, врачебной, лакокрасочной индустрии. Метилбензол, изготовленный по ГОСТу, доступен для реализации и имеет возможность применяться в будничной жизни. Высочайшая токсичность у метилбензола, он является горючим материалом. Паровоздушная смесь взрывается под определённым воздействием. Изомер огнеопасен.
Структурная формула акцентирует представление о составе и текстуре. Есть информация о действии на организм человека. Было определено, что метилбензол токсичен и владеет канцерогенным воздействием. Улетучивания его быстро попадают на кожу, в органы дыхания, провоцируют изменения в нервной системе, недоброкачественность покрова, воспаление.
При вдыхании нефтяных паров у человека отмечается затормаживание, трепет, нарушается работа вестибулярного аппарата. При работе с толуолом, красками, растворителями надо всё делать в резиновых перчатках, хорошо проветривать здание. Метилбензол считается наркотическим веществом, вызывающим подневольность при злоупотреблении.
Иные побочные эффекты:
- нарушения у человека зрения;
- утрата слуха;
- высочайшее сосредоточение в крови порождает нарушение работы печени, почек;
- вдыхание паров увеличивает сонливость, способствует головной боли.
Оборудование
Типичный прибор для простой перегонки приведен на рисунке:
Круглодонная колба с исходным раствором. Жидкость должна занимать не более 2/3 объема колбы для предотвращения выброса кипящей жидкости в приемную колбу.
Лапка
Важно! Металлическая лапка НЕ должна соприкасаться со стеклом, для избежания растрескивания колбы при перегонке. Для этого между колбой и лапкой помещают резиновые прокладки.
Насадка Вюрца или 3-х ходовой переходник
Насадка Вюрца выбирается из варианта (А) для жидкостей с температурой кипения менее 120 °С и (Б) для жидкостей с температурой более 120 °С.
Термометр. Выбирается из необходимой температуры кипения жидкости и вставляется в насадку Вюрца таким образом, чтобы верхняя часть шарика ртути совпадала с нижней частью бокового отвода насадки. Термометр без шлифа может быть использован, если имеется соответствующая насадка.
Холодильник Либиха. Холодильник Либиха (1) используется для жидкостей с температурой кипения до 120 °С. Его длина тем больше, чем меньше температура кипения вещества. Подключают холодильник к воде таким образом, чтобы поток воды был направлен против движения паров. Для облегчения соединения внешнюю поверхность керном можно смочить водой. Для веществ с температурой кипения более 120 °С используется воздушный холодильник, либо перегонка проводится без холодильника. В редком случае можно использовать обратный холодильник (2).
Аллонж и приемные колбы. Аллонж выбирают исходя из следующих критериев: Простой аллонж (А) – для не воспламеняющихся, не гидроскопичных веществ, Важно! при этом используются приемные колбы без шлифа. Аллонж с боковым отводом (Б) – для легковоспламеняющихся веществ (к отводу подсоединяют шланг и направляют его в сливное отверстие, для удаления не сконденсировавшихся паров), для гидроскопичных веществ (к отводу подсоединяют шланг и направляют в склянки Дрекселя или Тищенко с концентрированной серной кислотой, чтобы избежать попадание в перегнанный дистиллят следов влаги, либо соединяют с хлор кальциевой трубкой). Аллонж-«паук» (B) применяют для смены фракций с определенной температурой кипения, отвод используют как и в случае аллонжа (Б).
Нагревающий элемент. Выбирают исходя из свойств перегоняемой смеси. Колбонагреватели и пламенные горелки – для негорючих жидкостей. Важно! Водяные бани (т. кип. вещества до 100 °С) – для ЛВЖ. Масляные бани (т. кип. вещества до 200 °С) – для более точной регулировке температуры в перегонной колбе. При этом температура бани на 20-30 °С больше температуры кипения жидкости.
Формула толуола: что такое толуол и как его получить?
Арены, к которым относится толуол, можно рассматривать как производные родоначальника и первого члена гомологического ряда — бензола. Общая формула соединений, которые относятся к этому классу,— CnH2n–6. В молекулах ароматических углеводородов содержится бензольное кольцо (цикл, ядро). Формула толуола C7H8 отражает принадлежность вещества к этой большой группе органических соединений. Многим толуол известен под другим названием — метилбензол. Вещество получило широкое распространение в промышленности, используется в качестве органического растворителя, пятновыводителя и для других целей.
Значимость в применении
Толуол производится в больших количествах на нефтезаводах или же в качестве второстепенного продукта на коксохимических предприятиях и имеет различную плотность, массу. Он считается важным сырьём для крупномасштабного органического синтеза, применяемого в фармацевтической индустрии.

Метилбензол не опасается света и выпускается буквально во всех формах растворителей, что применяются при работе с красками. При работе с материалом сосредоточение его паров в атмосфере не должно превышать показателей, определённых санитарно-гигиеническими общепринятыми стандартами.
Вещество воздействует на экологию, и это связано с выбросом его в атмосферу:
- при сжигании всевозможных видов горючего в находящейся вокруг среде;
- в действующих интенсивных вулканах;
- при лесных пожарах;
- при применении растворителей и красок.
Ядовитые качества толуола небезопасны для самочувствия человека, вследствие этого его надо использовать с предосторожностью.
Реакция окисления
Атомы водорода в молекулах могут быть реакцией замещения, что практически подготавливает арены. Метилбензол больше реактивен, чем бензол. Общее вещество характеризуется окислением. Горение связано с выделением углекислого газа и воды. С толуолом и калием метильная молярная категория в передней цепочке молекулы окисляется вплоть до алкилирования карбоновой кислоты.

В итоге взаимодействия с формулой толуола химические свойства могут меняться. Бромирование, которое проводят с катализаторами, выходит на галогенированное вещество. Нитрование бромтолуола осуществляется консистенцией, складывающейся из фиксированной серной и азотной кислот. Нитрогруппа толуола имеет возможность откликаться на орто- и параположение. Реакция идёт сообразно электрофильному замещению. При высочайшей температуре элемент может реагировать и бывает обнаружен взрывчатый бензойный тринитротолуол (ТНТ), который несет опасность.
ОБРАБОТКА РЕЗУЛЬТАТОВ
4.1. Наблюдаемую температуру приводят к нормальному давлению. Температуру при нормальном давлении 760 мм рт. ст. () в градусах Цельсия вычисляют по формуле
,
где — наблюдаемая температура, °С;
— поправка на барометрическое давление, вычисленная по п.4.2, °С;
— поправка на выступающий над пробкой столбик ртути термометра, вычисленная по п.4.3, °С;
— поправка к термометру по паспорту, °С.
При давлении ниже 760 мм рт. ст. поправку прибавляют, в противном случае — вычитают.
4.2. Наблюдаемое давление с учетом постоянных поправок к барометру приводят к температуре 0 °С, вычитая из показаний барометра:
2 мм рт. ст. — при температуре окружающей среды 13-20 °С;
3 мм рт. ст.- при температуре окружающей среды 21-28 °С;
4 мм рт. ст. — при температуре окружающей среды 29-35 °С.
Далее по таблице в зависимости от температуры кипения продукта находят поправку на давление, приведенное к 0 °С.
|
Барометрическое давление, мм рт. ст. |
Поправка, °С, для температур |
|||
|
80±10 °С |
110±10 °С |
140±15 °С |
160 °С и более |
|
|
700 |
2,63 |
2,87 |
3,04 |
3,16 |
|
701 |
2,59 |
2,82 |
2,99 |
3,11 |
|
702 |
2,54 |
2,77 |
2,94 |
3,05 |
|
703 |
2,50 |
2,72 |
2,88 |
3,00 |
|
704 |
2,45 |
2,67 |
2,82 |
2,95 |
|
705 |
2,41 |
2,63 |
2,76 |
2,89 |
|
706 |
2,37 |
2,58 |
2,72 |
2,84 |
|
707 |
2,32 |
2,53 |
2,67 |
2,79 |
|
708 |
2,28 |
2,48 |
2,62 |
2,74 |
|
709 |
2,23 |
2,43 |
2,57 |
2,68 |
|
710 |
2,19 |
2,38 |
2,51 |
2,62 |
|
711 |
2,14 |
2,33 |
2,46 |
2,56 |
|
712 |
2,09 |
2,29 |
2,46 |
2,51 |
|
713 |
2,06 |
2,24 |
2,36 |
2,46 |
|
714 |
2,01 |
2,19 |
2,31 |
2,40 |
|
715 |
1,97 |
2,14 |
2,26 |
2,35 |
|
716 |
1,92 |
2,09 |
2,21 |
2,30 |
|
717 |
1,88 |
2,04 |
2,15 |
2,25 |
|
718 |
1,83 |
1,99 |
2,10 |
2,19 |
|
719 |
1,79 |
1,94 |
2,05 |
2,14 |
|
720 |
1,75 |
1,90 |
2,00 |
2,09 |
|
721 |
1,70 |
1,85 |
1,95 |
2,04 |
|
722 |
1,66 |
1,80 |
1,90 |
1,98 |
|
723 |
1,61 |
1,75 |
1,85 |
1,93 |
|
724 |
1,57 |
1,70 |
1,80 |
1,88 |
|
725 |
1,52 |
1,65 |
1,75 |
1,82 |
|
726 |
1,48 |
1,61 |
1,69 |
1,77 |
|
727 |
1,43 |
1,56 |
1,64 |
1,72 |
|
728 |
1,39 |
1,51 |
1,59 |
1,66 |
|
729 |
1,35 |
1,46 |
1,54 |
1,66 |
|
730 |
1,30 |
1,42 |
1,49 |
1,56 |
|
731 |
1,26 |
1,37 |
1,44 |
1,51 |
|
732 |
1,21 |
1,32 |
1,39 |
1,43 |
|
733 |
1,17 |
1,27 |
1,34 |
1,40 |
|
734 |
1,13 |
1,22 |
1,29 |
1,35 |
|
735 |
1,08 |
1,18 |
1,24 |
1,30 |
|
736 |
1,04 |
1,13 |
1,19 |
1,24 |
|
737 |
0,99 |
1,08 |
1,14 |
1,19 |
|
738 |
0,95 |
1,03 |
1,09 |
1,14 |
|
739 |
0,91 |
0,99 |
1,04 |
1,09 |
|
740 |
0,86 |
0,94 |
0,99 |
1,04 |
|
741 |
0,82 |
0,89 |
0,94 |
0,98 |
|
742 |
0,78 |
0,95 |
0,89 |
0,93 |
|
743 |
0,73 |
0,80 |
0,84 |
0,88 |
|
744 |
0,69 |
0,75 |
0,79 |
0,83 |
|
745 |
0,65 |
0,70 |
0,74 |
0,78 |
|
746 |
0,60 |
0,66 |
0,69 |
0,72 |
|
747 |
0,56 |
0,61 |
0,64 |
0,67 |
|
748 |
0,52 |
0,56 |
0,59 |
0,62 |
|
749 |
0,47 |
0,52 |
0,54 |
0,57 |
|
750 |
0,43 |
0,47 |
0,49 |
0,52 |
|
751 |
0,39 |
0,42 |
0,44 |
0,47 |
|
752 |
0,34 |
0,38 |
0,38 |
0,41 |
|
753 |
0,30 |
0,33 |
0,34 |
0,36 |
|
754 |
0,26 |
0,28 |
0,29 |
0,31 |
|
755 |
0,21 |
0,23 |
0,24 |
0,26 |
|
756 |
0,17 |
0,19 |
0,19 |
0,21 |
|
757 |
0,13 |
0,14 |
0,14 |
0,16 |
|
758 |
0,08 |
0,09 |
0,09 |
0,11 |
|
759 |
0,04 |
0,05 |
0,05 |
0,06 |
|
760 |
0,00 |
0,00 |
0,00 |
0,00 |
|
761 |
-0,04 |
-0,04 |
-0,05 |
-0,05 |
|
762 |
-0,08 |
-0,09 |
-0,10 |
-0,11 |
|
763 |
-0,13 |
-0,14 |
-0,15 |
-0,16 |
|
764 |
-0,17 |
-0,18 |
-0,20 |
-0,21 |
|
765 |
-0,21 |
-0,23 |
-0,25 |
-0,26 |
|
766 |
-0,26 |
-0,27 |
-0,29 |
-0,30 |
|
767 |
-0,30 |
-0,32 |
-0,35 |
-0,36 |
|
768 |
-0,34 |
-0,37 |
-0,39 |
-0,40 |
|
769 |
-0,38 |
-0,41 |
-0,44 |
-0,45 |
|
770 |
-0,42 |
-0,45 |
-0,49 |
-0,50 |
|
771 |
-0,47 |
-0,51 |
-0,54 |
-0,57 |
|
772 |
-0,51 |
-0,55 |
-0,59 |
-0,62 |
|
773 |
-0,55 |
-0,60 |
-0,64 |
-0,67 |
|
774 |
-0,59 |
-0,64 |
-0,69 |
-0,73 |
|
775 |
-0,63 |
-0,69 |
-0,74 |
-0,78 |
|
776 |
-0,68 |
-0,73 |
-0,79 |
-0,83 |
|
777 |
-0,72 |
-0,78 |
-0,84 |
-0,88 |
|
778 |
-0,76 |
-0,83 |
-0,89 |
-0,93 |
|
779 |
-0,80 |
-0,87 |
-0,94 |
-0,99 |
|
780 |
-0,85 |
-0,92 |
-0,99 |
-1,04 |
(Измененная редакция, Изм. N 1)
4.3. Поправку на выступающий над пробкой столбик ртути термометра () в градусах Цельсия вычисляют по формуле
,
где 0,00016 — видимый коэффициент расширения ртути в стекле;
— высота столбика ртути, выступающего над пробкой, выраженная в градусах шкалы термометра;
— наблюдаемая температура, °С;
— температура окружающего воздуха вблизи середины столбика ртути, выступающего над пробкой, измеряется вторым термометром, °С.
4.4. За результат анализа принимают среднее арифметическое результатов двух параллельных определений, допускаемые расхождения между которыми не должны превышать (при доверительной вероятности Р=0,95):
по температуре 0,1 и 1 °С в зависимости от точности применяемого термометра;
по объему дистиллята 1 см.
(Измененная редакция, Изм. N 1, 2).
Текст документа сверен по:
Углеводороды ароматические
бензольного ряда. Методы анализа:
Сб. ГОСТов. — М.: Издательство стандартов, 1982
Редакция документа с учетомизменений и дополнений подготовлена





















