Химические свойства водорода
В простом веществе H2 связь между атомами прочная (энергия связи 436 кДж/моль), поэтому активность молекулярного водорода невелика. При обычных условиях он взаимодействует только с очень активными металлами, а единственным неметаллом, с которым водород вступает в реакцию, является фтор:
F2+H2=2HF (фтороводород)
С другими простыми (металлами и неметаллами) и сложными (оксидами, органическими неопределенными соединениями) веществами водород реагирует либо при облучении и повышении температуры, либо в присутствии катализатора.
Водород горит в кислороде с выделением значительного количества теплоты:
2H2+O2=2H2O
Смесь водорода с кислородом (2 объема водорода и 1 объем кислорода) при поджигании сильно взрывается и поэтому носит название гремучего газа. При работе с водородом следует соблюдать правила техники безопасности.
Рис. 3. Гремучий газ.
В присутствии катализаторов газ может реагировать с азотом:
3H2+N2=2NH3
– по этой реакции при повышенных температурах и давлении в промышленности получают аммиак.
В условиях высокой температуры водород способен реагировать с серой, селеном, теллуром. а при взаимодействии с щелочными и щелочноземельными металлами происходит образование гидридов:
2Li+2H2=2LiH
– в данном случае водород играет роль окислителя.
Водород имеет особенность при повышении температуры восстанавливать оксиды многих металлов, в результате чего образуется вода. Например:
CuO+H2=H2O+Cu
– в данном процессе водород является восстановителем
Что мы узнали?
Водород – самый распространенный элемент в космосе. В учебной статье рассматриваются химические свойства водорода и взаимодействие с металлами этого газа. В нормальных условиях он способен реагировать с очень малым количеством металлов и неметаллов, а при измененных условиях вступает в реакции с азотом, серой, селеном, щелочными металлами, а также способен восстанавливать оксиды.
-
/10
Вопрос 1 из 10
Водород: общая информация
При обычных условиях водород не имеет ни вкуса, ни запаха, ни цвета.
Рис. 1. Формула водорода.
Поскольку атом имеет один энергетический электронный уровень, на котором могут находиться максимум два электрона, то для устойчивого состояния атом может как принять один электрон (степень окисления -1), так и отдать отдать один электрон (степень окисления +1), проявляя постоянную валентность I. Именно поэтому символ элемента водорода помещают не только в IA группу (главную подгруппу I группы) вместе со щелочными металлами, но и в VIIA группу (главную подгруппу VII группы) вместе с галогенами. Атомам галогенов тоже не хватает одного электрона до заполнения внешнего уровня, и они, как и водород, являются неметаллами. Водород проявляет положительную степень окисления в соединениях, где он связан с более электроотрицательными элементами-неметаллами, а отрицательную степень окисления – в соединениях с металлами.
Рис. 2. Расположение водорода в периодической системе.
У водорода есть три изотопа, каждый из которых имеет собственное название: протий, дейтерий, тритий. Количество последнего на Земле ничтожно.
Свойства водорода, делающие его полезным для применения в антивозрастной медицине
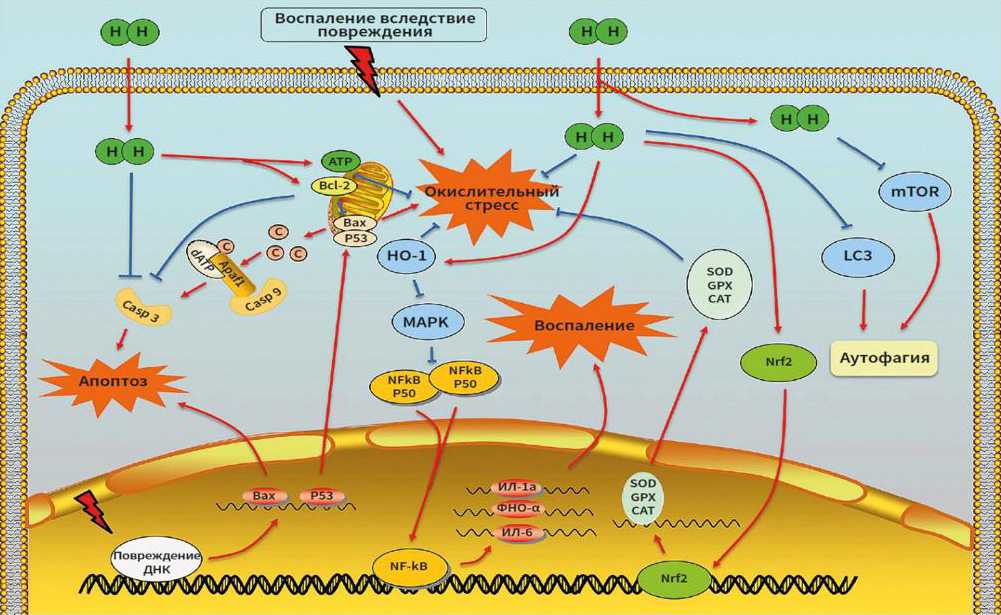
Применения H₂ в антивозрастной медицине связано с его антиоксидантными, противовоспалительными свойствами, а также со способностью модулировать процесс апоптоза.
Механизм антиоксидантного действия H₂ включает несколько звеньев.
- H₂ нейтрализует гидроксильный радикал (•OH). Гидроксид (OH–), также известный как гидроксильный ион или гидроксид-ион, не является свободным радикалом. Последовательное восстановление молекулярного кислорода приводит к образованию группы активных форм кислорода.
- H₂ обезвреживает пероксинитрит (ONOO–)).
- H₂ косвенно снижает выработку оксида азота (NO).
- H₂ ингибирует активность NADPH-оксидазы.
- H₂ снижает уровень митохондриальных активных форм кислорода (АФК).
- H₂ индуцирует экспрессию антиоксидантных генов и повышает активность антиоксидантных ферментов.
- H₂ снижает активность нейтрофилов.
Противовоспалительное действие H₂ обусловлено рядом эффектов.
- H₂ снижает высвобождение провоспалительных цитокинов, включая интерлейкин (ИЛ) 1β, ИЛ-6, фактор некроза опухоли альфа (ФНО-α), ядерный фактор каппа би (NF-κВ) и ядерный негистоновый белок (HMGB1).
- H₂ способствует поляризации макрофагов от провоспалительного типа M1 к противовоспалительному типу M2, который, в свою очередь, вырабатывает дополнительные противовоспалительные цитокины, такие как ИЛ-10 и трансформирующий фактор роста бета (TGF-β).
- H₂ уменьшает инфильтрацию тканей макрофагами и нейтрофилами.
- H₂ способен ингибировать несколько путей воспаления, таких как путь NF-κB, NLRP3 и TLR. NF-κB.
- За счет изменения межклеточной коммуникации воспаление вносит свой вклад в процесс старения. H₂ ингибирует хроническое воспаление, которое может способствовать воспалительному старению. Например, H₂ снижает экспрессию биомаркеров воспаления у пациентов с метаболическим синдромом и ослабляет воспалительный статус дыхательных путей у пациентов с астмой и хронической обструктивной болезнью легких (ХОБЛ), особенно ХОБЛ, вызванной табачным дымом. В головном мозге H₂ может подавлять нейровоспаление, вызванное различными патологическими состояниями — цереброваскулярными и нейродегенеративными заболеваниями, а также неонатальным повреждением мозга. Замедляет процесс воспаления и старения и предотвращает заболевания, связанные со старением.
Способы применения водорода в клинической практике
Разработаны различные способы введения H₂ в организм человека:
- ингаляция Н₂;
- вода, обогащенная Н₂;
- физиологический раствор, богатый Н₂,
- раствор для гемодиализа;
- местное применение (ванны, кремы) и другие методы.

Существуют несколько факторов, которые могут ограничить клиническое применение H₂. Например, H₂ считается небезопасным при концентрации 4%, которая является взрывоопасной и может оказывать цитотоксическое действие. При ингаляции Н₂ концентрация увеличивается медленнее по сравнению с другими способами введения.
Использование воды, насыщенной водородом, является самым простым, недорогим и безопасным методом. Водородная вода — это обычная питьевая H₂O, которая имеет в своем составе растворенный газообразный водород (H₂).
Биохимические свойства молекулярного водорода
Эндогенный H₂ вырабатывается кишечными бактериями как побочный продукт анаэробного метаболизма и является основным газовым маркером ферментации углеводов. Микроорганизмы производят H₂ в результате реакции газообмена воды с монооксидом углерода (CO): CO + H₂O → CO₂ + H₂.
Благодаря низкой молекулярной массе и отсутствию полярности H₂ может быстро проникать через клеточную мембрану и распространяться в цитоплазме, достигая ядра и других органелл. Более того, H₂ проходит через гематоэнцефалический барьер, хотя для большинства антиоксидантов это невозможно.

Поскольку H₂ привычен для организма, до сих пор не было зарегистрировано цитотоксических явлений. H₂ также не оказывает прямого воздействия на физиологические показатели, такие как температура тела, артериальное давление, водородный показатель (pH) или парциальное давление кислорода (pO₂).
Распространенность в природе
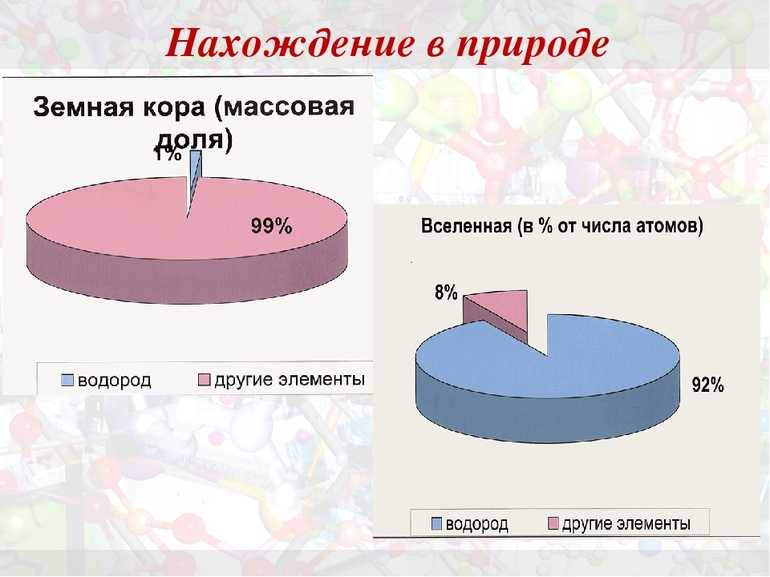
В настоящее время водород является самым распространенным элементом во Вселенной. На долю водорода приходится примерно 88,6 % всех атомов (около 11,3 % составляют атомы гелия, доля других вместе взятых элементов равна приблизительно 0,1 %). Водород представляет собой основную часть звезд и межзвездного газа.
В условиях звездных температур (к примеру, температура поверхности Солнца достигает 6000 °C) водород представлен в форме плазмы. Межзвездное пространство заполнено данным элементом в виде отдельных молекул, атомов и ионов. Вещество способно формировать молекулярные облака, которые существенно отличаются размерами, плотностью и температурой.
Массовая доля водорода в земной коре равна 1%. Данный факт позволяет водороду занимать десятое место по распространенности. Следует отметить, что значение элемента в природном мире определено не массой, а числом атомов, доля которых среди остальных элементов составляет 17% (второе место после кислорода, доля атомов которого равна примерно 52%). В связи с этим, роль водорода в химических процессах, которые протекают в жизни нашей планеты, велика и сравнима по значению с кислородом.
Почти весь водород на Земле представлен в виде соединений, что отличает элемент от кислорода, присутствующего на планете и в связанном, и в свободном состояниях. Атмосфера содержит лишь незначительное количество водорода в виде простого вещества (0,00005 % по объему для сухого воздуха). Водород является компонентом почти каждого органического вещества и включен в состав всех живых клеток, где, исходя из числа атомов, на элемент приходится около 63%.
Водородные таблетки — эффективный источник получения обогащенной водородом воды
Водород имеет низкий показатель растворимости (1,6 мг/л) и является нейтральным (рН 7,0) и неполярным веществом. Традиционный электрохимический способ насыщения воды водородом не позволяет получать концентрацию H₂ в воде выше 1,6 мг/л, следовательно, не будет достигнут максимально возможный антиоксидантный и противовоспалительный эффект водородной терапии.
Компания ООО Кит Мед представляет технологию приготовления воды, обогащенной H₂, Drink HRW, основанную на химической реакции взаимодействия воды и магния с образованием H₂:
Технология водородной терапии реализуется при помощи специализированной биологически активной добавки к пище Drink HRW Rejuvenation (HRW Natural Health Products Ink DBA Drink HRW@, США).
В результате растворения таблетки в питьевой воде образуется максимальное количество молекул водорода, концентрация которого достигает 8,0 мг/л. При этом молекулы H₂ не присоединяются к молекулам Н₂О, а временно растворяются и полностью улетучиваются в течение одного часа.
Помимо водорода, в воде образуется биологически усваиваемый магний, который необходим для организма человека. Водородные таблетки Drink HRW можно использовать как в домашних условиях, так и стационарах для снижения окислительных и воспалительных процессов, а также для профилактики заболеваний.
Разрешения FDA, WADA и Роспотребнадзора доказывают безопасность продукции.
Экспериментальные и клинические исследования выявили лечебно-профилактические эффекты водородной терапии в рамках лечения инфекционных и возраст-ассоциированных заболеваний.
По результатам сравнительного плацебо-контролируемого исследования прием внутрь препарата Rejuvenation Drink HRW привел к улучшению 18 из 20 маркеров метаболического статуса у 60 взрослых с метаболическим синдромом. В другом рандомизированном контролируемом исследовании водородная терапия при помощи таблеток Drink HRW позволила достичь ослабления симптомов жировой дистрофии печени, повышения на 11% чувствительности к инсулину и снижения на 10% уровня аспартатаминотрансферазы у пациентов с неалкогольной жировой болезнью печени. В рандомизированном контролируемом исследовании после курсового приема Rejuvenation Drink HRW зафиксировано улучшение деятельности кардио-респираторной системы (повышение максимального потребления кислорода), выносливости и общего количества выполненной работы у женщин. Доказано, что при назначении водородной терапии после агрессивных процедур период восстановления организма сократился до 30 %.
Образование — молекулярный водород
Образование молекулярного водорода из атомов водорода также рассматривается как побочная реакция.
|
Атомноводородная горелка. |
Образование молекулярного водорода особенно интенсивно происходит на поверхности металлов, оказывающих каталитическое действие на эту реакцию. Таким образом, если ввести в пламя атомного водорода металлическую пластинку, то ее поверхность быстро расплавится и образуется сварочная ванна.
Образование молекулярного водорода при фотолизе можно проиллюстрировать и на примере других молекул, причем молекула Н2 возникает из двух соседних атомов исходной молекулы.
К образованию молекулярного водорода приводят разные процессы, в том числе и биологические. Также активно осуществляется и потребление Н2, важная роль в этом принадлежит водородным бактериям. Нахождение в природе и возможность размножения этих бактерий определяются рядом факторов; основные из них — наличие Н2 и аэробные условия.
В реакторе II образование молекулярного водорода из экзогенных переносчиков электрона осуществляют бактериальные гидро-геназы. Авторы отмечают, что кроме катализаторов биологической природы можно использовать обычные катализаторы гидрирования-дегидрирования, например металлическую Pt. Наиболее перспективными они считают синтетические модели гидрогеназ.
|
Схема горелки для атомного водорода. |
Где используется реакция образования молекулярного водорода из атомного.
|
Зависимость выхо — стр. 185. да водорода при радиолйзе жидкого гексана от концентрации акцептора А — гексилметакрилата. |
Вопрос об истинном механизме образования молекулярного водорода по реакции 8 до настоящего времени остается — невыясненным.
Для того чтобы показать возможность образования молекулярного водорода, из протона и гидридоподвижного водорода, связанного с углеродом, Парнес, Калинкин и Курсанов провели реакцию между циклогептатриеном и трехбромистым бором с последующим действием воды.
Однако при радиолизе одной группы соединений происходит образование молекулярного водорода, а при радиолизе другой группы — нет. Этот факт требует объяснения. Мы исходили из простого соображения: отрывается легкая частица от тяжелой. Легкая и тяжелая частицы распределяют энергию между собой и основную долю энергии получает легкая частица.
Скорость первой стадии мала и тормозит в целом весь процесс образования молекулярного водорода из ионов водорода на границе электрод — раствор.
|
Эндотермическая хемосорбция при небольшой величине энергии активации процессов адсорбции и десорбции. |
Эта каталитическая реакция, по-видимому, играет большую роль в образовании молекулярного водорода из атомарного водорода в межзвездных газовых туманностях, где она происходит на поверхности космической пыли.
Как получают атомарный водород
При высокой температуре молекулы водорода диссоциируют на атомы:
Осуществить эту реакцию можно, например, накаливая током вольфрамовую проволочку в атмосфере сильно разреженного водорода.
Реакция обратима, и чем выше температура, тем сильнее равновесие сдвинуто вправо. При 2000° количество диссоциировавших молекул составляет еще только 0,1%, при 3000° — 9%, при 4000° — 62,5%, при 5000° — 94,7%, т. е. диссоциация является почти полной.
Атомарный водород получается также при действии тихого электрического разряда на обыкновенный водород, находящийся под давлением около 0,5 мм.
Образующиеся в этих условиях атомы водорода не сразу соединяются обратно в молекулы, что дает возможность изучить их химические свойства.
Атомарный водород уже при обыкновенной температуре восстанавливает многие окислы металлов, непосредственно соединяется с серой, азотом и фосфором; с кислородом он образует перекись водорода.
При разложении водорода на атомы поглощается большое количество тепла, составляющее 105 ккал на 1 граммолекулу:
H2 ⇄ 2Н — 105 ккал
Отсюда понятно, что атомы водорода должны быть гораздо активнее, чем его молекулы. Чтобы обыкновенный водород вступил в какую-либо реакцию.
Его молекулы должны сперва распасться на атомы, для чего необходимо затратить большое количество энергии. При реакциях же атомарного водорода такой затраты энергии не требуется.
Элемент с характеристикой «самый»
Если обратиться к периодической системе Д. И. Менделеева, можно заметить, что элемент, который имеет первый порядковый номер в ней, называется водородом. Как известно, положение в этой таблице способно полностью предсказать особенности химического поведения. Касательно водорода следует отметить его важную особенность — он не является типичным металлом или неметаллом. Этот элемент обладает промежуточным значением электроотрицательности, которое позволяет ему проявлять в реакциях с другими веществами как окислительные, так и восстановительные свойства.
Атомное строение
Водород — самый легкий самый маленький по размерам элемент. Он состоит из минимального набора протонов и электронов.
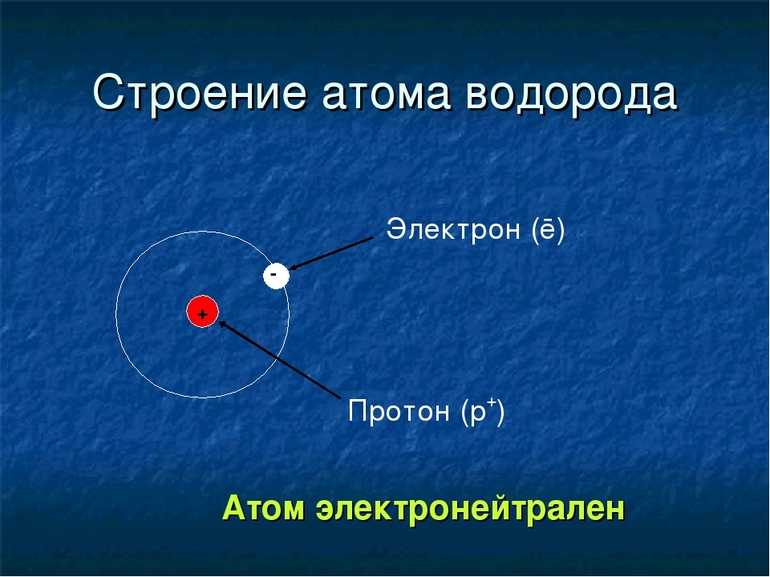
Всего одной положительно заряженной частицы (протон) и одной отрицательной (электрон) достаточно для формирования этого атома. Его атомная единица массы (а.е.м.) равна 1. Вокруг ядра-протона вращается всего один-единственный электрон, занимающий энергетический уровень 1s. Научное название этого элемента протий, хотя оно редко используется.
Простое атомное строение позволило Шредингеру в первой половине XX века точно решить уравнение квантовой механики для водорода, что обусловило сильный толчок для развития квантово-механических представлений о строении вещества.
Протий не является единственным водородом, хотя 99,98% всех его атомов относятся именно к этому изотопу. Существуют список некоторых других:
- Дейтерий H2. Он составляет 0,0184% всех водородных атомов и состоит из ядра, содержащего один протон и один нейтрон. Масса дейтерия приблизительно в 2 раза больше, чем протия, поэтому вода, образованная на его основе, называется тяжелой. Дейтерий —стабильный изотоп, который не претерпевает никаких радиоактивных распадов.
- Тритий H3. Это еще один водород, ядро которого содержит протон и 2 нейтрона. Он не является стабильным. В течение 12,33 лет ровно половина ядер трития испытывает бета-распад, который сопровождается излучением электронов и образованием катионов гелия.
- H4 и H7 — синтетически полученные сверхнестабильные изотопы водорода, содержащие больше 2 нейтронов в своих ядрах.
Распространение в природе
Водород — это самый распространенный элемент во Вселенной. По общим оценкам ученых, 75% всей массы вещества и 90% всех атомов образованы именно им. За пределами Земли в космических просторах он существует в следующих формах:
- В виде плазмы. Смесь протонов и несвязанных с ними электронов является типичным веществом, образующим звезды. Ядерные реакции между протонами приводят к образованию гелия и сопровождаются выделением огромного количества энергии в виде электромагнитного излучения в широком спектре длин волн. Эта плазма является практически идеальным проводником электричества.
- В атомарной форме. Атомы протия H1 являются очень активными с химической точки зрения. Тем не менее их можно встретить в чистом виде в холодном межзвездном пространстве.
- В молекулярной форме. Два атома H1 легко образуют молекулу H2. Эта реакция является энергетически выгодной. Образующийся при этом газ не имеет запаха и цвета. Является очень легким и взрывоопасным в присутствии кислорода. Молекул H2 в газообразной и жидкой форме присутствует в большом количестве на различных планетах. В Солнечной системе к ним относятся газовые гиганты Юпитер и Сатурн.
- В виде соединений. Например, с кислородом получается вода, с углеродом образуется целый ряд алканов, алкенов и алкинов. С элементами и их группами, обладающими большой электроотрицательностью, водород образует кислоты.

Достаточно вспомнить следующие вещества, чтобы убедиться в его распространенности и важности для протекания различных процессов, которые связаны с жизнедеятельностью:
- вода H2O;
- органические вещества — соединения водорода с углеродом (белки, углеводы, жиры);
- любые кислоты (HCl, HF, H2SO4, HNO3 и др.);
- гидриды металлов, которые могут действовать, как упрочняющие фазы в сплавах, а также как фактор, обуславливающий их охрупчивание.
Химические свойства
Элемент может взаимодействовать с большим количеством различных веществ благодаря своей двойственной природе. Чаще всего водород проявляет восстановительные свойства с неметаллами и окислительные с металлами.
Здесь необходимо пояснить. Если атом H присоединяет к себе лишний электрон, он восстанавливается, проявляя при этом свойства окислителя другого элемента, поэтому сама реакция будет окислительной. Наоборот, если атом H отдает электрон, сам он окисляется, восстанавливая при этом элемент, с которым вступает в химическую реакцию, поэтому она будет называться восстановительной.
Реакции восстановления
Самой известной из реакций восстановления с участием водорода является его горение в присутствии кислорода: 2*H2 + O2 = 2*H2O.
Эта реакция является экзотермической, сопровождается выделением большого количества теплоты. В настоящее время разрабатывают технологии, в которых ее можно будет использовать в качестве альтернативы традиционным видам топлива в двигателях внутреннего сгорания. Кислородное окисление водорода сопровождается возникновением неконтролируемого пламени, которое быстро устремляется вверх с образованием водяного пара. По этой причине в 1937 году взорвался наполненный газом дирижабль «Гинденбург».
Водород охотно вступает в реакцию с галогенами, например, с хлором и фтором он образует соответствующие сильные кислоты соляную и плавиковую:
- H2 + Cl2 = 2*HCl;
- H2 + F2 = 2*HF.
Окисление металлов
Атомы металлов, которые находятся в I-й и II-й группах таблицы Д. И. Менделеева на внешних энергетических уровнях содержат по одному или двум электронам, которые слабо связаны с ядрами. У атома H тоже 1 электрон на внешнем уровне, но из-за близости к атомному ядру он связан с ним сильнее, чем в атомах металлов, поэтому реакции водород-металл сопровождаются восстановлением первого и окислением последнего.
Ярким примером взаимодействия катиона водорода с металлом является реакция: Zn + 2H+ = Zn2+ + H2.

Здесь катионы H+ могут существовать, например, в кислотах. В результате реакции происходит их восстановление до молекулярного газообразного водорода.
Поскольку атомы H и молекулы H2 имеют маленькие геометрические размеры, они способны легко проникать в кристаллические структуры любых металлов. При определенных условиях (высокие температуры, наличие катализаторов) происходит взаимодействие металла с водородом, приводящее к образованию гидридов: Fe + 2*H2 = FeH4.
Таким образом, H является чрезвычайно активным элементом. Окислительные и восстановительные свойства водорода проявляются в зависимости от величины электроотрицательности вещества, с которым он вступает в химическую реакцию.
Сфера применения водорода
Водород обладает определенным набором физически и химических свойств. На основании данных характеристик вещество применяют в разных сферах:
- в качестве легкого газа водород смешивают с гелием и наполняют смесью аэростаты;
- кислородно-водородное пламя применяют с целью получения высоких температур в процессе сварки металлов;
- водород выполняет функцию восстановителя при синтезе металлов, в том числе, молибдена, вольфрама и других, из их оксидов;
- с помощью вещества получают аммиак и искусственное жидкое топливо;
- водород используют в реакции гидрогенизации для получения твердых жиров.
Водород не используют для очистки воды. Потребление водорода можно представить в виде таблицы:
Сферы применения водорода:
- Химическая промышленность. Примерно половина синтезированного водорода расходуется на производство аммиака, из которого изготавливают пластмассы, удобрения, взрывчатые вещества, а около 8% — на метанол, используемый в выпуске определенных типов пластмасс.
- Нефтеперерабатывающая промышленность. Водород способствует увеличению глубины переработки сырой нефти и улучшает качество конечных продуктов процессов гидрокрекинга и гидроочистки.
- Пищевая и косметическая промышленность. Водород используют в производстве саломаса, который представляет собой твердый жир, изготовленный на основе растительных масел. Материал является ключевым составным компонентом маргарина, косметических средств, мыла. Водород является пищевой добавкой, зарегистрированной под номером E949.
- Транспорт. Вещество применяют, как топливо для серийно выпускаемых автомобилей на Водородных топливных элементах.
- Лаборатории. Водород играет роль газа-носителя в газовой хроматографии.
- Авиационная промышленность. Ранее водородом заполняли дирижабли и воздушные шары. В настоящее время подобный способ не применяют из-за высокой опасности возгорания газа.
- Метеорология. Использование водорода в данной сфере заключается в заполнении газом оболочек метеозондов.
- Топливо. Водород является ракетным топливом. На практике, как правило, применяют смесь жидкой и твердой фаз вещества.
- Электроэнергетика. С помощью водорода охлаждают мощные электрические генераторы.
- Прочее. Атомарный водород применяют в процессе атомно-водородной сварки. Благодаря высокой теплопроводности, простое вещество Н2 активно используют для заполнения сфер гирокомпасов и стеклянных колб филаментных LED-лампочек.




























