Почему ацетокарминовый краситель используется в исследованиях митотических хромосом
Обычно ацетокармин представляет собой краситель, используемый для однократного окрашивания. Он окрашивает как ядро, так и цитоплазму. Чтобы окрашивать хромосомы, сохраняя при этом бесцветную цитоплазму, биологический образец необходимо сначала обработать формальдегидом, а затем его можно гидролизовать HCl при 60 ° C с правильным временем гидролиза. Наконец, его можно лечить ацетокармином. Ацетокармин образует крупные агрегаты красителя в слабокислой среде (pH 4-5). Демонстрация митоза корня лука путем окрашивания ацетокармином показана на рисунке 1.
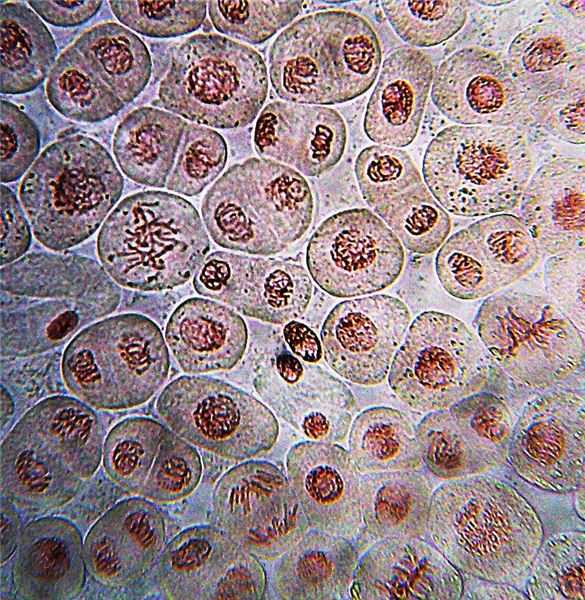
Рисунок 1: Митоз лукового корня
Однако ацетокармин слабо токсичен, чем другие окрашивающие нуклеиновые кислоты, такие как ацетоорсеин. Это также дешевле, чем другие виды пятен.
Заключение
Пятна используются в микроскопических исследованиях для усиления контраста определенных биологических компонентов в образце. Ацетокармин — это краситель, используемый для окрашивания нуклеиновой кислоты внутри клеток. Поскольку ацетокармин специфически окрашивает хромосомы помимо цитоплазмы, его можно использовать для визуализации хромосом в митотических исследованиях.
Ссылка:
1. «АЦЕТОКАРМИН ОЦЕНКА». Университет штата Канзас, доступен здесь. 2.J. A. Rattenbury (2009) Специфическое окрашивание ядерных веществ ацетокармином, технология окрашивания, доступно здесь.
Описание патента на изобретение SU1454309A1
4i
С
i Изобретение относи1 ся к цитоэмб- |риологии растений и может быть ис- :пользовано для оценки состояния женской генеративной сферы и форм размножения сорговых культур при интенсификации генетико-селекционных работ в научных учреждениях по селекции и генетике сорговых культур, а также в учебном процессе при изуче- |нии цитрэмбриологии растений.
Целью изобретения является повышение качества и выхода препаратов при упрощении способа. .
Способ осуществляется следующим образом,
j Завязи соргбвых культур фиксиру- т в ацетоалкоголе, отбывают водопроводной водой, протравливают желе- зоаммонийными квасцами в течение 5.- 20 мин, ополаскивают водопроводной водой, окрашивают ацетокармином 2 — 3 ч, отмывают водопроводной водой, после чего выделяют целостные заро- ршевые мешки. Все операции осущест- рляют при комнатной температуре, I Наилучшие результаты получают,когда фиксацию семяпочек сорговых куль- гур проводят ацетоалкоголем (1:3), состоящим из части ледяной уксусной кислоты на 3 части 96-градусного этилового спирта, отмывку после фиксации — в течение 20-40 мин в виде смывания без, выдержки, окрашивание — 2%-ным ацетокармином. Никаких специальных операций по мацерированию Межклеточных пластинок семяпочек для выделения зародьшевых мешков не про- одят. На предметное стекло в каплю 1воды после окрашивания ацетокармином помещают завязь и извлекают из Нее семяпочку при необходимом чении стереоскопического микроскопа. Из семяпочки вычленяадт зародьшевые Мешки тонкими вольфрамовыми электро.14543092
литически заточенными иглами, Выде- . ленные зародьтевые мешки можно оставить на этом же стекле, уГ5рав фильт- , ровапьной бумагой все лишние ткани, либо перенести их пипеткой с тонким капидпяром или иглами на другое предметное стекло, Яатем зародышевые мешки (можно по нескольку) помещают в
IQ каплю глицерина или глицерин-желати-, ны, накрывают покровньтм стеклом и препарат изучают под микроскопом,
С помощью полученных препаратов .изучают гаметофитогенез (развитие
15 зародьше,вого мешка), гаметогенез,
оплодотворение, ранние стадии эмбриогенеза, эндоспермогенеза, другие репродуктивные признаки женской генеративной сферы в связи с вопросами
20 гетерозисной, селекции, авто- и алло- полигшоидии, гаплоидии, андрогенеза, полиэмбрионии, апомиксиса для решения проблемы управляемого репродуктивного (полового) процесса у сорго25 вых культур.
Формула изобретения
Способ получения препаратов заро- 3Q дьшевьк мешков растений, включающий фиксацию завязей, протравливание, окрашивание, посдедовательньш отмывки в воде, выделение зародышевых мешков, отличающийся тем, что, с целью повышения качества и выхода препаратов при упрощении способа, фиксацию завязей проводят в фиксирующей смеси ацетоалкоголя,непосредственно после фиксации осуществляют протравливание в течение 5 — 20 мин железоаммонийными квасцами, затем проводят окращивание завязей ацетокармином в течение 2-3 ч при комнатной температуре, после чего д5 выделяют зародьшевые мешки.
35
40
Формула изобретения
Способ получения препаратов заро- дьшевьк мешков растений, включающий фиксацию завязей, протравливание, окрашивание, посдедовательньш отмывки в воде, выделение зародышевых мешков, отличающийся тем, что, с целью повышения качества и выхода препаратов при упрощении способа, фиксацию завязей проводят в фиксирующей смеси ацетоалкоголя,непосредственно после фиксации осуществляют протравливание в течение 5 — 20 мин железоаммонийными квасцами, затем проводят окращивание завязей ацетокармином в течение 2-3 ч при комнатной температуре, после чего выделяют зародьшевые мешки.
Обоснование методики оценки качества пыльцы в зависимости от условий внешней среды
Принято считать, что при изучении реакции растений на экзогенные воздействия наиболее приемлемыми и доступными являются методы определения качественных характеристик пыльцы: фертильности — окрашиванием пыльцевых зерен ацетокармином, акридиновым оранжевым, 2,3,5-трифенилтетразолием хлористым, раствором KJ; жизнеспособности — проращиванием пыльцы на искусственных питательных средах и др. (П. Диакону, 1962). Каждый из этих способов имеет преимущества и недостатки: так, окрашивание ацетокармином и KJ завышает результаты, поскольку неспособные к прорастанию зерна также окрашиваются. При окрашивании 2,3,5- хлористым трифенилтетразолием получают такие же результаты, что и при проращивании пыльцы на искусственных средах, но требования к со- блюдению температурного режима повышаются, проращивание пыльцы на средах метод «висячей капли» или проращивание на рыльцах пестиков трудоемки. Вероятно, суть происходящих явлений наиболее полно могла бы отразить система методов, дополняющих друг друга, но в доступной литературе мы таковой не обнаружили. Для определения жизнеспособности пыльцы томата мы использовали метод окрашивания ацетокармином, основываясь на успешных результатах исследований, выполненных на ООС МСХА под руководством Г.И. Тараканова (с сотрудниками 1978). Однако ранее в исследованиях П. Диакону (1962)было установлено, что при окрашивании 2,3,5-трифенилтетразолием хлористым можно выявить даже незначительные различия. Аналогичные результаты получены в исследованиях Г.И. Тараканова и Е.Н.Андреевой (1981). Как отмечено выше, метод качественного тестирования пыльцы широко применяется исследователями во Франции (J. Philouze, В. Maisonneuve, 1978), которые утверждают, что при действии пониженных температур на растение томата(іп vitro) определение качества пыльцы окрашиванием в растворе ацетокармина может служить тестом реакции сорта.
Опираясь на эти знания, мы изучали фертильность пыльцы — методом окрашивания аце- токармином, с последующим подсчетом количества окрашенных пыльцевых зерен под микроскопом МБИ-3. Выборка около 500 зерен на вариант. Вычисление эффектов комбинационной способности проводили по 1-му экспериментальному методу В.К. Савченко (В.К. Савченко, 1966)и модификации модели, позволяющих находить эффекты общей комбинационной способности (ОКС) относительно средней популяционной опыта (И.П. Го-товцева, 1976) и родительских линий. При обработке экспериментального материала использовали традиционные статистические методы (Б.А Доспехов, 1985; Г.Н.Зайцев, 1968; А.В Смиря-ев, М.В Гохман, 1985). Чтобы повысить надежность оценок форм и образцов рассчитывали доверительные интервалы, критерий существенности. Оценку генотипов осуществляли в типичных условиях защищенного грунта. Опыты проводили в зимне-весеннем обороте в остекленных ангар ных и блочных обогреваемых теплицах. Семена высевали 12-20 декабря (в зависимости от года). Массовые всходы появлялись на 5-7 день. Во время появления первого настоящего листа сеянцы пикировали в торфяную смесь следующего состава:50 % верховой торф, 50 % низинный торф. К смеси объемом 1 м. куб. добавляли доломитовую муку из расчета 6-8 кг/м , что позволяло довести рН до 5,8-6,З.Из минеральных удобрений использовали аммиачную селитру (0,2 кг),калийную селитру (1 кг),двойной обесфторен- ный суперфосфат (1,5-2,0 кг), сернокислый магний — 0,2-0,3 кг/м3 Мик роудобрения включали сернокислую медь (Зг),молибденово-кислый аммо- ний (6 г),сернокислый марганец- Иг, сернокислый цинк (Зг), борную кислоту -Зг,азотнокислое серебро (3 г) наї м смеси. Режим электродосве-чивания растений контрольного варианта был таким же как при выращивании рассады для производственных посадок. Растения второго и третьего вариантов, с периода появления всходов-до пикировки и после нее в течение трех дней (фаза появления 1-го настоящего листа) дополнительно освещали лампами ДРЛФ-400 по 12ч в сутки. В дальнейшем растения выращивали без освещения
Что такое Ацетокармин
Кармин — это основной краситель, получаемый из насекомого, известного как Coccus cacti. Ацетокармин получают путем смешивания кармина с ледяной уксусной кислотой. Это ДНК-специфическая окраска, используемая для визуализации суперспиральных хромосом на разных стадиях митоза.
Приготовление красителя ацетокармином
- Растворите 10 г кармина в 1 л 45% ледяной уксусной кислоты.
- Добавить алюминиевые гранулы и кипятить с обратным холодильником в течение 24 часов.
- Фильтровать в темные бутылки и хранить при 4 ° C.
- Окрашивание можно усилить добавлением хлорида железа (добавить 5 мл 10% раствора хлорида железа на 100 мл% ацетокармина).
Литература
1. ButterR.S., Lettington A.H. // J. Chem. Vap. Deposit. 1995. V. 3. P. 182.
2. Shvedova A.A., Kisin E.R. et al. // Ibidem. 2004. V. A67. P. 87.
3. Thomson L.A., Law F.C., Rushton N., Franks J. // Biomatter. 1991.
V. 12. P. 37-42.
4. Tran C.L., Donaldson K. et. al. // J. Toxicol. Environ. Health. 2003.
V. A66. P. 1909.
5. Постановление Главного государственного санитарного врача РФ от 31.10.2007 г. № 79 «Об утверждении Концепции токсикологических исследований, методологии оценки риска, методов идентификации и количественного определения наноматериалов» г. Москва. Доступ из справочно-правовой системы «Гарант».
6. Фостер Л. Нанотехнологии. Наука, инновации, возможности. Москва: Техносфера, 2008. 352 с.
7. Лысцов В.Н., Мурзин Н.В. Проблемы безопасности нанотехнологий. М.: МИФИ, 2007.
8. Батыгина Т.Б. Хлебное зерно. Л.: Наука, 1987. 103 с.
9. Жуков О.С., Колотева Н.И. Качество пыльцы сеянцев косточковых пород, полученных от гибридизации с использованием гиббе-реллина // Труды центральной генетической лаборатории им. Мичурина. Мичуринск, 1972. Т. 13. С. 14-21.
10. Рассветаева Э.Г. Характеристика особенностей пыльцевой фертильности косточковых // Цитолого-эмбриологические и генетикобиохимические основы опыления и оплодотворения растений. Матер. Всесоюз. совещания. Киев, 1982. С. 117-119.
11. Туровцева Н.М., Курсаков Г.А. Жизнеспособность пыльцы у отдаленных гибридов сортов и видов сливы // Бюл. науч. инф. Всерос. научн. -иссл. ин-та генет. и селекции плодовых раст. им. Мичурина. Мичуринск, 1995. Вып. 52. С. 24-30.
12. Волошина А.А. Морфогенез цветковых почек черешни и вишни и роль температурного фактора в их развитии в условиях Крыма // Вопросы опыления и оплодотворения плодовых деревьев: тр. гос. Никитского бот. сада. Т. XLV. Вып. IV. Харьков, 1970. С. 19-35.
13. Назарова М.Н., Истомина Е.А. Влияние температурных условий формирования пыльцы вишни войлочной на ее фертильность и частоту выхода геномных мутаций // Селекционно-генетические проблемы развития садоводства в средней полосе европейской части России. Мичуринск, 1995. С. 134-136.
14. Цвелев Н.Н. Определитель сосудистых растений Северо-Западной России (Ленинградская, Псковская и Новгородская области). СПб., 2000. С. 460-461.
15. Камелина О.П. Пыльник: строение, функции и разнообразие (Anther: structure, functions and diversity) // Матер. I Междунар. школы для молодых ученых. СПб., 2005. С. 40.
16. Романова Н.П., Шелаботин Г.П., Леонченко В.Г. и др. Методические рекомендации по применению цитологических методов в плодоводстве. М., 1988. 52 с.
БЛАГОДАРНОСТИ: Работа выполнена в рамках госконтрактов № П 208 от 23.04.2010 г. и № 16.740.11.0194 от 24.09.2010 г.
Поступила в редакцию 7 февраля 2011 г.
Yandovka L.F., Gusev A.A., Tkachyov A.G. INFLUENCE OF CARBONIC NANOSTRUCTURAL MATERIAL ON FERTILE OF POLLEN OF HIGH CERASUS PLANTS
The fertility of pollen grains in Cerasus fruticosa, C. vulgaris, C. avium, Microcerasus tomentosa and Amygdalus nana after a single treatment of the colloidal aqueous solution of carbon nanomaterial “Taunit” different concentrations during micro-porogenesis is studied. In most cases, pollen fertility after exposure to carbon nanomaterial “Taunit” decreases. Variations of concentration “Taunit”, after which there is a significant decrease in the percentage of morphologically formed pollen from different species.
Слайд 35Гипотеза доминирования основана на том, что большинство рецессивных генов отрицательно влияет
на организм, поэтому накопление у гетерозиготных особей большего числа доминантных
генов положительно влияет на жизнеспособность и продуктивность. Авторы ее С.В. Davenport и А.В. Вrисе. F.Кееblе и С.Реllеw дополнили эти представления положением о том, что благодаря ди- и поли гибридному скрещиванию у гибридов накапливается больше доминантных генов, чем их было у родителей, а значит подавляется большее число рецессивных генов, следствием чего и является гетерозис.Однако гипотеза доминирования не в силах объяснить разницу при реципрокных скрещиваниях и скрещиваниях аутбредных популяций, а также причину невозможность закрепления гетерозиса в ряду поколений.

Слайд 15картофель (Solanum) 12, 24, 36, 48, 60, 72, 96, 108,
144щавель (Rumex) 20, 40, 60, 80, 100, 120, 200пырей (Agropyrum)
14, 28, 42, 56, 70овсяница (Festuca) 14, 28, 42, 56, 70роза (Rosa) 14, 21, 28, 35, 42, 56овес (Avena) 14, 28, 42пшеница (Triticum) 14, 28, 42,свекла (Beta) 18, 36, 54малина (Rubus) 14, 21, 28костер (Bromus) 14, 28, 42, 56, 70слива (Primus) 16, 32, 48земляника (Fragaria) 14, 28, 42, 56
Полиплоидные ряды культурных растений
Исходным набором хромосом любого полиплоидного ряда является гаплоидное число, иначе называемое основным числом и обозначаемое буквой х.
Плоды октоплоидной (8х) и диплоидной (2х) земляники
Совокупность генов гаплоидного набора хромосом называется геномом

Особенности сортов с индетерминантным типом роста
Индетерминантные (sp+) сорта томата характеризуются неограниченным непрерывным ростом главного и боковых побегов, заложением соцветий через 3-5 листьев, и, как следствие, растянутым периодом плодоношения. Такой тип роста наиболее часто встречается у среднеспелых и позднеспе лых образцов томата (И.Т. Папонова, 1963, 1968; И.В. Полумордвинова, 1963; Г.И. Тараканов, 1961; Г.И. Тараканов, Н.В. Борисов, В.В. Климов, 1982). Темп роста стебля — признак определяющий сортовые особенности — у ин- детерминантных сортов среднесуточный прирост выше, чем у детерминант- ных. (Г.В. Боос, 1967; 1968).Поэтому перед селекционерами нередко стоит важная задача выведения сортов с меньшими темпами прироста, иначе в ус- ловиях производства много затрат уходит на подвязку, прищипку и удаление нижних листьев (А.Г. Авакян, 1975; И. Храпалова, 1989;). Поскольку томат обладает ремонтантностью, ряд исследователей успешно используют этот признак в селекции. Установлено, что ремонтантность, отдача урожая и общая продуктивность тесно сопряжены (С.Ф. Гавриш, Е.А. Сысина, 1980). Чем слабее способность растения постоянно возобновлять свой рост, тем раньше и дружнее наблюдается отдача урожая и тем меньше общая продуктивность томата (А.Г. Авакян, Г.Г. Асланян, С.А. Казарян, 1978). К группе биологических признаков относят особенности роста и развития растений (продолжительность вегетационного периода, реакция на определенную продолжительность светлого времени суток, однолетний или многолетний образ жизни и др.) (И.А. Прохоров, А.В. Крючков, В.А. Комиссаров, 1997).
По публикациям большинства авторов скороспелость является сложным признаком. Она сопряжена с детерминантностью и короткими этапами органогенеза (А.В. Алпатьев,1976; Е.Я. Глущенко, И.Б. Гаранько, Э.А. Власова 1982). На сегодня четко выделены признаки, определяющие скороспелость и используемые в селекции: высота заложения первого соцветия, расположение последующих соцветий на растении, скорость развития последующих соцветий, скорость прохождения плодами стадии зрелости (А.Н. Ипатьев, 1958). Отношение к данному признаку у исследователей не одинаково и менялось со временем. В классических работах данный признак выступал одним из основных при селекции на скороспелость (Ш. Г. Бексеев, 1971; Г.И. Тараканов, 1961). Было принято, что чем меньше количество листьев до первого соцветия, тем будущий сорт ценнее. В настоящее время считают, что при ранних посадках в зимне-весеннем обороте количество листьев должно быть не менее 10-11. В этом случае более вероятно, что первое соцветие не будет редуцируемым, а энергия плодообразования будет выше. Установлено, что скороспелые сорта обладают слабой облиственностью, отличаются тонкой листовой пластинкой, коротким черешком листа, простым неветвящимся соцветием, 6-5 лепестковым цветком, богатым фертильной пыльцой (А.В. Алпатьев, А.С. Агапов, 1985).В рассадный период скороспелые сорта томата быстрее формируют листовую поверхность, коэффициент корреляции между листовой поверхностью в этот период и ранним урожаем составляет +0,95 (Э.Н. Алехина, 1975). Понижение продуктивности растений с повышением скороспелости является общей биологической закономерностью (Ш.Г. Бексеев, 1968; Б.А.Рубин, 1962, 1970). Однако для растений томата не редки исключения. Так показано, что продуктивность и средняя масса плода слабо (коэффициент корреляции 0,12-0,19) связаны со скороспелостью, что позволило создать скороспелые сорта с высокой продуктивностью и средними и крупными плода-ми(В.Р. Гюнтер, 1980; В. Кравченко, 1979).Более того, некоторые авторы (В. Кравченко, 1979; ) показали, что скороспелость слабо связана с количеством плодов на втором соцветии ( г=0,32), количеством соцветий на главном стебле (г=0,29).
МАТЕРИАЛЫ И МЕТОДЫ
Объектами исследования были растения видов Ribes L. из коллекции открытого грунта Ботанического сада Петра Великого Ботанического
института им. В.Л. Комарова РАН (Ribes sachalinense (F. Schmidt) Nakai, R. sanguineum Purch., R. rubrum L., R. mandschuricum (Maxim.) Kom., R. spicatum E. Robson, R. saxatile Pall., R. aureum Pursh., R. alpinum L., R. nigrum L.). Их характеристика приводится в статье Г.А. Фирсова и Л.Ф. Яндовка (Firsov, Yandovka,
2018). Использовались также виды, произрастающие в питомнике Всероссийского института
генетических ресурсов растений им. Н.И. Вавилова: Ribes dikuscha Fisch. ex Turcz., R. hudsonianum Rich., R. nigrum ssp. europeum Zanez, R. nigrum ssp. sibiricum (Wolf.), R. pauciflorum Turcz. ex Pojark., R. usuriense Jancz ex M. Vilm.
Все исследуемые растения – многолетние листопадные кустарники, стелющиеся или крупные
прямостоячие. Цветки обоеполые (у Ribes alpinum раздельнополые цветки), собраны в кистевидные соцветия.
Слайд 14АвтополиплоидияАвтополиплоиды, как правило, имеют увеличенные размеры ядер и клеток, что
ведет к увеличению размеров листьев, устьиц, пыльцевых зерен и т.п.,
к физиологическим особенностям автополиплоидов следует отнести:замедление клеточного деления;увеличение длины вегетационного периода;снижение осмотического клеточного давления;снижение устойчивости к абиотическим факторам среды;снижение плодовитости из-за нарушений мейоза (образование мультивалентов и унивалентов, возникновение несбалансированных стерильных гамет);
Листья диплоидного (в,г) и тетраплоидного (е,ж) клевера красного
Замыкающие клетки устьиц,
число хлоропластов в них
у диплоидной (а) и тетраплоидной (б)
сахарной свеклы
Габитус диплоидной (а) и тетраплоидной гречихи (б)

Слайд 7Генные мутацииГен – отрезок ДНК, который состоит из определенного числа
пар нуклеотидов, кодирующий синтез полипептида.Изменение первичной структуры ДНК ведет к
изменению синтеза белков, то есть, к мутации.Различают 2 типа генных мутаций:точковые мутации;мутации сдвига рамки считывания;Точковые мутации – замена той или иной пары азотистых оснований:транзиции (один пиримидин заменяется на другой или один пурин заменяется на другой), например, А-Т меняется на Г-Ц или Г-Ц меняется на А-Т;трансверсии (пиримидин меняется на пурин или наоборот), например, А-Т меняется на Т-А или Ц-Г на Г-Ц;Мутации сдвига рамки считывания – под воздействием акридиновых соединений спиральная структура ДНК деформируется, в результате чего при репликации происходит выпадение или вставка дополнительных пар оснований
Классификация мутаций

Ацетокармин
Ацетокармин широко применяется для окраски хромосом. В делящихся клетках хромосомы обычно увеличиваются и хорошо видны в микроскоп.
Заменяют ацетокармин на просветляющую и консервирующую жидкость1 Смита. Для этого с одной стороны покровного стекла наносят каплю раствора Смита, а с другой кладут фильтровальную бумагу.
Раствор ацетокармина готовят следующим образом: 100 мл 45 % — ной уксусной кислоты и 4 г кармина кипятят 3 — 4 часа в колбе с обратным холодильником, охлаждают, дают отстояться в течение суток и фильтруют.
Окрашивают ацетокармином или по Фельгену.
Обычно применение ацетокармина дает возможность получать четко окрашенные хромосомы на фоне слабо окрашенной цитоплазмы. В том случае, если хромосомы красятся плохо, применяют протравливание в железо-аммонийных квасцах, в результате чего достигается достаточная степень контрастности в окрашивании хромосом и цитоплазмы. Для этого объект перед окрашиванием помещают на 5 — 10 минут в 2 — 4 % — ный водный раствор железоаммонийных квасцов, промывают и окрашивают, как описано выше.
Благодаря тому что ацетокармин обладает не только окрашивающими, но и фиксирующими свойствами, при анализе пыльников указанным способом нередко можно получить препараты с хорошими картинами мейоза.
Стерильные пыльцевые зерна с реактивом-1 ( ацетокармин) будут белого цвета, а фертильные — красного. Наличие крахмала в пыльце: синяя окраска с реактивом-2 свидетельствует о жизнеспособности пыльцы.
Листочек раздавливают на предметном стекле в капле ацетокармина, накрывают покровным стеклом и нагревают на пламени до 50 — 60 С в течение 15 — 20 секунд.
Петри; 5) термостат; 6) ацетокармин ( реактив — Г); 7) йод в йодистом калии ( реактив-2); ![]() агар; 9) 15 % — ный раствор сахарозы; 10) пыльца различных растений, собранная в зоне сильного загрязнения воздуха и контроль — в чистой зоне.
агар; 9) 15 % — ный раствор сахарозы; 10) пыльца различных растений, собранная в зоне сильного загрязнения воздуха и контроль — в чистой зоне.
Анализ ана-телофаз производится в препаратах костного мозга, окрашенных ацетокармином. На каждый срок исследования должен браться материал не менее чем от 6 животных. С целью получения убедительных данных в материале от каждого животного должно быть просмотрено не менее 300 — 400 ана-телофаз. Для количественной оценки влияния химических соединений подсчитывается процент хромосомных перестроек и митотический индекс ( процент делящихся клеток на 1000 клеток костного мозга); статистическая обработка полученных данных проводится по методу малых выборок для оценки различий по тесту t Стъюдента.
Анализ ана-телофаз производится в препаратах костного мозга, окрашенных ацетокармином. На каждый срок исследования должен браться материал не менее чем от 6 животных. С целью получения убедительных данных в материале от каждого животного должно быть просмотрено не менее 300 — 400 ана-телофаз. Для количественной оценки влияния химических соединений подсчитывается процент хромосомных перестроек и митотический индекс ( процент делящихся клеток на 1000 клеток костного мозга); статистическая обработка полученных данных проводится по методу малых выборок для оценки различий по тесту t Стъюдента.
В некоторых случаях окрашивание материала осуществляют при раздавливании пыльника в ацетокармине. Для этого зафиксированный пыльник помещают на предметное стекло в каплю ацетокармина и дальше поступают так, как описано выше при окрашивании свежих пыльников.
Обычно используют 2 — 4 % — ный раствор кармина в 45 % — ной уксусной кислоте ( ацетокармин), который одновременно фиксирует клетки и окрашивает в них ядра.
Берут серию бутонов, начиная от самых маленьких, и последовательно анализируют состояние пыльников, пока не будет обнаружена нужная стадия. Пыльник помещают на предметное стекло в каплю ацетокармина и быстро выдавливают его содержимое скальпелем или стеклянной палочкой.
Собранная пыльца хранится в холодильнике в малой стеклянной таре ( бюксы, пробирки) до анализа
Затем ее помещают на предметное стекло в каплю ацетокармина, накрывают покровным стеклом и осторожно несколько раз подогревают на спиртовке. По мере испарения красителя его следует добавлять пипеткой под покровное стекло
Когда пыльца размягчится ( при надавливании препаровальной иглой на покровное стекло начинает расплываться) нагревание прекратить.
Что такое окрашивание
Окрашивание — это метод, используемый при микроскопических исследованиях биологических образцов для увеличения контраста биологического образца под микроскопом. Он выделяет структуры биологической ткани, такие как определенные популяции клеток, органеллы, ДНК, белки, углеводы и липиды. Пятно может быть синтетическим или натуральным химическим веществом, полученным из растений или животных. Методы окрашивания описаны ниже.
- Одиночное окрашивание — При однократном окрашивании используется только одно окрашивание, чтобы дать единый цвет всему биологическому образцу.
- Двойное окрашивание — При двойном окрашивании используются два окрашивания для окрашивания определенных органелл или определенной области.
- Множественное окрашивание — При многократном окрашивании используется более двух красителей для специфического окрашивания компонентов, таких как органеллы в образце.
ЗАКЛЮЧЕНИЕ
У исследуемых растений Ribes нормально развитые пыльцевые зерна сферической или эллипсовидной формы, с вогнутыми
латеральными плоскостями, порово-оровые. Плоскости пыльцевого зерна имеют околооровые
зоны. Оры в околооровой зоне располагаются или в ее центре, или смещены к периферии
зоны. Околооровые зоны хорошо обособленные (чаще) или сливаются между собой.
Пыльца смородины характеризуется широким полиморфизмом размеров и формы, как между
разными видами, так и в пределах одного вида. У всех изученных видов встречаются нарушения
морфологической структуры пыльцевых зерен; такая пыльца не прорастает на искусственной
питательной среде. Более всего деформированной пыльцы у Ribes mandshuricum, R. ussuriense, R. alpinum, R. dikusha и R. pauciflorum (12.7–6.7%). Наиболее пригодной для оплодотворения является пыльца средних размеров
(21–49 мкм). Больше всего пыльцы средних размеров у R. sanguineum, R. ussuriense, R. saxatile и R. aureum (91.8–94.6%).
Изученные растения имеют высокий процент морфологически сформированной (фертильной)
пыльцы, окрашивающейся ацетокармином (80.3–96.4%). При этом обычно пыльца имеет довольно
низкую жизнеспособность во время ее проращивания на искусственной питательной среде.
Лучше всего прорастает пыльца R. sangui-neum, R. spicatum, R. nigrum, R. ussuriense, R. aureum (45–29%). При этом пыльцевые зерна могут прорастать с нарушениями.
У части видов Ribes пыльца способна прорастать, находясь еще внутри пыльника. Процент прорастания пыльцы
внутри пыльника неодинаковый в цветках, взятых из разных участков соцветия; наилучшее
прорастание имеется у пыльцы из цветков центральной зоны соцветия (15.3–82.9%).
Опылителями цветков Ribes в условиях Санкт-Петербурга являются представители Apis, Bombus и Chrysopa oculatа.
Наблюдаются 2 пика активности опылителей: в утренние часы (10.00–11.00) и вечерние
часы (17.00–18.00).
Прорастание пыльцы видов Ribes на рыльце пестика (in situ) происходит активно, но может сопровождаться нарушениями. При относительно высокой
температуре воздуха прохождение пыльцевой трубки до семязачатка происходит за 3–5
суток. В семязачатках уже в первый день цветения наблюдаются зрелые зародышевые мешки,
готовые к оплодотворению. В гнездах завязи развиваются по 4 геми-ортотропных семязачатка,
расположенных в 6–10 “этажей”. Пыльца попадает на рыльце в двухклеточном состоянии.
Деление генеративной клетки на два спермия происходит в пыльцевой трубке во время
роста пыльцевой трубки.
Проведенные исследования позволяют рекомендовать R. sanguineum, R. spicatum, R. nigrum, R. aureum для использования в экспериментах по селекции Ribes в условиях Санкт-Петербурга.






























