Статья составлена с использованием следующих материалов:
Красникова Л.В., Гунькова П.И. Общая и пищевая микробиология: Учеб. пособие. Часть I. – СПб.: Университет ИТМО, 2016. – 134 с  Скачать >>>
2.
Литусов Н.В. Физиология бактерий. Иллюстрированное учебное пособие. – Екатеринбург: Изд-во УГМУ, 2015. – 43 с
3.
Лысак В.В. Микробиология : учеб. пособие / В. В. Лысак. – Минск: БГУ, 2007 – 430 с
4.
Филина Н.Ю. Верховцева Н.В. Экологическая физиология микроорганизмов. Часть 1. Физиология микроорганизмов: Учебное пособие/Ярославский государственный университет, Ярославль,2001 – 92 с
5.
bacterial leaf spot (Xanthomonas axonopodis) Starr and Garces 1950 by Bacheline Joseph
Свернуть
Список всех источников
Как приготовить среду для культивирования тканей?
Среда для культивирования тканей растений состоит из двух различных параметров, таких как вид растения и часть или тип растительного материала, который вы будете использовать (ткани, протопласты, клетки и т. д.). Чтобы подготовить питательную среду, выполните следующие действия;
- Растворите порошкообразную среду в соответствующем количестве воды.
- Если вы готовите 1-литровую среду, наполните химический стакан 800 мл дистиллированной воды. Постепенно добавьте приведенную в действие среду в химический стакан.
- Затем добавьте 30 г сахарозы.
- Исправить PH на 5.8.
- Затем добавьте в стакан агар (8 г).
- Добавьте гормон (если используете).
- Добавьте 200 мл дистиллированной воды.
- Автоклавные среды.
- Распределите разжижающую среду по стерильным пробиркам и убедитесь, что каждая пробирка помечена.
- Среда должна заполнить примерно треть пробирок.
- Среду следует оставить в стерильной атмосфере, где ее наблюдают до тех пор, пока ее можно будет использовать для культивирования клеток через семь дней.
Подробнее: Служба написания резюме
Культуральная среда Определение
Питательный препарат, на котором или в котором находится культура (микроорганизм), выращиваемый в лаборатории, известен как культуральная среда или питательная среда.
Питательная среда представляет собой твердый или жидкий препарат, используемый для выращивания, транспортировки и хранения микроорганизмов. Чтобы быть полезной, среда должна содержать все питательные вещества, необходимые микроорганизму для прорастания.
- Все микроорганизмы требуют основных требований, хотя существуют различия в применении органических и неорганических соединений.
- В зависимости от выращиваемых видов питательные среды различаются по форме и составу.
- Некоторые среды содержат раствор неорганических солей и могут быть снабжены одним или несколькими органическими соединениями, в то время как другие среды содержат различные компоненты, такие как экстракты или гидролизаты тканей растений и животных.
- Многие микробиологические исследования основаны на способности выращивать и поддерживать микроорганизмы в лаборатории, а это достижимо только при наличии подходящих культуральных сред.
- Выбор подходящей питательной среды также зависит от информации о естественной территории микроорганизма, поскольку его потребности в питании раскрывают его естественное окружение.
- Удовлетворительная среда содержит источники энергии, углерод, азот, фосфор, серу и различные минералы и т. д., которые необходимы для роста микроорганизмов.
- При приготовлении питательной среды для любого микроорганизма основная цель состоит в том, чтобы создать стабильную смесь ожидаемых питательных веществ в концентрациях, которые обеспечат неизмеримый рост.
- Кроме того, культивирование микроорганизмов требует точного контроля различных факторов окружающей среды, которые обычно находятся в узких пределах.
Что такое питательная среда?
Питательная среда является основным ингредиентом в различных областях науки, включая биологию, микробиологию и химию. Она представляет собой специально подготовленную среду, созданную для поддержки роста и размножения различных организмов.
В биологии и микробиологии питательная среда используется для выращивания и исследования бактерий, вирусов и других микроорганизмов. Она состоит из различных питательных веществ, таких как аминокислоты, сахара, витамины и минеральные соли, которые обеспечивают энергию и пищу для роста микроорганизмов.
В химии питательная среда используется для проведения реакций и анализа различных веществ. Она может быть жидкой или твердой, а ее состав и свойства могут варьироваться в зависимости от цели исследования. Питательная среда может содержать различные химические соединения, растворители, катализаторы и другие добавки, которые обеспечивают оптимальные условия для химических процессов.
Существуют различные типы питательных сред, которые подходят для разных типов организмов и экспериментов. Они могут быть жидкими или твердыми, и содержать разные компоненты в зависимости от требований организма или реакции.
В общем, питательная среда играет важную роль в исследовании и экспериментах, предоставляя оптимальные условия для роста и развития различных организмов. Без нее было бы трудно изучать бактерии, вирусы и другие микроорганизмы, и проводить различные химические процессы.
Классификация
Питательные составы различаются по нескольким критериям — способу происхождения, назначению, консистенции. Способ получения является одним из основных критериев — он делит все существующие субстраты на две большие категории. А именно:
Естественные
Естественные составы производятся из натуральных веществ и компонентов — речной или морской воды, тканей живых организмов, растений. Отличаются сложным составом, который не во всех случаях можно точно определить. Сюда относятся бульоны, солодовое сусло, обезжиренное и гидролизованное молоко, овощные отвары, а также кровь и желчь.

Синтетические
Синтетические среды — это субстраты с максимально точным содержанием необходимых химических веществ. Их состав строго рассчитан, а значит полностью известен. Применяются для культивирования и изучения конкретных микроорганизмов — исследования их метаболизма, базовых свойств, способностей принимать вещества, которые подавляют или стимулируют развитие.
Также существуют полусинтетические микробиологические среды. Их основа выполнена из натуральных субстратов, но в состав вводят специальные вещества, обеспечивающие активное размножение культур. Такие субстраты чаще всего применяются в фармацевтике для получения аминокислот, антибиотиков и витаминов.
Рассмотрим также несколько видов субстратов в зависимости от назначения.

Дифференциально-диагностические
Дифференциально-диагностические среды необходимы для отделения разных видов микроорганизмов друг от друга с учётом их ферментативной активности или культуральных проявлений. Состав субстратов рассчитывается таким образом, чтобы было проще выявить свойства каждого вида микроорганизмов, опираясь на особенности обмена веществ. Сюда относятся среды Эндо, Левина, Плоскирева, Гисса и пр. Дополнительно составы могут подкрашивать химическими красителями для идентификации, чтобы было удобнее разделять близкие культуры.
Элективные
Эти среды применяются для отбора и селективного (выборочного) выращивания биологических культур с определёнными качествами. Их состав подбирается таким образом, чтобы подавлять развитие бактерий других видов, но быть оптимальным для требуемой группы (вида) бактерий. Способы создания условий — регулировка кислотности, концентрации солей, питательных веществ. Либо добавление веществ, препятствующих развитию других микроорганизмов. К элективным относятся селенитовые, желчный бульон, щелочной агар, висмут-сульфит агар и пр.
Также существуют среды основные, специальные, консервирующие (транспортировочные), накопления.
Твердые, полужидкие и жидкие
По агрегатному состоянию все составы делятся на три типа. Основой любого субстрата является жидкая среда. Другая консистенция достигается добавлением веществ, повышающих плотность — желатина или агар-агара.
- Жидкие питательные среды используют для накопления микроорганизмов и продуктов их метаболизма, а также для выявления их особенностей. Хранятся такие составы в ёмкостях с плотно завинчивающимися крышками или пробками.
- К полужидким относятся субстраты, в составе которых от 0,2 до 0,7% агара. Чаще всего применяются для хранения культур.
- У твёрдых в составе около 1,5-2,5 % агара. Такие питательные среды используют для выделения бактерий, изучения колоний, учёта количества, определения активности и свойств.
Также существуют сухие субстраты. Это высушенные и измельчённые в порошок вещества (или их комбинации), которые перед применением разводят и стерилизуют.
Асептика и антисептика
Асептика — комплекс профилактических мероприятий, направленных на предотвращение попадания микроорганизмов в какой-либо объект: рану, операционное поле, стерильный раствор или лекарственный препарат.
Она включает:
1) стерилизацию инструментов, приборов, материалов;
2) специальную (антисептическую) обработку рук перед асептичной работой;
3) соблюдение определенных правил и приёмов работы (стерильный халат, маска, перчатки, исключение разговоров и т.п.);
4) осуществление специальных санитарно-противоэпидемических и гигиенических мероприятий (правильная вентиляция, влажная уборка с применением дезинфицирующих средств, использование бактерицидных облучателей, боксированных помещений).
Антисептика — это комплекс мероприятий, направленных на уничтожение микробов, попавших в рану, лекарственный препарат или другой объект.
Различают антисептику:
1) механическую (например, при обработке раны удаление из нее инфицированных и нежизнеспособных тканей, инородных тел);
2) физическую (наложение гигроскопических повязок, дренирование ран, применение гипертонических растворов, способствующих оттоку раневого отделяемого в повязку, сухого тепла, УФО, лазера);
3) химическую (применяют химические вещества, обладающие бактерицидными или бактериостатическим действием при минимальном органотропном действии, например, этиловый спирт, перекись водорода, мирамистин или хлоргексидин; в лекарственные препараты вносят борную кислоту, мертиолят и др.);
4) биологическую (использование протеолитических ферментов для лизиса нежизнеспособных клеток, применение антибиотиков, бактериофагов, иммуноглобулинов, средств, стимулирующих защитные силы организма).
Питательные среды и требования к ним
Микробиологическое исследование — это выделение чистых культур микроорганизмов, культивирование и изучение их свойств.
Для культивирования микроорганизмов необходимы особые субстраты — питательные среды.
На средах микроорганизмы осуществляют все жизненные процессы (питаются, дышат, размножаются).
Питательные среды
Питательные среды являются основой микробиологической работы, и их качество нередко определяет результаты всего исследования. Среды должны создавать оптимальные условия для жизнедеятельности микробов.
Требования, предъявляемые к питательным средам
- 1) содержать все необходимые питательные вещества (микроэлементы, витамины, некоторые аминокислоты);
- 2) иметь оптимальную концентрацию водородных ионов — рН (для большинства патогенных бактерий оптимальна слабощелочная среда (рН 7,2—7,4), исключение составляют холерный вибрион — его оптимум находится в щелочной зоне (рН 8,5—9,0) и возбудитель туберкулеза, нуждающийся в слабокислой реакции (рН 6,2—6,8);
- 3) быть изотоничными для микробной клетки, т. е. осмотическое давление в среде должно быть таким же, как внутри клетки. Для большинства микроорганизмов оптимальна среда, соответствующая 0,5% раствору натрия хлорида;
- 4) быть стерильными: посторонние микроорганизмы препятствуют росту изучаемого м/о, определению его свойств и изменяют свойство среды;
- 5) плотные среды должны быть влажными и иметь оптимальную для микроорганизмов консистенцию;
Стерилизация питательных сред
Все питательные среды независимо от их назначения разливают в чистую посуду и стерилизуют.
Большинство сред стерилизуют автоклавированием, но при различных режимах в зависимости от их состава.
1. Синтетические среды и все агаровые среды, не содержащие в своем составе нативного белка и углеводов, стерилизуют 15—20 мин в автоклаве при температуре 115—120°С и давлении 1-1,5 атмосферы.
2. Среды с углеводами и молоком (в состав которого входит лактоза), питательный желатин стерилизуют текучим паром при температуре 100°С дробно или в автоклаве при 112°С и при давлении до 1 атмосферы.
Среды, в состав которых входят белковые вещества (сыворотка крови, асцитическая жидкость), обеспложиваются тиндализацией или фильтрованием.
4. Для стерилизации питательных сред, содержащих в своем составе нативные белки, пользуются фильтрацией через мембранные фильтры Зейтца.
Для контроля стерильности среды после стерилизации помещают в термостат при 37°С на 3-5 сут.
Жидкие среды должны оставаться прозрачными, а на поверхности и в толще плотных питательных сред не должны появляться признаки роста. Кроме контроля стерильности, производят химический контроль готовых сред, который заключается в том, что в нескольких образцах каждой серии определяют рН, количество общего и аминного азота и хлоридов.
Существует также биологический контроль сред.
В этом случае несколько образцов среды засевают лабораторной культурой того микроба, для которого приготовлена среда, и изучают характер его роста. Только после того, как среды выдержали контроль, их можно использовать по назначению.
Свойство некоторой питательной среды с применением
Маннитоловый агар Эшби
- Модель: химически определенные.
- Специальные ингредиенты: N-бесплатный, содержащий глюкозу.
- Использование для организмов: гетеротрофный, свободноживущие, N-фиксирующие бактерии азотобактер.
Агар для инфузии мозга и сердца
- Модель: не определяемые химически.
- Специальные ингредиенты: Глюкоза.
- Использование для организмов: стрептококки и пневмококки.
Агар Чапека-Докса
- Модель: не определяемые химически.
- Специальные ингредиенты: сахароза.
- Использование для организмов: Особенно плесени aspergillus и penicillium.
Экстракт солода Средней степени определенности
- Модель: не определяемые химически.
- Специальные ингредиенты: Витамины.
- Использование для организмов: дрожжи и ацетобактерия.
Питательный агар
- Модель: не определяемые химически.
- Специальные ингредиенты: Пептон.
- Использование для организмов: Многие непривередливые бактерии, в том числе E.. палочка, B. cereus, S. aureus и P. aeruginosa Водоросли.
Медиум Джорджа
- Модель: минерально-солевая среда.
- Специальные ингредиенты: Пептон.
- Использование для организмов: морские водоросли.
Серная среда Ваксмана
- Модель: химически определенные.
- Специальные ингредиенты: Бактерии, являющиеся источником энергии серы.
- Использование для организмов: Автотрофные, сероокисляющие бактерии, Тиобациллы.
Медиум Виноградского
- Модель: химически определенная неорганическая среда.
- Специальные ингредиенты: NH4+ как источник энергии.
- Использование для организмов: автотрофные нитрифицирующие бактерии, нитрозомонады и нитробактерии.
Кровяной агар
- Модель: Обогащенная и дифференциальная среда.
- Специальные ингредиенты: Кровь.
- Использование для организмов: Многие быстрорастущие бактерии, включая стрептококки и Гонококков свидетельствует о гемолизе.
Шоколадный агар
- Модель: Обогащенная среда.
- Специальные ингредиенты: Кровяной агар нагревают, чтобы разрушить клетки крови.
- Использование для организмов: Нейссерия.
среда Филде
- Модель: Питательная среда.
- Специальные ингредиенты: Содержит ферментативный гидролизат крови.
- Использование для организмов: Haemophilus и clostridium tetani.
Агар с эозином и метиленовым синим (EMB)
- Модель: Селективная и дифференциальная среда.
- Специальные ингредиенты: Эозин и метиленовый синий.
- Использование для организмов: Для дифференциации Е. палочки и Аэробактерии аэрогены.
Агаровая среда МакКонки
- Модель: Селективная и дифференциальная среда.
- Специальные ингредиенты: Желчные соли кристаллический фиолетовый и нейтральный красный хлорид натрия, феноловый красный.
- Использование для организмов: для определения количества БГКП в воде и фекалиях.
Агаровая среда с маннитом и солью
- Модель: Селективная и дифференциальная среда.
- Специальные ингредиенты: Феноловый красный хлорид натрия.
- Использование для организмов: Для изоляции от Сальмонеллы и шигеллы, стафилококки.
Приготовление
Приготовление питательной среды включает несколько этапов, а именно:
- взвешивание — отбор навески компонентов на аналитических весах;
- растворение — для растворения применяется нагретая дистиллированная вода;
- кипячение — для кипячения используется водяная баня;
- установление pH — контролируется с помощью индикаторной бумаги;
- фильтрация — производится через бумажные, матерчатые или ватно-марлевые фильтры (в зависимости от консистенции);
- розлив по ёмкостям — не более, чем на ¾ ёмкости;
- стерилизация — осуществляется различными термическими способами;
- контроль — помещение в термостат на двое суток, затем — установление состава химическим путём или засев специальными культурами для проверки свойств.

Приготовление сред
Посуда для приготовления сред
Посуда для приготовления сред не должна содержать посторонних веществ, например щелочей, выделяемых некоторыми сортами стекла, или окислов железа, которые могут попасть в среду при варке её в ржавых кастрюлях. Лучше пользоваться стеклянной, эмалированной или алюминиевой посудой. Перед употреблением посуду необходимо тщательно вымыть, прополоскать и высушить. Новую стеклянную посуду предварительно кипятят 30 минут в 1-2 % растворе хлороводородной кислоты, после чего в течение часа прополаскивают в проточной воде.
Сырьё
Исходным сырьём для приготовления большинства сред служат продукты животного и растительного происхождения, а также готовые полуфабрикаты.
Этапы приготовления
варка: среды варят на открытом огне, водяной бане, автоклаве или варочных котлах.
установление pH: ориентировочно производят с помощью индикаторной бумаги, для точного определения пользуются потенциометром или компаратором. При стерилизации pH снижается на 0,2, поэтому сначала готовят более щелочной раствор.
осветление производят, если при варке среды мутнеют или темнеют. Для этого используют белок куриного яйца или сыворотку крови.
фильтрация жидких и расплавленных желатиновых сред производят через влажный бумажный или матерчатый фильтры. Фильтрация агаровых сред затруднена — они быстро застывают. Обычно их фильтруют через ватно-марлевый фильтр.
разливают среды не более чем на ¾ ёмкости, так как при стерилизации могут намокнуть пробки и среды утратят стерильность.
стерилизация: режим стерилизации зависит от состава среды и указан в её рецепте.
контроль
- для контроля стерильности среды ставят на 2 суток в термостат, после чего их просматривают.
- химический контроль окончательно устанавливает pH, содержание общего и амминого азота, пептона, хлоридов.
- для биологического контроля несколько образцов среды засевают специально подобранными культурами, и по их росту судят о питательных свойствах среды.
Виды питательных сред
- Среда типа АГВ (ТУ 9229-083-00419785-97).
- Агаризованная дрожже-молочно-солевая среда (АДМС)
- Среда Байрд-Паркера (агаризованная)
- Среда Блаурокка (агаризованная)
- Среда Бушнелла-Хааса (агаризованная)
- Среда Вильсона-Блера (агаризованная)
- Среда Гамборга (агаризованная)
- Среда Гаузе-1 (агаризованная)
- Среда Кери-Блейра (агаризованная) или среда среда Кери-Блэр (Кэри-Блэир).
- Среда Китт Тароцци (агаризованная)
- Среда Левенштейна-Йенсена.
- Среда Левина-ГРМ
- Среда Мак-Конки (агаризованная)
- Среда Мурасиге-Скуга (агаризованная)
- Среда Мюллера-Хинтон (плотная)
- Среда МРС-2 (агаризованная)
- Среда типа MRS (агаризованная) (ГОСТ 51331-99) — латинская аббревиатура предыдущей среды
- Среда типа Neogen
- Среда Рогоза (агаризованная)
- Среда Сабуро (агаризованная)
- Среда Смирнова А. М.
- Среда Сотона (агаризованная)
- Среда СР-15 (агаризованная)
- Среда Стрита (агаризованная)
- Среда Стюарта (транспортная)
- Среда триптон-соевый агар (TSA)
- Среда Хейфлика (агаризованная) или Hayflick Liquid Medium
- Среда Чапека (агаризованная)
- Среда Эймса (транспортная) или Amies Liquid Medium
- Среда Эндо (агаризованная)
- Среда Эшби (агаризованная)
Азотсодержащее сырье
Биосинтез многих биологически активных веществ осуществляют на питательных средах сложного, а зачастую непостоянного химического состава. В них различные источники азота могут быть представлены белками, пептидами или свободными аминокислотами. При промышленной ферментации используют кукурузный экстракт, соевую муку или гидролизаты дрожжей. Кукурузный экстракт содержит весь комплекс аминокислот, но их количественный состав может значительно изменяться от партии к партии. Примерный химический и аминокислотный состав кукурузного экстракта представлен ниже.
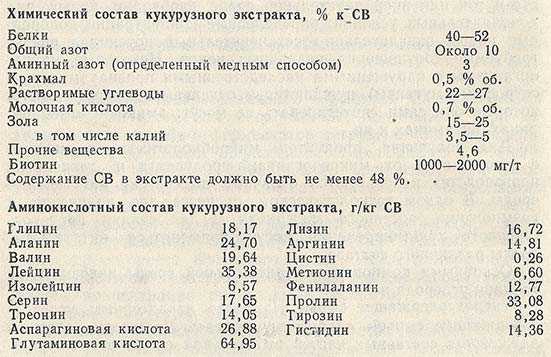
Белковыми веществами богата соевая мука. Она так же, как и кукурузный экстракт, содержит все распространенные аминокислоты, однако в основном они связаны в виде белков. При оценке природных веществ (соевая мука, кукурузный экстракт и т
п.) следует принимать во внимание, что их воздействие на направленный процесс обмена веществ микроорганизмов обусловливается не только наличием белков и аминокислот, но и присутствием наряду с ними углеводов, нуклеиновых кислот, жиров, микроэлементов, органических кислот и других соединений
Из минеральных азотсодержащих веществ наиболее часто применяют аммонийные соли серной, соляной или азотной кислот. Как показала практика, сульфат аммония оказался пригодным для биосинтеза многих соединений.
В веществах, содержащих аммонийный азот, ион аммония находится в сочетании с анионом какой-либо кислоты, например серной или фосфорной. Потребность микроорганизмов в сере и фосфоре меньше, чем в азоте, поэтому при использовании азота в среде будут накапливаться анионы и будет повышаться кислотность среды. Во избежание этого в процессе культивирования микроорганизмов в среду добавляют мел или ведут подтитровку щелочью.
Влияние источников азота на биосинтез зависит непосредственно не только от самого источника азота, но и от общего состава среды. Существенное значение имеет соотношение количеств присутствующих в среде азота и углерода. Их дозировку необходимо регулировать в соответствии с оптимальными границами концентрации наиболее важных веществ для данной культуры. Для каждого штамма-продуцента эта величина будет различной.
Приготовление культуральной среды/среды
Подготовка питательной среды | Автор изображения: СуравБио (microbiologynote.com)
Коммерчески все среды доступны в виде порошка. Приготовление культуральной среды или бактериологической среды можно осуществить, выполнив следующие шаги:
- Растворяли желаемые ингредиенты или полную обезвоженную среду в соответствующем объеме дистиллированной воды.
- Затем определите pH среды с помощью pH-метр и при необходимости отрегулируйте его.
- Добавьте агар в эту среду и прокипятите ее, чтобы растворить агар, если требуется твердая среда.
- Затем разливают среду по пробиркам или колбам.
- После этого стерилизовали их с помощью автоклав. Некоторые термолабильные среды или отдельные ингредиенты стерилизуют с помощью фильтрации.
Состав/приготовление определенной культуральной среды
Название культурного носителя
Приготовление культуральной среды
Трибутириновый агар
Предоставляется для использования. Дайте нагреться, чтобы расплавить и распределить асептически. Можно приготовить путем добавления 1% трибутирина к питательному агару.
Сахарно-пептонная вода
Смешайте 10 г пептона, 5 г NaCl, 5 г сахара и 20 см³ универсального индикатора с 1 л дистиллированной воды; Поддерживайте рН 7.4. Управляйте по мере необходимости и стерилизуйте.
Питательный агар
Растворить 28 г порошка питательного агара в 1 л дистиллированной воды. Затем прокипятите среду до полного растворения агара. Дозируйте по мере необходимости и стерилизуйте.
Питательный бульон
Смешайте 13 г порошка питательного бульона с 1 л дистиллированной воды. Затем хорошо перемешайте. Дозируйте по мере необходимости и стерилизуйте.
Агар с экстрактом солода
Растворить 18 г порошка агара в 1 л дистиллированной воды. Затем прокипятите среду до полного растворения агара. Смешайте 15 г солодового экстракта на литр. хорошо перемешайте. Дозируйте по мере необходимости и стерилизуйте.
Агар с маннитоловым дрожжевым экстрактом
Растворить 10 г агара в 1 л дистиллированной воды. Кипятите среду, чтобы растворить агар. Смешать 0.5 г K2HPO4, 0.2 г MgSO4.7H2O, 0.2 г NaCl, 0.2 г CaCl2.6H2O, 10 г маннита и 0.4 г дрожжевого экстракта. Дозируйте по мере необходимости и стерилизуйте.
Дрожжевой бульон с маннитолом
Выполните вышеуказанный шаг, без агара.
Глюкозный питательный бульон
Приготовьте питательный бульон, как указано выше, и добавьте 10 г глюкозы на литр.
Глюкозно-дрожжевой экстракт бульона
Смешайте 10 г пептона, 5 г NaCl, 3 г дрожжевого экстракта с 1 л дистиллированной воды. Дозируйте по мере необходимости и стерилизуйте.
Экстракт глюкозы дрожжевой бульон лемко
Смешайте 10 г Lemco (мясной экстракт) с глюкозным бульоном дрожжевого экстракта.
Молочный агар
Приготовьте питательный агар, как указано выше, но используя только 900 см³ дистиллированной воды. Растворите 20 г сгущенного обезжиренного молока в 100 см³ дистиллированной воды. Стерилизовать индивидуально. Перенесите молоко на агар асептически после охлаждения до 45-50°С. Распределять асептически.
Крахмальный агар
Растворить 15 г питательного агара в 100 см³ дистиллированной воды. Кипятите среду, чтобы растворить агар. Нагрейте 40 г растворимого крахмала в 100 см³ дистиллированной воды, чтобы образовалась суспензия. Дайте остыть, а затем смешайте с раствором питательного агара. Разложить и стерилизовать.
Йодный раствор
Растворить 1 г кристаллов йода и 2 г калия йода в 300 см³ дистиллированной воды.
Целлюлозный бульон (для Trichoderma reesei)
В 0.1 см2 дистиллированной воды добавляют 0.5 г CaCl4, 2 г (NH4)0.5SO0.5, 10 г порошка дрожжевого экстракта, 1.0 г аспарагина, 2 г карбоксиметилцеллюлозы, 4 г KH800PO3. Затем поддерживайте pH6.2
Смешайте ингредиенты как следует, осторожно нагрейте и перемешайте до полного растворения.





























