Презентация на тему: » Кремний и его соединения. 1. Характеристика Характеристика элемента по положению в системе и строению атома 2. Распространение Распространение в природе.» — Транскрипт:
1
Кремний и его соединения

2
1. Характеристика Характеристика элемента по положению в системе и строению атома 2. Распространение Распространение в природе 3. Физические Физические свойства Аллотропия 4. Химические Химические свойства 5. Способы Способы получения 6. Применение Применение кремния и его соединений 7. Оксид Оксид кремния IV 8. Кремниевая Кремниевая кислота

3
Si — элемент 14, 3 период, IV А группа, Ar(Si)=28. 1s 2 2s 2 2p 6 3s 2 3p 2 3d 0 – стационарное состояние 1s 2 2s 2 2p 6 3s 1 3p 3 3d 0 – возбуждённое состояние 3s3s 3p3p 3d3d 3s3s 3p3p 3d3d Возможные степени окисления: -4; 0; +2; +4

4
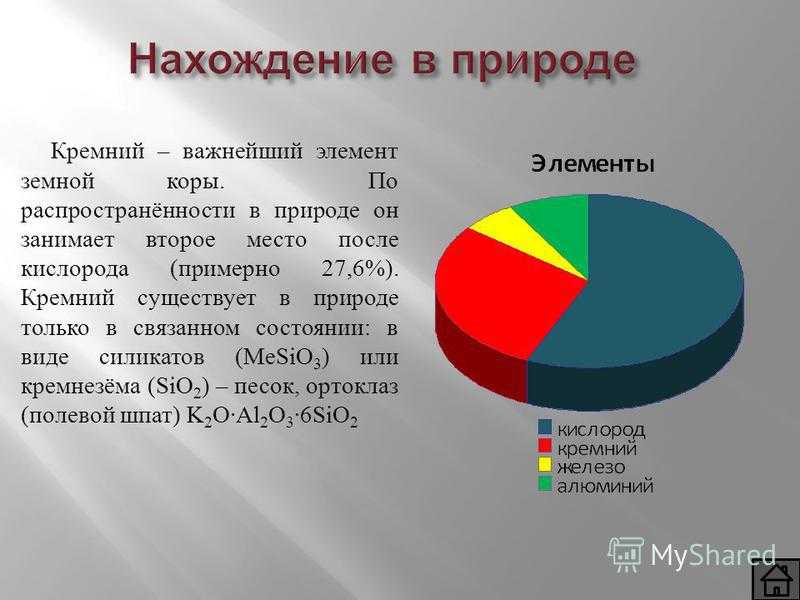
Нахождение в природе Кремний – важнейший элемент земной коры. По распространённости в природе он занимает второе место после кислорода (примерно 27,6%). Кремний существует в природе только в связанном состоянии: в виде силикатов (MeSiO 3 ) или кремнезёма (SiO 2 ) – песок, ортоклаз (полевой шпат) K 2 O·Al 2 O 3 ·6SiO 2
5
Яшма Агат

6
Физические свойства Кристаллический кремний Тёмно-серого цвета, имеет металлический блеск, полупроводниковые свойства Химически инертен. Плотность 2,33 г/см 3 Температура плавления = 1415 С Аморфный кремний Бурый порошок Более активен, чем кристаллический Алмазоподобная структура Плотность 2 г/см 3 Кремний

7
Химические свойства Si + 2F 2 SiF 4 (фторид кремния) Si + 2Cl 2 SiCl 4 (хлорид кремния) Типичный неметалл, инертен. Реагирует с сильными окислителями или восстановителями при очень высокой температуре. Si + O 2 SiO 2 (оксид кремния) 2)Кремний сгорает в кислороде 3)Кремний взаимодействует с азотом и углеродом Si + C SiС (карборунд)3Si + 2N 2 Si 3 N 4 ( нитрид кремния ) 4)Кремний растворяется в щелочах при нагревании Si + 2NaOH + H 2 O Na 2 SiO 3 + 2H 2 Как восстановитель 5)С водородом не взаимодействует Si + H 2 1)Взаимодействует с галогенами

8
При сплавлении кремния с металлами могут образоваться силициды Как окислитель Si + 2Mg Mg 2 Si (Силицид магния) Силициды – малоустойчивые соединения. В присутствии воды или кислот они разлагаются: Mg 2 Si + 4H 2 O 2 Mg(OH) 2 + SiH 4 (силан) Ca 2 Si + 4HCl 2CaCl 2 + SiH 4 (силан) Химические свойства

9
Способы получения кремния 2)В лаборатории – восстановлением SiO 2 + 2C Si + 2CO SiO 2 + 2Mg Si + 2MgO 3SiO 2 + 4Al 3Si + 2Al 2 O 3 3)Наиболее чистый кремний получают из тетрахлорида кремния SiCl 4 + 2H 2 Si + 4HCl SiCl 4 + 2Zn Si + 2ZnCl 2 1)В промышленности

10
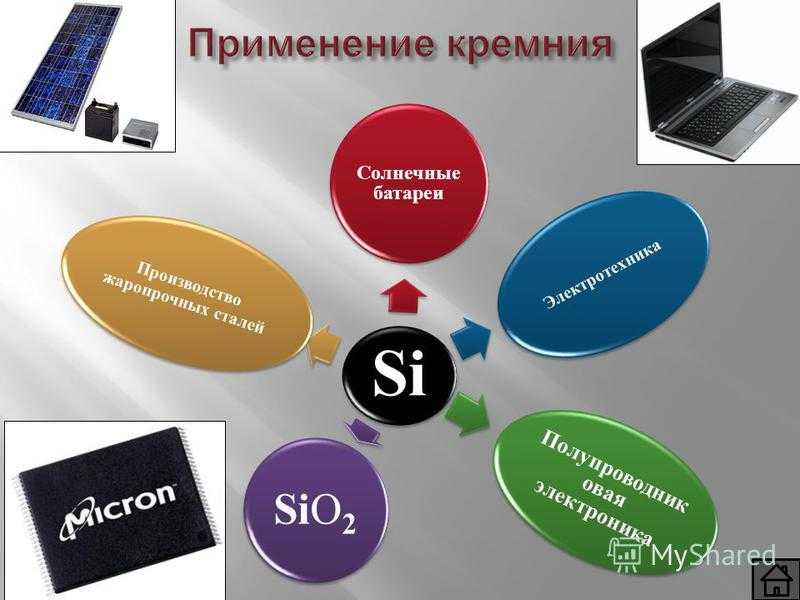
Применение кремния Si Солнечные батареи Электротехника Полупроводник овая электроника SiO2 Производство жаропрочных сталей
11
Оксид кремния IV (SiO 2 ) n Кварц Кристобалит Коусит Горный хрусталь Агат Яшма опал Кварцевый песок В природе 2 вида кремнезёма: Кристаллический и аморфный. Твёрдое, кристаллическое вещество, атомная кристаллическая решётка, немолекулярного строения. Т пл = 1728 С, Т кип = 2590 С, инертен.

12
1. Со щелочами при t SiO 2 + 2NaOH Na 2 SiO 3 + H 2 O 2. С солями SiO 2 + CaCO 3 CaSiO 3 + CO 2 3. С основными оксидами SiO 2 + CaO CaSiO 3 4. Не реагирует с водой SiO 2 + H 2 O Кислотный оксид 5. Особое свойство (Травление стекла) SiO 2 + 4HF SiF 4 + 2H 2 O 6. С металлами при t SiO 2 + 2Mg 2MgO + Si

13
Кремниевая кислота. Силикаты nSiO 2 mH 2 O поликремниевые кислоты N = 1, m = 1 SiO 2 H 2 O или H 2 SiO 3 – кремниевая кислота. Слабая, непрочная, в воде малорастворимая (образует коллоидный раствор), нет кислого вкуса. 1. При нагревании разлагается H 2 SiO 3 H 2 O + SiO 2 2. Со щелочами H 2 SiO 3 +2NaOH 2H 2 O + Na 2 SiO 3 Na 2 SiO 3 и K 2 SiO 3 – жидкое стекло Получение : Na 2 SiO 3 + 2HCl 2NaCl + H 2 SiO 3 Студенистый осадок Свойства:


Изотопы и их применение[править | править код]
Кремний состоит из стабильных изотопов 28Si (92,23 %), 29Si (4,67 %) и 30Si (3,10 %). Остальные изотопы являются радиоактивными.
Ядро 29Si (как и протон) имеет ядерный спин I = 1/2 и всё шире используется в спектроскопии ЯМР. 31Si, образующийся при действии нейтронов на 30Si, имеет период полураспада равный 2,62 ч. Его можно определить по характеристическому β-излучению, и он очень удобен для количественного определения кремния методом нейтронно-активационного анализа. Радиоактивный нуклид 32Si имеет самый большой период полураспада (~170 лет) и является мягким (низкоэнергетическим) β-излучателем.
Где встречается кремний в природе
С кремнием многие из нас знакомы с детства, вернее с одним из его соединений. Серые неприметные камешки, из которых мы высекали искру для разжигания костра, пользовались у нас особой популярностью.
Минерал — кремень, образовался в меловом периоде из остатков растений и животных подводного мира, в составе которого присутствует диоксид кремния. Как вы помните, из школьного курса истории, из этого камня в древности люди изготавливали орудия труда (наконечники, топоры…)
Что такое кремний
Химический элемент кремний в таблице Менделеева находится под порядковым номером 14. Это неметалл, латинское название кремния — (Silicium) — Si.
Кремний настолько распространен в природе, что занимает после кислорода второе место и составляет 30%, существует около 400 минералов в гидросфере, литосфере и биосфере, в которых он содержится. Большое количество этого элемента присутствует в морской воде, до 3 мг. на литр воды.
Огромное количество разных соединений этого элемента, человек использует для изготовления оборудования, стекла, отделочных и строительных материалов, украшений.
Кремний в природе присутствует в виде двух аллотропных модификаций, они чем-то схожи между собой, но и различаются строением кристаллической решетки и свойствами, это кристаллический и аморфный кремний.

Где содержится в природе
Кремний в чистом виде в природе не встречается, соединения кремния содержат горные породы, почва, морская вода, растения и морские обитатели, наземные животные и организм человека.
Недра земли хранят огромное количество минералов с содержанием кремния. Наиболее распространенной формой природных соединений кремния считается кремнезем, силикаты и алюмосиликаты.
Из соединений кремния широко распространены:
- бинарные соединения с неметаллами (силан, карбид, нитрид, фосфид и так далее), с силанами мы знакомы встречая их в быту в виде резины, силикона, смазок, эмульсий;
- оксиды, диоксиды (халцедон и агат, аметист и яшма, горный хрусталь и опал, кварц и кварцевый песок, полевые шпаты);
- кремниевая кислота и силикаты ( стекло, фарфор, фаянс, цеолит, цемент..);
Получение[править | править код]
Свободный кремний получается при прокаливании мелкого белого песка (диоксида кремния) с магнием:
- SiO2+2Mg⟶2MgO+Si{\displaystyle {\ce {SiO_2 + 2Mg -> 2MgO + Si}}},
при этом образуется аморфный кремний, имеющий вид бурого порошка.
В промышленности кремний технической чистоты получают, восстанавливая расплав SiO2 коксом при температуре около 1800 °C в рудотермических печах шахтного типа. Чистота полученного таким образом кремния может достигать 99,9 % (основные примеси — углерод, металлы).
Возможна дальнейшая очистка кремния от примесей.
- Очистка в лабораторных условиях может быть проведена путём предварительного получения силицида магния Mg2Si. Далее из силицида магния с помощью соляной или уксусной кислот получают газообразный моносилан SiH4. Моносилан очищают ректификацией, сорбционными и др. методами, а затем разлагают на кремний и водород при температуре около 1000 °C.
- Очистка кремния в промышленных масштабах осуществляется путём непосредственного хлорирования кремния. При этом образуются соединения состава SiCl4, SiHCl3 и SiH2Cl2. Их различными способами очищают от примесей (как правило, перегонкой и диспропорционированием) и на заключительном этапе восстанавливают чистым водородом при температурах от 900 до 1100 °C.
- Разрабатываются более дешёвые, чистые и эффективные промышленные технологии очистки кремния. На 2010 год к таковым можно отнести технологии очистки кремния с использованием фтора (вместо хлора); технологии, предусматривающие дистилляцию монооксида кремния; технологии, основанные на вытравливании примесей, концентрирующихся на межкристаллитных границах.
Содержание примесей в доочищенном кремнии может быть снижено до 10−8—10−6 % по массе. Более подробно вопросы получения сверхчистого кремния рассмотрены в статье Поликристаллический кремний.
Способ получения кремния в чистом виде разработан Николаем Николаевичем Бекетовым.
В России технический кремний производится «ОК Русал» на заводах в г. Каменск-Уральский (Свердловская область) и г. Шелехов (Иркутская область).
Кремний, как простое вещество
Кремний представляет из себя темно-серое кристаллическое вещество с металлическим блеском. Кристаллический кремний является полупроводником.
Кремний образует только одну аллотропную модификацию, подобную алмазу, но при этом не такую прочную, т. к. связи Si-Si не так прочны, как в алмазной молекуле углерода (См. ).
Аморфный кремний — порошок бурого цвета, с температурой плавления 1420°C.
Кристаллический кремний получают из аморфного путем его перекристаллизации. В отличие от аморфного кремния, который является достаточно активным химическим веществом, кристаллический кремний более инертен в плане взаимодействия с другими веществами.
Строение кристаллической решетки кремния повторяет структуру алмаза, — каждый атом окружен четырьмя другими атомами, расположенными в вершинах тетраэдра. Атомы связываются друг с другом ковалентными связями, которые не так прочны, как углеродные связи в алмазе. По этой причине, даже при н.у. некоторые ковалентные связи в кристаллическом кремнии разрушаются, в результате чего высвобождается некоторая часть электронов, благодаря чему кремний обладает небольшой электропроводностью. По мере нагревания кремния, на свету или при добавлении некоторых примесей, кол-во разрушаемых ковалентных связей увеличивается, вследствие чего и увеличивается кол-во свободных электронов, следовательно, растет и электропроводность кремния.
Литература[править | править код]
- Самсонов. Г. В. Силициды и их использование в технике. Киев, Изд-во АН УССР, 1959. 204 стр. с илл.
- Алёшин Е. П., Алёшин Н. Е. Рис. Москва, 1993. 504 стр. 100 рис.
- Китай ввел пошлины на ввоз поликристаллического кремния «солнечного» качества из США… Под их действие не попадает поликремний «электронного» качества, предназначенный, в частности, для изготовления чипов… // 2014
| H | He | |||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | |
| Uue | Ubn | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | |||||||||||||||||||||||||
| Iа | IIа | IIIб | IIIб: лантаноиды и актиноиды и Суперактиноиды | IVб | Vб | VIб | VIIб | VIIIб | Iб | IIб | IIIа | IVа | Vа | VIа | VIIа | VIIIа | ||||||||||||||||
Об элементе
Кре́мний — элемент четырнадцатой группы (по старой классификации — главной подгруппы четвёртой группы), третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 14. Атомная масса 28,086 Обозначается символом Si (лат. Silicium), неметалл.
Впервые в чистом виде кремний был выделен в 1811 году французскими учёными Жозефом Луи Гей-Люссаком и Луи Жаком Тенаром.

В 1825 году шведский химик Йёнс Якоб Берцелиус действием металлического калия на фтористый кремний SiF4получил чистый элементарный кремний. Новому элементу было дано название «силиций» (от лат. silex — кремень). Русское название «кремний» введено в 1834 году российским химиком Германом Ивановичем Гессом. В переводе c др.-греч. κρημνός — «утёс, гора».

Содержание кремния в земной коре составляет по разным данным 27,6—29,5 % по массе. Таким образом, по распространённости в земной коре кремний занимает второе место после кислорода. Концентрация в морской воде 3 мг/л.Чаще всего в природе кремний встречается в виде кремнезёма — соединений на основе диоксида кремния (IV) SiO2 (около 12 % массы земной коры). Основные минералы и горные породы, образуемые диоксидом кремния, — это песок (речной и кварцевый), кварц и кварциты, кремень, полевые шпаты. Вторую по распространённости в природе группу соединений кремния составляют силикаты и алюмосиликаты.Отмечены единичные факты нахождения чистого кремния в самородном виде.

Применение Кремния

Большая часть кремния используется в промышленности практически без очистки, по сравнению с его естественной формой. Более 90% земной коры состоит из силикатных минералов. Многие из них имеют прямое коммерческое использование, такие как глина, кварцевый песок и некоторые виды строительного кварца. Большая часть кремния применяется именно в строительстве, так как кремний является связующей составляющей бетона, без которого не обходится практически ни одно сооружение. Так же кремний используется в разного рода растворах, штукатурке. Этот химический элемент является основой красного огнеупорного кирпича, разного рода керамических изделий, которые встречаются повсеместно.
Так же кремний используется и в металлургической промышленности в качестве добавки. Это позволяет улучшить некоторые физические свойства изготавливаемых материалов. К примеру можно взять металлы, которые изготавливаются для электротехнической промышленности. Добавка кремния к этим металлам позволяет регулировать их удельное сопротивление, что может быть очень важным в часных случаях. Так же стоит отметить автомобильную промышленность. На сегодняшний день подавляющее большинство автомобильных двигателей изготавливается из алюминий-кремниевого сплава, который обеспечивает двигателю заданные характеристики.
Следующим пунктом стоит отметить электронику. В этом сегменте используется кремний именно высокой очистки. На его долю приходится не больше 20% от общего количества. Большая часть кремния в этой сфере используется в качестве полупроводников. Оставшаяся часть идет на изготовление высокоточных и узкоспециализированных приборов или запасных частей к ним. В пример можно поставить фотоэлементы и микропроцессоры. Для этих устройств кремний является неотъемлемой частью.
Читайте: Неон как химический элемент таблицы Менделеева
Физические свойства[править | править код]
Кристаллическая структураправить | править код
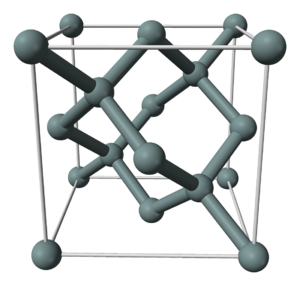
Кристаллическая структура кремния.
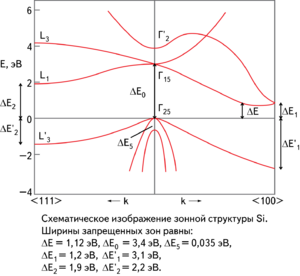
Схематическое изображение зонной структуры кремния
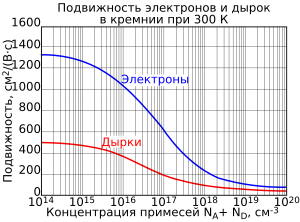
Подвижность электронов и дырок в кремнии в зависимости от концентрации легирующей примеси при 300 К
Кристаллическая решётка кремния кубическая гранецентрированная типа алмаза, параметр а = 0,54307 нм (при высоких давлениях получены и другие полиморфные модификации кремния), из-за большей длины связи между атомами Si—Si по сравнению с длиной связи С—С твёрдость кремния значительно меньше, чем алмаза. Кремний хрупок, только при нагревании выше 800 °C он становится пластичным веществом.
Электрофизические свойстваправить | править код
Элементарный кремний в монокристаллической форме является непрямозонным полупроводником. Ширина запрещённой зоны при комнатной температуре составляет 1,12 эВ, а при Т = 0 К — 1,21 эВ. Концентрация собственных носителей заряда в кремнии при нормальных условиях составляет около 1,5⋅1010 см−3.
На электрофизические свойства кристаллического кремния большое влияние оказывают содержащиеся в нём примеси. Для получения кристаллов кремния с дырочной проводимостью в кремний вводят атомы элементов III группы, таких, как бор, алюминий, галлий, индий. Для получения кристаллов кремния с электронной проводимостью в кремний вводят атомы элементов V группы, таких, как фосфор, мышьяк, сурьма.
При создании электронных приборов на основе кремния используется преимущественно приповерхностный слой монокристалла (толщиной до десятков мкм), поэтому качество поверхности кристалла может оказывать существенное влияние на электрофизические свойства кремния и, соответственно, на свойства созданного электронного прибора. При изготовлении некоторых приборов используется технология, модифицирующая поверхность монокристалла, например, обработка поверхности кремния различными химическими реагентами и её облучение.
- Некоторые электрофизические параметры монокристаллического кремния при нормальных условиях
- Диэлектрическая проницаемость: 12
- Подвижность электронов: 1200—1450 см²/(В·c).
- Подвижность дырок: 500 см²/(В·c).
- Ширина запрещённой зоны 1,21 эВ при 0 К.
- Время жизни свободных электронов: 5 нс — 10 мс.
- Длина свободного пробега электронов: порядка 1 мм.
- Длина свободного пробега дырок: порядка 0,2—0,6 мм.
- Собственная концентрация носителей заряда: 5,81⋅1015 м−3 (при 300 K).
Нехватка кремния — симптомы
Дефицит Si может вызывать следующие нарушения в работе организма:
- Дряблость и сухость кожи, а также склонность к рецидивирующим кожным болезням – экземе, дерматиту, дерматозу, рожистым воспалениям и прочим. Раны заживают медленнее;
- Волосы становятся тусклыми, секутся и выпадают в повышенном количестве;
- Ногти также становятся более ломкими, периодически слоятся;
- Со временем развивается остеомаляция костей (размягчение костной ткани), остеопороз, артриты, склонность к переломам;
- Появляется ряд зубных болезней – кариес, пародонтоз;
- Развивается ряд заболеваний сердца и сосудов – артериальная гипертензия (гипертония), атеросклероз, ишемическая болезнь сердца, тромбофлебит, варикозное расширение вен, склонность к инфаркту и инсульту;
- Снижение аппетита;
- Повышенное утомление, периодическая слабость и апатия;
- Склонность к инфекционным болезням;
- Замедление роста ребенка;
- Бесплодие;
- Сосуды теряют свою эластичность, из-за чего при небольшом ушибе на коже появляются синяки, а также периодическое формирование сосудистых «звездочек».
- Кроме того, замечена связь между недостаточным количеством кремния в организме и наличием в это время следующих болезней – катаракта, сахарный диабет, дисбактериоз, гепатит, наличие камней в желчном пузыре (ЖКБ) и почках (ПКБ), злокачественные опухоли (рак).
Причины нехватки Si
- Недостаточное поступление микроэлемента из-за недостаточного питания, жестких и несбалансированных диет, голодовки;
- Употребление продуктов питания, скудных на полезные вещества – малополезной и вредной пищи;
- Злоупотребление алкогольными напитками;
- Наличие в организме глистных инвазий и прочих паразитов.
Применение[]
Мини Микроконтроллер 1993 года с УФ стиранием памяти 62E40 европейской фирмы STMicroelectronics За окошечком виден кристалл микросхемы — кремниевая подложка с выполненной на ней схемой.
В настоящее время кремний — основной материал для электроники и солнечной энергетики.
Монокристаллический кремний — материал для рентгеновской оптики преломления — оптика, отличающаяся новыми свойствами и характкристиками, обеспечивающая преломление и фокусировку рентгеновских лучей аналогично тонким линзам. Также применяется для изготовления рентгеновских зеркал, применяемых в рентгеновских микроскопах, телескопах и др.
Иногда кремний (технической чистоты) и его сплав с железом (ферросилиций) используется для производства водорода в полевых условиях.
Соединения металлов с кремнием — силициды, являются широкоупотребляемыми в промышленности (например электронной и атомной) материалами с широким спектром полезных химических, электрических и ядерных свойств (устойчивость к окислению, нейтронам и др.), а также силициды ряда элементов являются важными термоэлектрическими материалами.
Кремний применяется в металлургии при выплавке чугуна, сталей, бронз, силумина и др. (как раскислитель и модификатор, а также как легирующий компонент).
Соединения кремния служат основой для производства стекла и цемента. Производством стекла и цемента занимается силикатная промышленность. Она также выпускает силикатную керамику — кирпич, фарфор, фаянс, стеклокерамику (ситаллы) и изделия из них.
Оптика
Основная статья: Оптические элементы из кремния
Основная статья: Линза из кремния
Плоско-выпуклая линза
Линзы контактные
Оптические элементы из кремния — линзы, призмы, пластинки, изготовленная из однородного кремния, прозрачны для инфракрасно излучения, преломляют Х-лучи и стойкие к Х-излучению.
Линзы контактные
Линзы из органических полимеров дают возможность создавать недорогие асферические линзы с помощью литья. В области офтальмологии созданы мягкие контактные линзы. Их производство основано на применении оптическиих полимерных материалов материалов (ОПМ), имеющих бифазную природу, сочетающих фрагменты кремний-органического или кремний-фторорганического полимера силикона и гидрофильного полимера гидрогеля.
Линзы из кремния
Линза преломления ретгеновских лучей
Линзы из кремния или рентгеновская оптика преломления — линзы, изготовленные из однородного кремния, прозрачные для инфракрасного излучения, рентгеновсого излучения, преломляющие Х-лучи.
В настоящее время нашли применение линзы из кремния
Это связано с современным уровнем технологий обработки твёрдых кристаллов и самое важное, кремний сочетает сверхвысокую дисперсию с самым большим абсолютным значением коэффициента преломления n=3,4 в диапазоне ИК-излучения; линзы из кремния прозрачны к Х-лучам и способны их преломлять, фокусировать (мягкие и жёсткие Х-лучи), что в последнее время находят широкое применение в микроскопии, телескопии, вытесняя рентгеновскую дорогостоящую оптику с применением зеркал и оптических систем «скользящего» преломления Х-лучей. Они полностью непрозрачны в видимом диапазоне спектра
Кроме этого кремний обладает способностью создавать материалы, имеющих бифазную природу, сочетающих фрагменты кремний-органического или кремний-фторорганического полимера силикона и гидрофильного полимера гидрогеля. Что делает его самым перспективным в изготовлении мягких контактных линз.
Биологическая роль
Для некоторых организмов кремний является важным биогеным элементом. Он входит в состав опорных образований у растений и скелетных — у животных. В больших количествах кремний концентрируют морские организмы — диатомовые водоросли, радиолярии, губки. Большие количества кремния концентрируют хвощи и злаки, в первую очередь — подсемейства Бамбуков и Рисовидных, в том числе — рис посевной. Мышечная ткань человека содержит (1-2)·10-2% кремния, костная ткань — 17·10-4%, кровь — 3,9 мг/л. С пищей в организм человека ежедневно поступает до 1 г кремния.
Соединения кремния относительно нетоксичны. Но очень опасно вдыхание высокодисперсных частиц как силикатов, так и диоксида кремния, образующихся, например, при взрывных работах, при долблении пород в шахтах, при работе пескоструйных аппаратов и т. д. Микрочастицы SiO2, попавшие в лёгкие, кристаллизуются в них, а возникающие кристаллики разрушают лёгочную ткань и вызывают тяжёлую болезнь — силикоз. Чтобы не допустить попадания в лёгкие опасной пыли, следует использовать для защиты органов дыхания респиратор.
Углерод и кремний
Строение углерода. Углерод представитель четвертой группы, главной подгруппы. Обозначение в периодической системе – С. Находится он, в системе элементов под номером 6, атомный вес равен 12. Заряд ядра +6. Внешний слой представлен 4 электронами, двумя спаренными s-электронами и двумя неспаренным и р-электронам.
 Имеет множество интересных особенностей в своем строении. Элемент поистине уникальный. Называют его «царём органического мира». И за его особенности строения молекулы и атома, он может образовывать множество элементов. А в химии есть целый раздел, изучающий эти соединения.
Имеет множество интересных особенностей в своем строении. Элемент поистине уникальный. Называют его «царём органического мира». И за его особенности строения молекулы и атома, он может образовывать множество элементов. А в химии есть целый раздел, изучающий эти соединения.

группы, главной подгруппы.Но в отличие от углерода он в третьем периоде. Что наделяет его несколько иными свойствами.

Кремний также называют «царем», но только неорганического «мира». Если органическим миром называют совокупность живых организмов их продукты жизнедеятельности. То неорганической называют природу неживую. И ее главное отличие – не способность гореть в огне.
Кремний так же образует множество соединений (второй по распространению в земной породе элемент после кислорода). Состав земной породы можно описать так: соединения кремния и кислорода с другими элементами. Химический знак — Si. Порядковый номер – 14, заряд ядра +14. В свободной форме вещество имеет металлический блеск.
Внешний слой атома кремния такой же, как внешний слой атома углерода. Так же 4 атома, но разница в радиусе, расстоянии до ядра. Оно больше, чем у углерода, а значит атомы менее связаны с ядром.
 Нахождение кремния в природе в виде минералов Источник
Нахождение кремния в природе в виде минералов Источник
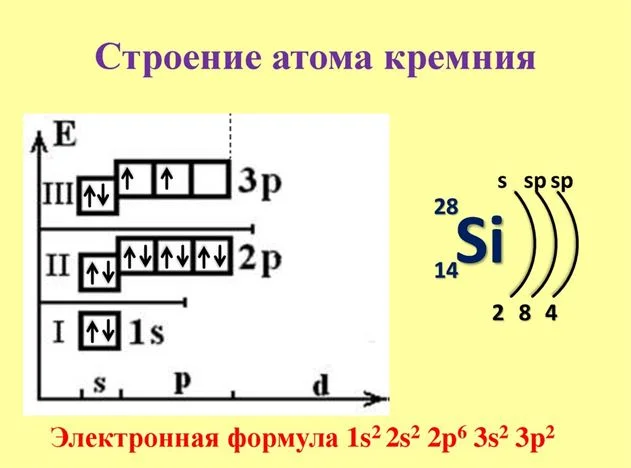 Строение атома кремния Источник
Строение атома кремния Источник
Аллотропия углерода и кремния
Аллотропные формы углерода
Углероду свойственно явление аллотропии. Например, у углерода 4 аллотропные формы: графит, алмаз, карбин, фуллерен. По составу это все тот же углерод, но ввиду особенностей строения молекулы каждого из них, имеются различия в физических и химических свойствах.
Открытие фуллерена произошло относительно недавно, в 1985 г, их особенность в строении молекулы, похожей на футбольный мяч. Наиболее распространены молекулы фуллерена С60, состоящего из 60 атомов углерода,и фуллерена С70, состоящего из 70 атомов углерода.
Благодаря своему строению, обладает уникальными свойствами, который открывает широкий спектр применений. Начиная применениями в физике, заканчивая медициной. Молекула является мощнейшим антиоксидантом, используемая даже в борьбе с ВИЧ.
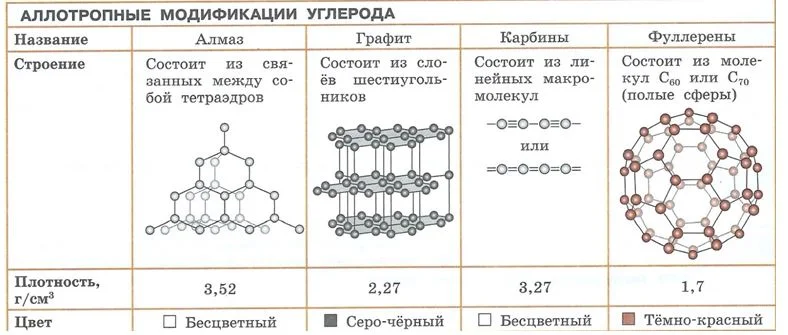 Аллотропные модификации углерода Источник
Аллотропные модификации углерода Источник
Графит и алмаз нам хорошо знакомы. Первый используется как грифель для простого карандаша, второй является драгоценным камнем, но ввиду своей прочности используется и в строительстве, и в медицине и т.д. Отличны они по своим физическим свойствам, в силу различий строений графических решеток.
Графит вещество темно-серого цвета, не поддается плавлению, обладает металлическим блеском и достаточно мягкий. Его кристаллическая решетка атомная. Это означает, что в узлах таких решеток атомы, связаны ковалентной полярной или неполярной связью. Такая кристаллическая решетка влияет и на свойства вещества, придавая тугоплавкость, нерастворимость в воде.
 Изображение графита при нахождении в природе и графит в грифеле карандаша.
Изображение графита при нахождении в природе и графит в грифеле карандаша.
Алмаз – самое твердое вещество на земле. Цвета не имеет.Плавлению не поддается. Высока твердость и тугоплавкость алмаза объясняется строением кристаллической решетки.Связи между атомами углерода – ковалентные неполярные, они равны по длине и энергии. Поэтому сложно разорвать их. Иначе называют «кубической аллотропной формой углерода».
 Алмазы до и после огранки
Алмазы до и после огранки
Карбин — это еще одна аллотропная модификация углерода, по последним данным это вещество считается тверже алмаза.Было впервые получено и открыто в 1960-х годах. Примечательно, что сначала его получили в лаборатории, а после обнаружили в природе, в виде вкраплений в чаоите (минерал белого цвета, называемый иначе «белый углерод»), графите и в метеоритах.Обладает широкими набором свойств. В обычном состоянии порошкообразное вещество. Также тугоплавкое.
 Чаоит
Чаоит
Аллотропия кремния
Аллотропия кремния выражена двумя видами кремния: аморфным и кристаллическим. Это два вещества,одинаковых по составу, но различные построению молекул. Эти отличия наделяют их разными физическими и химическими свойствами, а также различиями во внешнем виде.
Цвет кристаллического кремния темный, почти черный. Присутствует металлический блеск. Твердый на ощупь, при этом хрупкий. Обладает свойствами полупроводником. Полупроводники – вещества, способные проводить электричество. Но по своей способности проводить последнее они находятся между проводниками, хорошо проводящими электрический ток, и диэлектриками, веществами, плохо проводящими электрический ток.
Кипит и плавится при больших температурах, реакционно не активен. Структуру имеет подобную алмазу.
Аморфный кремний буро-красный по цвету, порошкообразен. Хорошо впитывает воду, но структура такая же как у кристаллического.
 Аллотропия кремния
Аллотропия кремния
Как сделать кремниевую воду
После приобретения, минерал необходимо промыть и положить на дно банки с водой ( 10-15 г кремния на один литр воды).Вода настаивается 2-3 суток в темном месте
Затем воду слить осторожно, не взбалтывая осадок. Осадок, это грязь и вредные вещества, которые были в воде
Воду использовать для питья, а камешки промыть и поместить в соленый раствор для очищения, после их можно вновь использовать. Но минерал не долговечный, когда-то наступает момент, что кремниевая кислота, полностью из этого минерала будет израсходована, а это произойдет примерно через полгода. Кремний нужно будет поменять.
Где-то читала, что кремниевая вода в герметичной упаковке может храниться более года и не портиться.
Как очистить воду кремнием? Не каждый камешек кремниевый пригоден для очистки воды. Те камни, что можно найти на берегу реки или водоема, будут непригодны для структурирования воды, они загрязнены окружающей средой. Необходим минерал, добытый из недр земных. Специалисты рекомендуют использовать минералы серого или черного цвета. Лучше брать мелкий щебень, чтобы увеличивалась площадь соприкосновения с водой.
В старину кремнием выкладывали дно колодцев, таким образом, очищая воду и превращая ее в целебную. Если положить камешки в аквариум, то вода в нем не цветет. Читайте, шунгитовая вода.





























