Примеры реакций нейтрализации PDF
Если вы ищете больше примеров реакций нейтрализации, существует множество ресурсов PDF, которые могут предоставить вам богатство информации. Эти ресурсы может быть ценный инструмент в понимании концепт реакций нейтрализации и их протекания в различных химические реакции.
Предложение PDF-ресурсов удобный способ , чтобы открыть Широкий ассортимент примеров, пояснений и диаграмм, связанных с реакциями нейтрализации. Их можно легко скачать и сохранить на твое устройство, что позволяет вам обращаться к ним всякий раз, когда вам нужно освежить свои знания или изучить новые примеры.
Одной из преимущества использования PDF-ресурсов заключается в том, что они часто включают в себя подробные объяснения рядом примеры. Это может помочь вам получить более глубокое понимание of основополагающие принципы и механизмы, участвующие в реакциях нейтрализации. Изучая эти объяснения, вы можете улучшить ваше понимание of тема и развивать более полное понимание о том, как работают реакции нейтрализации.
Кроме того, ресурсы PDF могут также включать пошаговые инструкции о том, как выполнить определенные эксперименты или демонстрации, связанные с реакциями нейтрализации. Этот практический подход может быть особенно полезен для визуальные ученики кто предпочитает видеть реакции в действии.
Кроме того, PDF-ресурсы часто предоставляют большой выбор примеров, охватывающих Различные типы реакций нейтрализации. Сюда могут входить кислотно-основные реакции, включающие общие вещества такие как соляная кислота, серная кислота, азотная кислота, уксусная кислота и лимонная кислота, а также основные вещества такие как гидроксид натрия, гидроксид калия, аммиак, гидроксид кальция, гидроксид магния, фосфорная кислотаи гидроксид алюминия.
Изучая эти примеры, вы сможете получить лучшее понимание of различные факторы которые влияют на реакции нейтрализации, такие как уровень pH, титрование и образование солей. Это знание может быть особенно полезен в таких областях, как химия, биология и наука об окружающей среде.
В заключение, если вы хотите расширить свои знания о реакциях нейтрализации, вам могут пригодиться ресурсы PDF. ценный актив. Они предлагают Широкий ассортимент примеров, объяснений и инструкций, которые могут помочь углубить Ваше понимание of этот важный химический процесс. Итак, вперед и исследуйте доступные PDF-ресурсы расширить свои знания о реакциях нейтрализации.
Применение на практике
Методы нейтрализации положены в основу титриметрического анализа. Титрование используется во многих сферах:
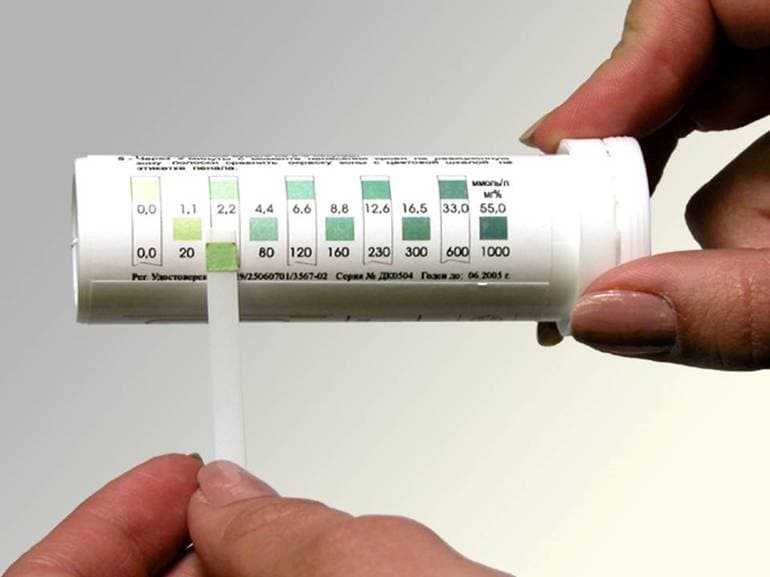
В диагностике заболеваний пищеварительной системы титрование применяют для определения количества соляной кислоты в желудочном соке.
В лабораторной диагностике применяется реакция нейтрализации для определения буферной ёмкости плазмы крови.
Многие тяжёлые заболевания и угрожающие жизни состояния сопровождаются сдвигом рН биологических жидкостей. Сдвиг может произойти в кислую сторону (ацидоз) или в щелочную (алкалоз). Чтобы скорректировать кислотно-основное равновесие, необходимо определить рН.
Чтобы сократить содержание в крови щелочных компонентов, при метаболическом ацидозе в качестве экстренной меры используют внутривенное вливание щелочного раствора (бикарбоната натрия, лактата натрия, Трисамина). В результате происходит выравнивание баланса в организме.
Для коррекции алкалоза вводят раствор аскорбиновой кислоты. Она нейтрализует избыток щелочных оснований.
Наиболее широко используются реакции нейтрализации при лечении болезней желудка. При повышенной кислотности назначают антацидные средства — оксид магния, карбонат кальция и пр.
В фармакологии и аналитической химии титрование применяют для определения количества органических и неорганических кислот в составе вещества. Кроме того, метод позволяет определить, проходят ли лекарственные средства через клеточные мембраны и с какой скоростью.
Метод нейтрализации используется в пищевой и химической промышленности. С его помощью определяют количество кислоты или щёлочи в том или ином веществе, продукте или жидкости.
Нередко эта химическая реакция используется в быту. При проливе уксусной или другой кислоты на кожу может возникнуть ожог. В качестве первой помощи необходимо тщательно промыть место чистой водой, после чего обработать содовым раствором. Той же тактики придерживаются при ожоге едкой щёлочью. В качестве нейтрализатора используется лимонная или уксусная кислота в слабом разведении.
Предыдущая запись Химический элемент магний (Mg) — характеристика, строение и свойства металла
Следующая запись Золото (Au) — характеристика, строение и свойства элемента таблицы Менделеева
Применения
Методы химического титрования используются для анализа кислот или оснований с целью определения неизвестной концентрации. Можно использовать либо pH-метр, либо pH-индикатор, который показывает точку нейтрализации по отчетливому изменению цвета. Простые стехиометрические расчеты с известным объемом неизвестного и известным объемом и молярностью добавленного химического вещества дают молярность неизвестного.
В очистке сточных вод методы химической нейтрализации часто применяются для уменьшения ущерба, который сточные воды могут нанести при попадании в окружающую среду. Для контроля pH популярные химические вещества включают карбонат кальция, оксид кальция, гидроксид магния и бикарбонат натрия. Выбор подходящего химического вещества для нейтрализации зависит от конкретного применения.
Есть много применений реакций нейтрализации, которые являются кислотно-щелочными реакциями. Очень часто используются антацидные таблетки. Они предназначены для нейтрализации избытка желудочной кислоты в желудке (HCl ), которая может вызывать дискомфорт в желудке или нижних отделах пищевода. Это также можно исправить путем приема внутрь бикарбоната натрия (NaHCO 3).
В химическом синтезе наноматериалов теплоту реакции нейтрализации можно использовать для облегчения химического восстановления предшественников металлов.
Также в пищеварительном тракте реакции нейтрализации используются, когда пища перемещается из желудок к кишечнику. Для всасывания питательных веществ через стенку кишечника необходима щелочная среда, поэтому поджелудочная железа вырабатывает антацидный бикарбонат, вызывающий эту трансформацию.
Другое распространенное применение, хотя, возможно, не так широко известно, — это удобрения и контроль pH почвы. Гашеную известь (гидроксид кальция) или известняк (карбонат кальция) можно обрабатывать в почве, слишком кислой для роста растений. Удобрения, улучшающие рост растений, получают путем нейтрализации серной кислоты (H 2SO4) или азотной кислоты (HNO 3) газообразным аммиаком (NH 3) с образованием сульфата аммония. или нитрат аммония. Это соли, используемые в удобрении.
В промышленности побочный продукт сжигания угля, диоксид серы газ, может объединяться с водяным паром в воздухе с образованием серной кислоты, которая выпадает в виде кислотного дождя. Чтобы предотвратить выброс диоксида серы, устройство, известное как скруббер, собирает газ из дымовых труб. Это устройство сначала вдувает карбонат кальция в камеру сгорания, где он разлагается на оксид кальция (известь) и диоксид углерода. Затем эта известь вступает в реакцию с образовавшимся диоксидом серы с образованием сульфита кальция. Затем в смесь вводят суспензию извести, чтобы получить суспензию, которая удаляет сульфит кальция и любой оставшийся непрореагировавший диоксид серы.
Нормальная концентрация
Нормальная концентрация, или нормальность раствора (н.) показывает, сколько эквивалентов вещества содержится в 1 л его раствора. Например, по аналогии с молярной концентрацией, 1,00 М раствор H3PO4 имеет нормальность 3,00 н, а 0,010 М раствор Mg(OH)2 имеет нормальность 0,020 н.

Пример 2. Определите молярность и нормальность 500 мл раствора, полученного при растворении в воде 4,00 г NaOH.
Решение:
По таблице Менделеева находим молекулярную массу гидроксида натрия, она равна 40,0 г/моль. В нашем распоряжении ровно 4,00 г NaOH, и в них содержится:
4,00 г / 40,0 г/моль = 0,100 моля NaOH
Нам уже известно, что молярная концентрация представляет собой отношение числа моль растворенного вещества на общий объем раствора, следовательно молярность раствора гидроксида натрия равна:
0,100 моля NaOH / 0,500 л раствора = 0,200 моль/л, или 0,2 М NaOH
В данном случае молярность раствора совпадает с его нормальностью, поскольку каждый моль гидроксида натрия дает 1 эквивалент OH— ионов. Следовательно нормальность полученного раствора равна также 0,200 н.
Пример 3. В 750 мл раствора содержится 10,0 г серной кислоты H2SO4. Определите молярность и нормальность данного раствора.
Решение:
- 10,0 г / 98,1 г/моль = 0,102 моля серной кислоты
- 0,102 моля / 0,750 л = 0,136 М раствор серной кислоты
Поскольку каждый моль серной кислоты высвобождает 2 эквивалента ионов H+, полученный раствор серной кислоты имеет нормальность, равную 2·0,136=0,272 н., т.е. представляет собой 0,272 н. раствора H2SO4.
Надеюсь урок 17 «Реакция нейтрализации» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.
дальнейшее чтение
Нейтрализация рассматривается в большинстве учебников по общей химии. Подробные описания можно найти в учебниках по аналитической химии, таких как
Скуг, Д.А.; Запад, DM; Холлер, JF; Крауч, SR (2004). Основы аналитической химии (8-е изд.). Томсон Брукс / Коул. ISBN 0-03-035523-0. Главы 14, 15 и 16
Приложения
- Штумм, В .; Морган, Дж. Дж. (1996). . Нью-Йорк: Вили. ISBN 0-471-05196-9.
- Snoeyink, VL; Дженкинс, Д. (1980). Водная химия: химические равновесия и скорости в природных водах . Нью-Йорк: Вили. ISBN 0-471-51185-4.
- Миллеро, FJ (2006). Химическая океанография (3-е изд.). Лондон: Тейлор и Фрэнсис. ISBN 0-8493-2280-4.
- Меткалф и Эдди. Очистка, очистка и повторное использование сточных вод . 4-е изд. Нью-Йорк: Макгроу-Хилл, 2003. 526-532.
Химический эквивалент
С реакцией нейтрализации тесно связано процедура кислотно-основного титрования. Грубо говоря, титрование — это способ определения имеющегося количества кислоты или основания в растворе, путем измерения количества основания или кислоты с заданной концентрацией необходимого для полной нейтрализации имеющегося реагента. При титровании пользуются понятием химический эквивалент.
Химический эквивалент кислоты — количество кислоты, которое при нейтрализации основания высвобождает 1 моль ионов H+.
Химический эквивалент основания — количество основания, которое при нейтрализации основания высвобождает 1 моль ионов OH—.
Полная нейтрализация происходит в том случае, если в реакцию вступают одинаковые количества химических эквивалентов кислоты и основания.
Грамм-эквивалент — это масса кислоты (или основания) в граммах, которая образует 1 моль ионов H+ (или OH—)
Для кислот, способных высвобождать 1 ион H+ на молекулу, как, например, HCl или HNO3, химический эквивалент представляет собой то же самое количество вещества, что и моль, а 1 грамм-эквивалент — то же самое, что и молекулярная масса. Однако поскольку H2SO4 способна высвобождать два иона H+ на молекулу, 1 молю H2SO4 соответствуют два эквивалента, и поэтому в реакциях кислотно-основной нейтрализации грамм-эквивалент серной кислоты равен половине ее молекулярной массы. Грамм-эквивалент фосфорной кислоты H3PO4, т.е. такая ее масса в граммах, которая образует 1 моль ионов H+, равен 1/3 молекулярной массы этой кислоты. Точно так же для NaOH, KOH и NH3, молекулярные массы совпадают с грамм-эквивалентами этих веществ, но грамм-эквивалент Ca(OH)2 равен половине его молекулярной массы.
В удобстве использования понятий химического эквивалента и грамм-эквивалента можно убедиться при рассмотрении нейтрализации фосфорной кислоты гидроксидом магния:

Рассмотрим решение конкретной задачи по химическим эквивалентам и грамм-эквивалентам:
Пример 1. Используя метод эквивалентов, найдите число граммов HNO3 необходимо для нейтрализации 100,0 г Ba(OH)2.
Решение:
Первым делом выпишем молекулярные массы и грамм-эквиваленты для HNO3 и Ba(OH)2:
| Реагент | Молекулярная масса, г/моль | Грамм-эквивалент, г/экв |
| Азотная кислота, HNO3 | 63,01 | 63,01 / 1 = 63,01 |
| Гидроксид бария, Ba(OH)2 | 171,34 | 171,34 / 2 = 85,67 |
Отлично! Теперь найдем сколько химических эквивалентов гидроксида бария содержится в 100,0 г:
100,0 г / 85,67 г/экв = 1,167 экв Ba(OH)2
В начале урока мы говорили, что полная нейтрализация получается, когда в реакцию вступают одинаковые количества химических эквивалентов кислоты и основания. Поэтому для нейтрализации 1,167 экв Ba(OH)2 потребуется 1,167 экв HNO3:
1,167 экв × 63,01 г/экв = 73,53 г HNO3
Ответ получен! Кстати, данную задачу можно решить по другому, используя полное уравнение реакции:
2HNO3 + Ba(OH)2 → Ba(NO3)2 + 2H2O
Число моль Ba(OH)2, вступающего в реакцию, равно:
100,0 г / 171,3 г/моль = 0,5838 моля Ba(OH)2
Из полного уравнения реакции следует, что в ней должно принять участие вдвое большее молярное количество азотной кислоты, чем гидроксида бария:
0,5838 моля × 2 = 1,167 моля HNO3
А в граммах это составит:
1,167 моля × 63,01 г/моль = 73,53 г HNO3
Ответы совпадают, т.е оба метода решения верны, однако метод эквивалентов позволяет обойтись без использования полного уравнения реакции.
Обратимые реакции
Обратимость происходит в результате смещения вправо в системе равновесия. Обратимость реакции можно увидеть при использовании в качестве исходных веществ, например, или синильной кислоты, а также аммиака.
Слабая кислота и сильное основание:HCN+KOH=KCN+H2O;
В ионном виде:HCN+OH(-)=CN(-)+H2O.
Слабое основание и сильная кислота:HCl+NH3-H2O=Nh4Cl+H2O;
В ионном виде:H(+)+NH3-H2O=NH4(+)+H2O.
Слабая соль и слабое основание:CH3COOH+NH3-H2O=CH3COONH4+H2O;
В ионном виде:CH3COOH+NH3-H2O=CH3COO(-)+NH4(+)+H2O.
Существующее в неорганической химии понятие “реакция нейтрализации” подразумевает химический процесс, в котором взаимодействуют вещества с кислотными и основными свойствами, в результате чего происходит потеря участниками реакции и тех и других характерных химических свойств. Реакция нейтрализации в микробиологии имеет то же глобальное значение, продукты ее теряют свои биологические свойства. Но, разумеется, это совершенно иной процесс с другими участниками и итогами. И биологическое свойство, о котором идет речь и которое прежде всего интересует врачей и ученых, — это способность микроорганизма вызывать заболевание или гибель восприимчивого животного.
Области применения
Чаще всего этот метод исследования используется для идентификации вирусов, то есть диагностики вирусных заразных болезней. Причем тест может быть направлен как на выявление самого возбудителя, так и антител к нему.
В бактериологии эту методику обычно применяют для выявления антител к ферментам бактерий, таких как антистрептолизины, антистафилолизины, антистрептокиназы.
Каким образом проводится этот тест
Реакция нейтрализации основана на способности антител — особых иммунных белков крови — нейтрализовать антигены — чужеродные агенты, попадающие в организм. Если необходимо обнаружение возбудителя и его идентификация, тогда смешивают стандартную иммунную сыворотку, содержащую антитела, с биологическим материалом. Полученная смесь выдерживается в термостате нужное время и вводится в живую восприимчивую систему.
Таковыми являются лабораторные животные (крысы, мыши), куриные эмбрионы, культуры клеток. При отсутствии биологического действия (болезни или смерти животного) можно сделать вывод о том, что это именно тот вирус, стандартную сыворотку к которому использовали. Так как, как уже было сказано, признаком того, что реакция прошла, является потеря вирусом биосвойств (способности вызывать смерть животного) вследствие взаимодействия антител сыворотки и антигенов вируса. При определении токсических веществ алгоритм действий тот же, но есть варианты.
Если исследуют какой-либо субстрат, содержащий токсин, тогда его смешивают со стандартной сывороткой. В случае изучения последней применяют контрольное токсическое вещество. Чтобы пошла реакция нейтрализации, эта смесь также инкубируется заданное время и вводится восприимчивой системе. Техника оценки результата точно такая же.
В медицинской и ветеринарной практике используемая как диагностический тест реакция нейтрализации вирусов проводится в так называемой методике парных сывороток.
Это способ подтверждения диагноза какого-либо вирусного заболевания. Для его проведения у больного человека или животного берут дважды — в начале заболевания и через 14-21 дней после этого.
Если после проведения теста обнаруживается увеличение количества антител к вирусу в 4 и более раза, то диагноз можно считать подтвержденным.
Значения pH некоторых растворов
При определении величины pH для растворов кислот и оснований принято выражать концентрацию раствора в единицах нормальности. Нормальная концентрация – это количество моль-эквивалентов вещества в 1 л раствора: .
Эквивалентом называется частица (реальная либо условная), которая в химических реакциях равноценна одному катиону или одному электрону. Моль-эквивалент содержит эквивалентов, а его масса в единицах называется молярной массой эквивалента .
Многоосновные кислоты могут отдавать один или более ионов водорода, поэтому число моль-эквивалентов в растворе и, соответственно, нормальность будет в разных случаях неодинакова. Она имеет обозначение «н.» с указанием доли нормальной концентрации. Например, серная кислота, молекула которой при диссоциации отдает два протона , при молярной концентрации имеет нормальность 1н.
pH растворов кислот
| Кислота | Концентрация | pH |
| Азотная | 0,1 н. | 1,0 |
| Борная | 0,1 н. | 5,2 |
| Муравьиная | 0,1 н. | 2,3 |
| Серная | н. | 0,3 |
| 0,1 н. | 1,2 | |
| 0,01 н. | 2,1 | |
| Сернистая | 0,1 н. | 1,5 |
| Сероводородная | 0,1 н. | 4,1 |
| Уксусная | н. | 2,4 |
| 0,1 н. | 2,9 | |
| 0,01 н. | 3,4 | |
| Соляная | н. | 0,1 |
| 0,1 н. | 1,1 | |
| 0,01 н. | 2,0 | |
| Щавелевая | 0,1 н. | 1,3 |
pH растворов оснований
Нормальность щелочей определяется аналогично нормальности кислот, исходя из количества гидроксид-ионов, которые отщепляются при диссоциации.
| Основание | Концентрация | pH |
| Гидроксид калия | н. | 14,0 |
| 0,1 н. | 13,0 | |
| 0,01 н. | 12,0 | |
| Гидроксид кальция | насыщенный | 12,4 |
| Гидроксид натрия | н. | 14,0 |
| 0,1 н. | 13,0 | |
| 0,01 н. | 12,0 |
Значения pH некоторых бытовых веществ и пищевых продуктов
| Вещество | pH | Продукт | pH |
| электролит аккумуляторный на основе | <1 | сок лимонный | 2,0–2,6 |
| шампуни | 4,5–7,0 | уксус пищевой | 2,4–3,1 |
| мыла жидкие на основе синтетических ПАВ | 5,5–7,0 | кетчуп | 3,9 |
| средства для мытья стекол | 6,2–7,3 | томаты | 4,3–4,9 |
| средства для мытья пола | 6,9–8,6 | сыр | 4,8–6,4 |
| вода морская | 8,0 | кофе | 5,0 |
| мыло натуральное | 9,0–11,0 | чай | 5,5 |
| нашатырный спирт | 11,5 | вода питьевая | 6,5–8,5 |
| хлорная известь (отбеливатель) | 12,5 | молоко | 6,5–6,9 |
| раствор соды | 13,5 | яйцо куриное свежее | 7,6–8,0 |
Реакция — нейтрализация
Реакции нейтрализации ( РН) основаны на способности специфических антител иммунных сывороток погашать болезнетворное действие вирусов, риккетсий, бактерий и других инфекционных агентов или их продуктов, а также ингибировать физиологические реакции живых систем.
Реакция нейтрализации протекает очень быстро, и при дальнейшем смешивании вся масса сточных вод приобретает одинаковое значение рН в течение нескольких минут.
Реакция нейтрализации не сопровождается внешним эффектом, поэтому определять эквивалентную точку приходится с помощью индикаторов. Но они меняют окраску не строго в эквивалентной точке, а с некоторым отклонением. В связи с этим даже при правильном выборе индикатора допускается погрешность, называемая индикаторной ошибкой титрования. Неправильный же выбор индикатора искажает результаты анализа. Наиболее часто применяют из индикаторов метиловый оранжевый, метиловый красный, лакмус и фенолфталеин.
Реакция нейтрализации — реакция между кислотами и основаниями, ведущая к образованию солей.
Реакция нейтрализации сопровождается выделением большого количества тепла, что нежелательно в данном случае. Дело в том, что под влиянием высокой температуры поваренная соль, имеющаяся в соде в качестве примеси, разлагается с выделением хлора.
|
Нейтрализационный аппарат ИТН. |
Реакция нейтрализации сопровождается выделением тепла. Количество выделяющегося тепла реакции находится в зависимнсти от концентрация применяемой в производстве азотной кислоты. Чем выше концентрация кислоты, тем больше выделяется тепла.
Реакции нейтрализации были исследованы разными методами. Было найдено, что для потенциометрического титрования в безводном тионилхлориде удобно использовать молибденовый электрод , однако механизм электродной реакции не был установлен.
|
Соединения фосфороксихлорида с хлоридами. |
Реакции нейтрализации могут проводиться также с помощью цветных индикаторов: они показывают обратимое изменение цвета в зависимости от активности ионов хлора в растворе, которая может быть измерена также при помощи обратимого хлоридного электрода.
Реакции нейтрализации не сопровождаются каким-либо внешним эффектом, поэтому момент эквивалентности взаимодействующих растворов или конец титрования фиксируется подходящим индикатором, прибавляемым в небольшом количестве к титруемому раствору.
Реакция нейтрализации протекает между основаниями и кислотами. Сущность этой реакции заключается в том, что за счет гидроксильных групп оснований и водорода кислот образуется нейтральное вещество — вода.
Реакция нейтрализации широко используется в химической промышленности для получения различных солей.
Реакция нейтрализации идет согласно следующему уравнению: NaOH НС1 NaCl ЬШ.
Реакция нейтрализации не сопровождается какими-либо внешними изменениями, например переменой окраски раствора. Поэтому для фиксирования точки эквивалентности приходится прибегать к помощи индикаторов. Таких индикаторов известно много, причем оказывается далеко не безразличным, какой из них выбрать. Надо сказать, что индикаторы обычно изменяют свою окраску не строго в точке эквивалентности, а с некоторыми отклонениями от нее. В соответствии с этим, если индикатор выбран правильно, проистекающая отсюда погрешность ( называемая индикаторной ошибкой титрования) мала и не скажется на результатах титрования. Но при неправильном выборе индикатора она может достигнуть значительной величины и совершенно исказить результаты анализа. Кроме того, в таких случаях и самая перемена окраски индикатора происходит не скачком, от одной капли титрующего раствора, а постепенно, так что неизвестно, когда следует закончить титрование.
Что такое пример реакции нейтрализации
Реакции нейтрализации — это тип химической реакции, которая происходит, когда кислота и основание реагируют друг с другом с образованием соли и воды. Эти реакции также известны как кислотно-основные реакции. В реакции нейтрализации кислотные свойства кислоты и основные свойства основания нейтрализуются, в результате чего образуется нейтральный раствор.
Краткая информация о реакциях нейтрализации и их примерах
Реакции нейтрализации часто встречаются в нашей повседневной жизни. Они играют решающую роль в Различные поля, включая химию, биологию и медицину. Давайте рассмотрим несколько примеров реакций нейтрализации для получения лучшее понимание о том, как они происходят и их значение.
-
Соляная кислота и гидроксид натрия: Когда соляная кислота (HCl) реагирует с гидроксидом натрия (NaOH), ионы водорода (H+) кислоты соединяются с ионами гидроксида (OH-) основания, образуя воду (H2O). Остальные ионы, натрий (Na+) и хлорид (Cl-), объединяются, образуя хлорид натрия (NaCl), который представляет собой соль, широко известную как поваренная соль.
-
Серная кислота и гидроксид калия: В этой реакции серная кислота (H2SO4) реагирует с гидроксидом калия (KOH). Ионы водорода кислоты соединяются с гидроксид-ионами основания, образуя воду. Остальные ионы, калий и сульфат, объединяются, образуя сульфат калия (K2SO4), который представляет собой соль, используемую в удобрениях.
-
Азотная кислота и гидроксид кальция: Когда азотная кислота (HNO3) реагирует с гидроксидом кальция (Ca(OH)2), вода образуется в результате сочетания ионов водорода и ионов гидроксида. Остальные ионы, кальций и нитрат, объединяются, образуя нитрат кальция (Ca(NO3)2), который используется в качестве удобрение и в продуктион фейерверков.
-
Уксусная кислота и аммиак: Уксусная кислота (CH3COOH) реагирует с аммиаком (NH3) с образованием воды и ацетата аммония (CH3COONH4). Эту реакцию обычно используют в продуктион уксуса.
-
Лимонная кислота и гидроксид магния: Когда лимонная кислота (C6H8O7) реагирует с гидроксидом магния (Mg(OH)2), образуется вода и цитрат магния (C6H6Mg3O7). Цитрат магния используется в качестве слабительное и при лечении изжоги.
-
Фосфорная кислота и гидроксид алюминия: Фосфорная кислота (H3PO4) реагирует с гидроксидом алюминия (Al(OH)3) с образованием воды и фосфата алюминия (AlPO4). Фосфат алюминия используется как ингредиент в антацидах и зубные цементы.
Эти примеры иллюстрируют разнообразный ассортимент реакций нейтрализации и их приложения. Реакции нейтрализации не ограничиваются этими примерами и могут протекать при различные другие кислоты и базы. PH полученного решения зависит от сила кислоты и основания, использованных в реакции. Титрование – это распространенный метод, используемый для определения концентрации кислоты или основания путем нейтрализации их раствором. известная концентрация of противоположный реагент.
В заключение, реакции нейтрализации имеют фундаментальное значение. химические реакции которые возникают при взаимодействии кислоты и основания. В результате образуются соль и вода. Понимание реакций нейтрализации и их примеров необходимо для понимания различные химические процессы и их приложения в нашей повседневной жизни.
Заключение
В заключение следует отметить, что реакции нейтрализации важный аспект Химия, возникающая при реакции кислоты и основания с образованием соли и воды. Эти реакции играют решающую роль в различные повседневные сценарии, Из продуктион обычные предметы домашнего обихода как мыло и пищевая сода для лечения изжога. Понимая концепт реакций нейтрализации и их примеров, мы можем получить более глубокая оценка для химические процессы которые происходят повсюду вокруг нас. Будь то шипение of таблетка антацида in стакан воды или успокаивающий эффект of паста из пищевой соды on пчелиный укусреакции нейтрализации продолжают влиять на нашу повседневную жизнь в многочисленные способы. Поэтому в следующий раз, когда вы столкнетесь с кислотой или основанием, помните сила нейтрализации и как она может трансформировать одно вещество в другой, привнося баланс и гармонию в мир химии.
Понятие о водородном показателе
Определение pH-фактора базируется на кислотно-основных свойствах воды. Ее молекулы способны к самопроизвольной диссоциации, благодаря чему в воде всегда присутствует некоторое количество ионов и . Их концентрация мала вследствие обратимости процесса диссоциации, который выражается формулой
⇄ +
Из формулы видно, что ионы водорода и гидроксила содержатся в воде в равной концентрации: []=[]. В стандартных условиях (при температуре 22–25° C) она составляет моль⁄л.
Величина =[]∙[] называется ионным произведением воды. При заданной температуре она является постоянной (при 22–25° C = моль/л) не только для воды, но и для разбавленных растворов. При добавлении кислоты к воде повышается концентрация [] и понижается [] (кислотность возрастает), при добавлении щелочи падает [] и растет [] (кислотность понижается).
В качестве показателя кислотности удобно использовать десятичный логарифм величины [] с обратным знаком:
pH = -lg []
Для воды и любой нейтральной среды водородный показатель составит: pH = — lg = -(-7) = 7
Названия солей
Все международные химические названия солей, полученных в результате нейтрализации, строятся по единому принципу и состоят из двух слов. Первое слово — это наименование кислотного остатка. Оно является производным от латинского названия кислоты:

- серной — сульфат;
- азотной — нитрат;
- соляной — хлорид;
- фосфорной — фосфат и пр.
В качестве примера можно привести названия солей:
- фосфат калия — K3PO4;
- сульфат меди — CuSO4;
- нитрат натрия — NaNO3.
Это утверждение верно и для обратной ситуации — по названию соли можно определить её химическую формулу. Вначале записывается символ, которым металл обозначается в периодической таблице. Затем добавляется формула кислотного остатка.
Следующий шаг — определение валентности обеих частей. Теперь нужно найти для них наименьшее общее кратное и разделить его на валентность каждой части соли. Значит, в результате получается количество атомов металла в формуле и количество кислотных остатков.
Кислотный остаток может иметь сложную структуру и содержать в себе несколько разных атомов (азотная, серная, фосфорная кислоты и пр.). При составлении формулы соли кислотный остаток вписывается в скобки. За ними цифровым индексом обозначается количество остатков.
https://youtube.com/watch?v=CD30WHVBmu0
Влияние температуры на значение pH
Повышение температуры приводит к росту диссоциации слабых электролитов, в том числе и воды. Повышается равновесная концентрация ионов и и возрастает величина ионного произведения. Соответственно меняется и водородный показатель для нейтральной среды:
| Температура
T, 0° C |
20 | 25 | 40 | 60 | 80 | 100 | |
| Ионное произведение воды, , моль ⁄л | |||||||
|
Нейтральный pH = — lg(√(K_W ))=-lg K_W/2 |
7,5 | 7,1 | 7 | 6,8 | 6,5 | 6,3 | 6,1 |
Температурные изменения оказывают сложное и неоднозначное влияние на измерения pH. В целом органические и щелочные пробы более зависимы от них, чем неорганические и кислотные. При pH-метрии и титровании температура строго контролируется, а полученные результаты пересчитываются с целью приведения к значению, характерному при 25° C.
Общие принципы

Сущность реакции нейтрализации заключается в том, что кислота и основание вступают во взаимодействие. Они обмениваются активными компонентами. Происходит нейтрализация обоих составляющих. В итоге получается вода и соль, имеющие нейтральную реакцию среды.
Общий принцип взаимодействия выглядит следующим образом: кислота соединяется со щёлочью, обменивается активными компонентами, в результате чего получается нейтральная соль и вода.
NaOH + HCl → NaCl + H2O.
Перед соединением этих веществ можно проверить их реакцию с помощью лакмусовой бумаги:
- В присутствие соляной кислоте лакмус окрасится в красный цвет.
- В щелочном растворе гидроксида натрия — в синий.
- После смешивания растворов бумажка покажет нейтральную реакцию, то есть будет фиолетовой.
Ионное уравнение нейтрализации выглядит так: H+ + OH- → H2O.

Если получившийся раствор нагреть, вода постепенно испарится. В колбе останется осадок — поваренная соль (хлорид натрия).
Некоторые основания не растворяются в воде, но хорошо растворяются в кислотах. В результате взаимодействия тоже образуется вода и соль. Примером может быть реакция между нерастворимым гидроксидом меди и серной кислотой. В итоге получается медный купорос и вода.
Стихи для запоминания окраски индикаторов
1) Индикатор лакмус — красный,
Кислоту укажет ясно.
Индикатор лакмус — синий,
Щелочь здесь! Не будь разиней!
2) Лакмус будет в них краснеть,
Растворяться — цинк и медь.
А мелок в них, посмотри,
Вмиг пускает пузыри!
И опасны для работы
Эти жгучие КИСЛОТЫ
3) Я растворчик изучал.
Лакмус в нем синее стал.
Поглощал раствор тотчас
Кислый углекислый газ!
Про такой раствор я знаю,
Что среда в нем ЩЕЛОЧНАЯ
4) Смущает меня щелочная среда;
Краснею… Но если вокруг кислота,
И если в воде растворен я один,
Не видно меня. Я — фенолфталеин.
Ах, что же я поделаю с собой —
Ведь в щелочи я сине-голубой.
А в кислоте быть синим я не смею:
Я — лакмус, и в кислотах я краснею.
Как на прогулке от мороза,
От кислого я стану розов.
Но вид мой в щелочи смешон:
Я сразу желтый, как лимон.
(метилоранж)
|
Название индикатора |
Нейтральная среда (OH=H) |
Щелочная среда (OH>H) |
|
Лакмус |
Фиолетовый |
Синий |
|
Фенолфталеин |
Бесцветный |
|
|
Метилоранж |
Оранжевый |
Жёлтый |
|
Универсальная индикаторная бумага |
Оранжевая |
Синяя |

Видео-опыт: “
Видео-опыт: “
Виртуальная образовательная лаборатория:“Определение характера среды раствора с помощью универсального индикатора”
Это интересно
Кто придумал индикаторы?
Современные индикаторы — фенолфталеин, метиловый оранжевый, метиловый красный — в основном продукты химического синтеза. А первый индикатор был приготовлен английским учёным Робертом Бойлем (1627 — 1691) из тропического лишайника лакмуса. Фиолетовый настой этого лишайника под действием кислот становился красным, а под действием щелочей — синим. Бойль пропитал фильтровальную бумагу этим настоем и тем самым положил начало применению индикаторной бумаги («реактивные бумажки»). Он также заметил, что и отвары цветков некоторых растений (фиалок, васильков и др.) меняют цвет в растворах кислот и щелочей. Термин «индикатор» также придумал Роберт Бойль.
Индикаторы из растений (в виде отваров или соков) можно приготовить и самостоятельно. В качестве сырья можно использовать ягоды черники, чёрной рябины, винограда, столовую свёклу, листья краснокочанной капусты, цветки анютиных глазок, ирисов и т. д.
Чтобы узнать, как изменяется цвет самодельного индикатора в кислой или щелочной среде, нужно взять пипеткой несколько его капель и добавлять их поочерёдно в кислый или щелочной раствор. Кислым раствором может служить столовый уксус, а щелочным — раствор стиральной соды (карбоната натрия). Так, под действием кислоты ярко-синий отвар из цветков ириса станет красным, под действием соды — зелёно-голубым.
2) Взаимодействие с кислотными оксидами: Щёлочь + Кислотный оксид = Соль + Вода – реакция обмена
2KOH + CO2 = K2CO3 + H2O
Ca(OH)2 + CO2 = CaCO3 + H2O
3) Взаимодействие с кислотами: Щёлочь + Кислота = Соль + Вода
Ca(OH)2 + 2HNO3 = Ca(NO3)2 + 2H2O —
Тренажёр
Видео
4) С растворами солей, если в результате образуется осадок: Соль (раствор) + Щёлочь = Нерастворимое основание↓ + Новая соль
FeCI3 + 3NaOH = Fe(OH)3↓ + 3NaCl -реакция обмена
III. Химические свойства нерастворимых оснований
1) С кислотами — реакция обмена: Ме(OH)n↓ + Кислота = Соль + вода
2) Разлагаются при нагревании: Ме(OH)n↓ = MxOy + H2O – реакция разложения
Cu(OH)2 = CuO + H2O или 2Fe(OH)3 = Fe2O3 +3H2O
Внимание! Валентность металла в оксиде и соответствующем гидроксиде одинаковая. IV
Химические свойства амфотерных оснований
IV. Химические свойства амфотерных оснований
1.Реагируют с кислотами: Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
2.Реагируют со щелочами: Zn(OH)2 + 2NaOH = Na2[ Zn(OH)4] – тетрагидроксоцинкат(II) натрия
Интерактивное задание №1 LearningApps.org по теме: “Оксиды и основания”
Интерактивное задание №2 LearningApps.org по теме: “Химические свойства оснований”
ЦОРы
Видео-опыт: “
Видео-опыт: “
Виртуальная образовательная лаборатория: “Определение характера среды раствора с помощью универсального индикатора”
Анимация: “Реакция нейтрализации”
Видео:






























