Содержание в природе
В природе встречается в составе буры или борной кислоты, а также борных руд:
- Ашаритовой
- Борацитовой
- Гидроборацитовой
- Датолитовой
- Турмалиновой и др.
Бор не встречается в природе в свободном состоянии.
Относится к числу рассеянных микроэлементов и в небольших количествах встречается почти повсеместно. Содержится во всех почвах, горных породах, воде морей, рек, озер, и входит в состав растительных и животных организмов. Изверженные горные породы гораздо беднее бором (0,001 % B2O3) по сравнению с осадочными (0,05 – 0,1% B2O3). Значительное количество этого элемента содержится в золе морских водорослей (0,05 – 1% B2O3), каменного угля (0,1 – 0,1%), а также в морской воде (0,46 %).
Биологическая роль
|
3 |
Бор — важный микроэлемент, необходимый для нормальной жизнедеятельности растений. Недостаток бора останавливает их развитие, вызывает у культурных растений различные болезни. В основе этого лежат нарушения окислительных и энергетических процессов в тканях, снижение биосинтеза необходимых веществ. При дефиците бора в почве в сельском хозяйстве применяют борные микроудобрения (борная кислота, бура и другие), повышающие урожай, улучшающие качество продукции и предотвращающие ряд заболеваний растений.
Роль бора в животном организме не выяснена. В мышечной ткани человека содержится (0,33—1)⋅10−4 % бора, в костной ткани (1,1—3,3)⋅10−4 %, в крови — 0,13 мг/л. Ежедневно с пищей человек получает 1—3 мг бора. Токсичная доза — 4 г. ЛД₅₀ ≈ 6 г/кг массы тела.
Один из редких типов дистрофии роговицы связан с геном, кодирующим белок-транспортер, предположительно регулирующий внутриклеточную концентрацию бора.
Нахождение в природе
Среднее содержание бора в земной коре составляет 4 г/т. Несмотря на это, известно около 100 собственных минералов бора; в «чужих» минералах он почти не встречается. Это объясняется, прежде всего, тем, что у комплексных анионов бора (а именно в таком виде он входит в большинство минералов) нет достаточно распространённых аналогов. Почти во всех минералах бор связан с кислородом, а группа фторсодержащих соединений совсем малочисленна. Элементарный бор в природе не встречается. Он входит во многие соединения и широко распространён, особенно в небольших концентрациях; в виде боросиликатов и боратов, а также в виде изоморфной примеси в минералах входит в состав многих изверженных и осадочных пород. Бор известен в нефтяных и морских водах (в морской воде 4,6 мг/л), в водах соляных озёр, горячих источников и грязевых вулканов.
Основные минеральные формы бора:
- боросиликаты: датолит CaBSiO4OH, данбурит CaB2Si2O8;
- бораты: бура Na2B4O7·10H2O, ашарит MgBO2(OH), гидроборацит (Ca, Mg)B6O11·6H2O, иниоит Ca2B6O11·13H2O, калиборит KMg2B11O19·9H2O.
Также различают несколько типов месторождений бора:
- месторождения боратов в магнезиальных скарнах:
- людвигитовые и людвигито-магнетитовые руды;
- котоитовые руды в доломитовых мраморах и кальцифирах;
- ашаритовые и ашарито-магнетитовые руды;
- месторождения боросиликатов в известковых скарнах (датолитовые и данбуритовые руды);
- месторождения боросиликатов в грейзенах, вторичных кварцитах и гидротермальных жилах (турмалиновые концентрации);
- вулканогенно-осадочные:
- борные руды, отложенные из продуктов вулканической деятельности;
- переотложенные боратовые руды в озёрных осадках;
- погребённые осадочные боратовые руды;
- галогенно-осадочные месторождения:
- месторождения боратов в галогенных осадках;
- месторождения боратов в гипсовой шляпе над соляными куполами.
Крупнейшее месторождение России находится в Дальнегорске (Приморье). Оно относится к боросиликатному типу. В этом одном компактном месторождении сосредоточено не менее 3 % всех мировых запасов бора.
Аллотропные модификации
Бор похож на углерод по своей способности образовывать стабильные ковалентно связанные молекулярные сетки. Даже неупорядоченный (аморфный) бор содержит икосаэдрические мотивы B12 кристаллического бора, которые связаны друг с другом без образования дальнего порядка. Кристаллический бор — очень твёрдый чёрный материал с температурой плавления выше 2000 °C. Он образует четыре основные полиморфные формы: α-ромбоэдрический и β-ромбоэдрический (α-R и β-R), γ и β-тетрагональный (β-T); также существует α-тетрагональная фаза (α-T), но ее очень трудно получить в чистом виде. Большинство фаз основаны на икосаэдрических мотивах B12, но γ-фазу можно описать как фазу типа NaCl c чередующимся расположением икосаэдров и атомных пар B2. γ-фазу можно получить путем сжатия других фаз бора до 12—20 ГПа и нагревания до 1500—1800 °C; она остаётся стабильной после понижения температуры и давления. Т-фаза образуется при аналогичных давлениях, но при более высоких температурах (1800—2200 °C). Что касается α и β фаз, то они могут сосуществовать при условиях окружающей среды, причем β-фаза является более стабильной. При сжатии бора выше 160 ГПа образуется фаза бора с неизвестной структурой, которая является сверхпроводящей при температуре 6—12 К.
-
Фазовая диаграмма бора (α и β — ромбоэдрические фазы; T — β-тетрагональная фаза). Известны и другие версии фазовой диаграммы.
-
Структура α-R бора
-
Структура β-R бора
-
Структура γ бора
Экспериментально обнаружены и описаны боросферены (фуллерено-подобные молекулы B40)) и борофены (графено-подобные структуры).
-
Боросферен B40
-
Кристаллическая структура борофенов: (a) β12 борофен (также известен как лист γ фазы или лист υ1/6), (b) χ3 борофен (также известен как лист υ1/5), (b) отдельный лист борофена
-
Кластер B36, который может рассматриваться как минимальный борофен; фронтальный и боковой вид
Биологическая роль
Бор — важный микроэлемент, необходимый для нормальной жизнедеятельности растений. Недостаток бора останавливает их развитие, вызывает у культурных растений различные болезни. В основе этого лежат нарушения окислительных и энергетических процессов в тканях, снижение биосинтеза необходимых веществ. При дефиците бора в почве в сельском хозяйстве применяют борные микроудобрения (борная кислота, бура и другие), повышающие урожай, улучшающие качество продукции и предотвращающие ряд заболеваний растений.
Роль бора в животном организме не выяснена. В мышечной ткани человека содержится (0,33—1)×10-4 % бора, в костной ткани (1,1—3,3)×10-4 %, в крови — 0,13 мг/л. Ежедневно с пищей человек получает 1—3 мг бора. Токсичная доза — 4 г.
Один из редких типов дистрофии роговицы связан с геном, кодирующим белок-транспортер, предположительно регулирующий внутриклеточную концентрацию бора.
Другие заметки по химии
Как был открыт бор
Название химического элемента бор было использовано от названия минерала буры, которое представляет собой соединение из которого добывается бор. Есть сведения о том, что бура и ее минеральный вид использовались в Китае еще в 300 году до нашей эры. В неизвестных записях приблизительно 1600 года упоминается, что буру использовали в качестве флюса в металлургии. Борная кислота была обнаружена в 1777 году в Италии, недалеко от Флоренции. Это соединение стало известно как Sal Sedativum и использовалось исключительно в медицине. Редкий минерал сасолит, который был обнаружен в поселении Сассо (Италия), был главным источником европейской буры в период с 1827 по 1872 год. Затем его заменили источники с Американского континента.
Бор не был признан в качестве отдельного элемента, пока он не был отделен от минерала французскими химиками Хамфри Дэви и Джозефом Луи Гей-Люссаком и Луи Жаком Тенаром. В 1808 году Дэви заметил, что электрический ток, пропускаемый через раствор боратов, вызывает образование коричневого осадка на одном из электродов. В своих последующих экспериментах он использовал калий для восстановления борной кислоты вместо электролиза. Он отделил достаточно бора, чтобы подтвердить наличие нового химического элемента, и назвал его борацием. Гей-Люссак и Тенар использовали железо для восстановления борной кислоты при высоких температурах. Окисляя бор воздухом, они показали, что борная кислота является продуктом окисления бора.

Йенс Якоб Берцелиус выделил бор как новый химический элемент только в 1824 году. Исторических сведений по этому элементу не очень много. По поводу выделения чистого бора, можно предположить, что он был выделен в 1909 году американским химиком Иезекиилем Вайнтраубом.
Читайте: Бериллий как химический элемент таблицы Менделева
Интересные факты

Интересных фактов связанных с бором достаточно много. Начнем с того что бор входит в состав неодимовых магнитов (Nd 2 Fe 14 B), которые являются самыми мощными магнитами в мире. В пример можно поставить компьютерные жесткие диски, в которых неодимовые магниты раскручивают двигатель в приводах. Или в мобильных телефонах эти магниты создают магнитное поле, которое позволяет крошечным динамикам показывать заметную звуковую мощность.
Бор является одним из компонентов триэтилборана, которое представляет собой вещество поджигающее ракетное топливо в турбореактивных двигателях. Борная кислота является популярным фармацевтическим средством. Она обладает противогрибковым, противовирусным и антисептическим действием. Так же бор является важнейшим компонентом препарата бортезомиб. Является первым одобреным средством помогающим против миеломы и лимфомы. На сегодняшний день ведутся множественные разработки препаратов против этих болезней. Так же борная кислота является компонентом многих антисептиков для глаз.
Еще борную кислоту используют для очистки воды в бассейнах. Бор является очень важным питательным веществом для растений, которая оказывает влияние на стенки клеток растения. В уменренных количествах оно улучшает рост и развитие, а в чрезмерных губительно для растений.
Химические свойства
По многим физическим и химическим свойствам неметалл бор напоминает кремний.
Химически бор довольно инертен и при комнатной температуре взаимодействует только со фтором:
При нагревании бор реагирует с другими галогенами с образованием тригалогенидов, с азотом образует нитрид бора BN, с фосфором — фосфид BP, с углеродом — карбиды различного состава (B4C, B12C3, B13C2). При нагревании в атмосфере кислорода или на воздухе бор сгорает с большим выделением теплоты, образуется оксид B2O3:
С водородом бор напрямую не взаимодействует, хотя известно довольно большое число бороводородов (боранов) различного состава, получаемых при обработке боридов щелочных или щелочноземельных металлов кислотой:
При сильном нагревании бор проявляет восстановительные свойства. Он способен, например, восстановить кремний или фосфор из их оксидов:
Данное свойство бора можно объяснить очень высокой прочностью химических связей в оксиде бора B2O3.
При отсутствии окислителей бор устойчив к действию растворов щелочей. Растворяется в расплаве смеси гидроксида и нитрата калия:
В горячей азотной, серной кислотах и в царской водке бор растворяется с образованием борной кислоты H3BO3.
Оксид бора B2O3 — типичный кислотный оксид. Он реагирует с водой с образованием борной кислоты:
При взаимодействии борной кислоты со щелочами возникают соли не самой борной кислоты — бораты (содержащие анион BO3 3− ), а тетрабораты, например:
В 2014 г. исследователями из Германии был получен бис(диазаборолил) бериллия, в котором атомы бериллия и бора образуют двухцентровую двухэлектронную связь (2c-2e), впервые полученную и нехарактерную для соседних элементов в Периодической таблице.
Химические свойства
По многим физическим и химическим свойствам неметалл бор напоминает кремний.
Химически бор довольно инертен и при комнатной температуре взаимодействует только со фтором.
При нагревании бор реагирует с другими галогенами с образованием тригалогенидов, с азотом образует нитрид бора BN, с фосфором — фосфид BP, с углеродом — карбиды различного состава (B4C, B12C3, B13C2). При нагревании в атмосфере кислорода или на воздухе бор сгорает с большим выделением теплоты, образуется оксид B2O3.
С водородом бор напрямую не взаимодействует, хотя известно довольно большое число бороводородов (боранов) различного состава, получаемых при обработке боридов щелочных или щелочноземельных металлов кислотой.
При сильном нагревании бор проявляет восстановительные свойства. Он способен, например, восстановить кремний или фосфор из их оксидов. Данное свойство бора можно объяснить очень высокой прочностью химических связей в оксиде бора B2O3.
При отсутствии окислителей бор устойчив к действию растворов щелочей. В горячей азотной, серной кислотах и в царской водке бор растворяется с образованием борной кислоты Н3ВО3.
Оксид бора B2O3 — типичный кислотный оксид. Он реагирует с водой с образованием борной кислоты.
При взаимодействии борной кислоты со щелочами возникают соли не самой борной кислоты — бораты (содержащие анион BO33-), а тетрабораты.
Нахождение в природе
Содержание углерода в земной коре 0,1 % по массе. Свободный углерод находится в природе в виде алмаза и графита. Основная масса углерода в виде природных карбонатов (известняки и доломиты), горючих ископаемых — антрацит (94—97 % С), бурые угли (64—80 % С), каменные угли (76—95 % С), горючие сланцы (56—78 % С), нефть (82—87 % С), горючих природных газов (до 99 % метана), торф (53—56 % С), а также битумы и др. В атмосфере и гидросфере находится в виде диоксида углерода СО2, в воздухе 0,046 % СО2 по массе, в водах рек, морей и океанов в ~60 раз больше. Углерод входит в состав растений и животных (~18 %).
В организм человека углерод поступает с пищей (в норме около 300 г в сутки). Общее содержание углерода в организме человека достигает около 21 % (15 кг на 70 кг массы тела). Углерод составляет 2/3 массы мышц и 1/3 массы костной ткани. Выводится из организма преимущественно с выдыхаемым воздухом (углекислый газ) и мочой (мочевина).
Кругооборот углерода в природе включает биологический цикл, выделение СО2 в атмосферу при сгорании ископаемого топлива, из вулканических газов, горячих минеральных источников, из поверхностных слоев океанических вод и др. Биологический цикл состоит в том, что углерод в виде СО2 поглощается из тропосферы растениями. Затем из биосферы вновь возвращается в геосферу: с растениями углерод попадает в организм животных и человека, а затем при гниении животных и растительных материалов — в почву и в виде СО2 — в атмосферу.
В парообразном состоянии и в виде соединений с азотом и водородом углерод обнаружен в атмосфере Солнца, планет, он найден в каменных и железных метеоритах.
Большинство соединений углерода, и прежде всего углеводороды, обладают ярко выраженным характером ковалентных соединений. Прочность простых, двойных и тройных связей атомов С между собой, способность образовывать устойчивые цепи и циклы из атомов С обусловливают существования огромного числа углеродсодержащих соединений, изучаемых органической химией.
В природе встречается минерал шунгит,в котором содержится как твердый углерод (≈25%), так и значительные количества оксида кремния (≈35%).
Где и как добывают бор

В природе бор содержится только в виде химических соединений. Добыча бора осуществляется в своей основе из боросодержащих минералов. Такими минералами являются колеманит, кернит (расорит), улексит и тинкал. Эти экономически важные минералы составляют 90% от общей массы борной руды. Крупнейшие месторождения борной буры находятся в Центральной и Западной Турции. Эти месторождения находятся в провинциях Эскишехир, Кютахья и Балыкесир. Большая часть этих месторождений еще не освоено.
Турция, США и Россия являются лидерами в бородобывающей отрасли. Годовой спрос на бор находится в пределах 4 миллионов тонн. Около 50% от этой цифры приходится на добычу в турецком месторождении. Почти 1/4 от общего объема добывает США в боровом руднике в штате Калифорния. Очищение бора от других химических соединений в борной руде осуществляется в основном методом пиролиза. Этот метод заключается в отделении бора от других элементов коротким нагреванием до высоких температур ( около 750°C ) при очень низком давлении. Вообще, методов отделения бора достаточно много. Например, оксиды могут отделяться методом электролиза или восстановлением магнием и натрием с выделением водорода и т.д. Россия в этом плане отстает от своих конкурентов, добыча бора осуществляется в Дальнегорске. Это месторождение является крупнейшим месторождением в РФ.
Читайте: Литий как химический элемент таблицы Менделеева
Где будет использоваться борный рудник?
Борный рудник, который в настоящее время используется в качестве добавки к авиационному топливу, в ближайшие годы планируется использовать в наземных и морских транспортных средствах. В результате исследований ожидается, что использование борной мины в качестве опоры для аккумуляторов будет в 3 раза мощнее, чем аккумуляторы. Благодаря этому решатся проблемы с питанием аккумуляторных батарей электромобилей за счет увеличения мощности борных минных батарей.
Кроме того, до сих пор ведутся исследования с точки зрения использования борного рудника вместо других рудников. Если в результате этих исследований будут получены положительные результаты, наша страна обретет большую стратегическую мощь. Борный рудник имеет большое значение благодаря своей легкости, снижению трения, энергоэффективности и термостойкости. Все эти детали показывают будущую любовь мира к этому элементу. Если не будет проблем с намеченными планами, наша страна будет иметь большое процветание в этом отношении и укрепит себя экономически.
Методы переработки и обогащения боросиликатных руд
Потребители боропродуктов (химическая, металлургическая, строительная промышленность и др.) стремятся, как правило, применять возможно более концентрированное сырье, что позволяет интенсифицировать их процессы и получать продукцию лучшего качества с меньшими затратами.
Впервые в мировой практике в России разработаны способы обогащения боросиликатных руд с получением датолитового концентрата, производства борной кислоты и бората кальция из датолитового концентрата, производства из борной кислоты пербората натрия, безводных кислородных боропродуктов, производства элементарного бора и других его соединений.
Результаты внедрения этих процессов решили проблему обеспечения боропродуктами потребности народного хозяйства страны, ускорили развитие новейших научных направлений в производстве изоляционного и текстильного стекловолокна, боросиликатного стекла, термобора, нитридов бора как волокно, так и порошкообразного, свойства которого позволяют его использовать при чрезвычайно высоких параметрах давления и температур, в производстве карбида бора, материала, применяемого для абразивных целей и в качестве экранов от ядерного излучения, и позволили обеспечить традиционных потребителей бора — металлургию, строительную индустрию (стеклокерамика, эмали, стекловолокно, стекловата), сельское хозяйство, лесное хозяйство, электронику, ядерную энергетику и т. д.
Основные способы обогащения борсодержащего сырья: радиометрическое обогащение, обогащение в тяжелых средах, электромагнитная сепарация, флотация, термическая и химическая переработка.
С целью повышения содержания полезного компонента в природном сырье проводят предварительное обогащение сырья с применением радиометрической сепарации и обогащения в тяжелых средах по типовым схемам цикла.
Схема магнитного обогащения приведена на рис. 7.13.
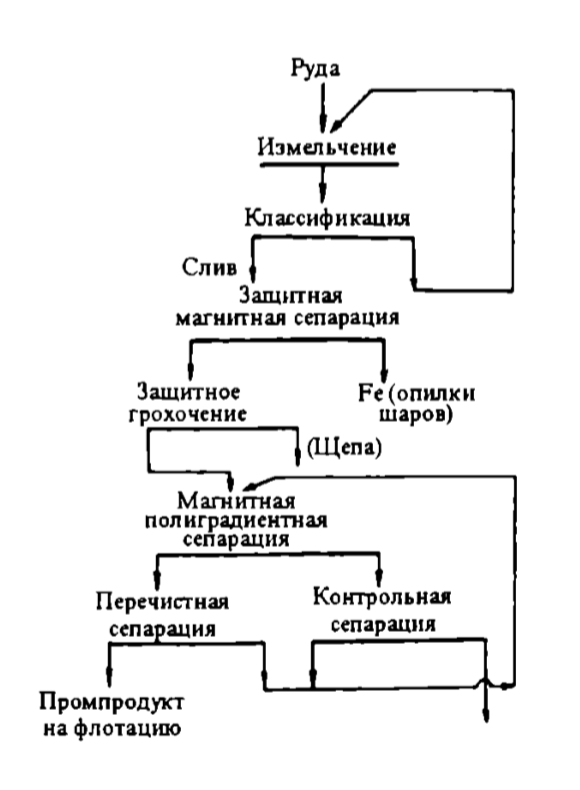
Рис. 7.13. Схема магнитного обогащения с применением высокоградиентных сепараторов
По данной схеме (рис. 7.13) руда, измельченная до крупности -0,074 мм (65 %) в шаровой мельнице, работающей в замкнутом цикле со спиральным классификатором, плотностью 25—27 % твердого поступает на магнитный сепаратор со слабым магнитным полем для отделения металлических опилок и затем направляется на грохочение для отделения крупных классов и щепы. Подрешетный продукт грохота поступает в основной полиградиентный сепаратор. Магнитная индукция в рабочей зоне составляет 1,7—2,4 Тл. Магнитная фракция поступает на контрольную сепарацию, магнитная фракция контрольной сепарации — в отвал. Немагнитная фракция основной магнитной сепарации поступает на перечистную сепарацию, немагнитная фракция перечистной сепарации — на флотацию, а магнитная фракция перечистной сепарации и немагнитная фракция контрольной сепарации — в голову основной сепарации.
По данной схеме получают промпродукт с содержанием Fe2O3 = 3,46 %, B2O3 = 12,4 %, который при дальнейшем обогащении флотационным методом доводится до концентрата с содержанием Fe2O3 = 2,5 % и B2O3 = 17 %.
Принципиальная коллективно-селективная схема флотационного обогащения боросиликатных руд приведена на рис. 7.14.
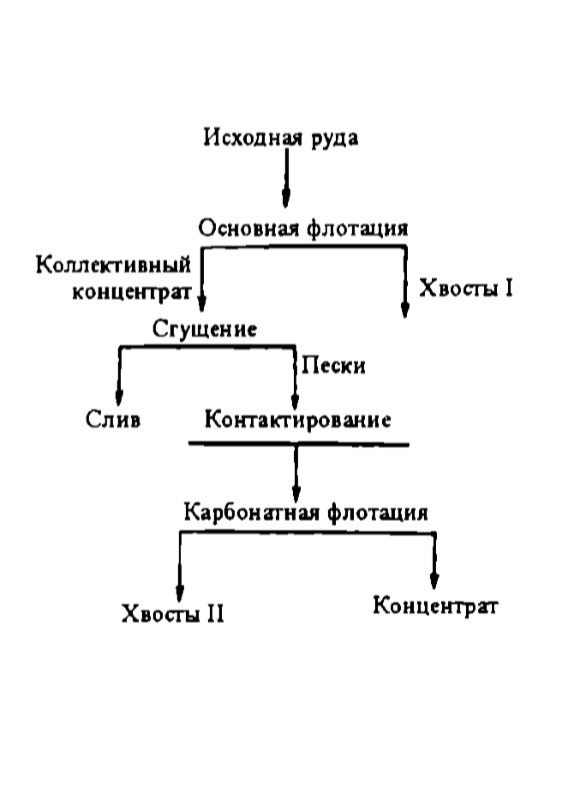
Рис. 7.14. Принципиальная коллективно-селективная схема флотационного обогащения боросиликатных руд
Схема флотационного обогащения (см. рис. 7.14) состоит из четырех основных операций:
- • основной коллективной флотации с получением датолит-кальцитового концентрата и выделением отвальных хвостов;
- • сгущения датолит-кальцитового концентрата;
- • контактирования датолит-кальцитового концентрата с реагентами;
- • карбнатной флотации датолит-кальцитового концентрата с выделением в пену кальцитового концентрата.
Флотационный процесс характеризуется подачей в основную флотацию едкого натра (1 кг/т), а затем жидкого мыла (0,18 кг/т) четырьмя порциями, жидкого стекла (2 кг/т) и медного купороса (1 кг/т) в контактный агрегат, жидкого мыла (1,4 кг/т) в четыре точки карбонатной флотации, температурой флотации 60 °С.
Биологическая роль
Бор — важный микроэлемент, необходимый для нормальной жизнедеятельности растений. Недостаток бора останавливает их развитие, вызывает у культурных растений различные болезни. В основе этого лежат нарушения окислительных и энергетических процессов в тканях, снижение биосинтеза необходимых веществ. При дефиците бора в почве в сельском хозяйстве применяют борные микроудобрения (борная кислота, бура и другие), повышающие урожай, улучшающие качество продукции и предотвращающие ряд заболеваний растений.
Роль бора в животном организме не выяснена. В мышечной ткани человека содержится (0,33—1)⋅10−4 % бора, в костной ткани (1,1—3,3)⋅10−4 %, в крови — 0,13 мг/л. Ежедневно с пищей человек получает 1—3 мг бора. Токсичная доза — 4 г. ЛД₅₀ ≈ 6 г/кг массы тела.
Один из редких типов дистрофии роговицы связан с геном, кодирующим белок-транспортер, предположительно регулирующий внутриклеточную концентрацию бора.
Биологическая роль
Бор — важный микроэлемент, необходимый для нормальной жизнедеятельности растений. Недостаток бора останавливает их развитие, вызывает у культурных растений различные болезни. В основе этого лежат нарушения окислительных и энергетических процессов в тканях, снижение биосинтеза необходимых веществ. При дефиците бора в почве в сельском хозяйстве применяют борные микроудобрения (борная кислота, бура и другие), повышающие урожай, улучшающие качество продукции и предотвращающие ряд заболеваний растений.
Роль бора в животном организме не выяснена. В мышечной ткани человека содержится (0,33—1)×10-4 % бора, в костной ткани (1,1—3,3)×10-4 %, в крови — 0,13 мг/л. Ежедневно с пищей человек получает 1—3 мг бора. Токсичная доза — 4 г.
Один из редких типов дистрофии роговицы связан с геном, кодирующим белок-транспортер, предположительно регулирующий внутриклеточную концентрацию бора.
| 6. Углерод-Carboneum (C) |
Применение бора
Не смотря на трудное производство и небольшое обилие бора, его применение является очень разнообразным. Причем применение бора захватывает очень широкий круг услуг и товаров. Для справки, на 2012 год цена бора за 1 грамм оценивалась в 5 долларов США. На сегодняшний день, мировой спрос на бор составляет около 20 миллионов тонн в год.
Основными промышленными потребителями бора являюися изготовители стекловолокна, как изолирующего элемента. К стеклу добавляется либо оксид, либо пентагидрата буры для изменения прочности или текучести продукта. На эти цели отводится около 46% производимого бора. Следующей областью применения является изготовление высокопрочной стекольной посуды из боросиликатного стекла. На эти цели приходится около 10% от общего количества потребляемого бора. Около 15% потребляемого бора приходится на производство высокопрочной керамики. Сельскохозяйственные нужды занимают около 11% производимого бора. В основном на производство удобрений и средств от насекомых. Еще около 6% приходится на бытовую химию, которая включает порошки, моющие средства и отбеливатели. Оставшаяся часть идет на другие нужды, такие как производство магнитов, экранирования нейтронов в ядерных реакторах и фармацевтика.
Читайте: Водород как химический элемент таблицы Менделеева
История
Углерод в виде древесного угля применялся в глубокой древности для выплавки металлов. Издавна известны аллотропные модификации углерода — алмаз и графит.
На рубеже XVII—XVIII вв. возникла теория флогистона, выдвинутая Иоганном Бехером и Георгом Шталем. Эта теория признавала наличие в каждом горючем теле особого элементарного вещества — невесомого флюида — флогистона, улетучивающегося в процессе горения. Так как при сгорании большого количества угля остается лишь немного золы, флогистики полагали, что уголь — это почти чистый флогистон. Именно этим объясняли, в частности, «флогистирующее» действие угля, — его способность восстанавливать металлы из «известей» и руд. Позднейшие флогистики, Реомюр, Бергман и другие, уже начали понимать, что уголь представляет собой элементарное вещество. Однако впервые таковым «чистый уголь» был признан Антуаном Лавуазье, исследовавшим процесс сжигания в воздухе и кислороде угля и других веществ. В книге Гитона де Морво, Лавуазье, Бертолле и Фуркруа «Метод химической номенклатуры» (1787) появилось название «углерод» (carbone) вместо французского «чистый уголь» (charbone pur). Под этим же названием углерод фигурирует в «Таблице простых тел» в «Элементарном учебнике химии» Лавуазье.
В 1791 году английский химик Теннант первым получил свободный углерод; он пропускал пары фосфора над прокалённым мелом, в результате чего образовывались фосфат кальция и углерод. То, что алмаз при сильном нагревании сгорает без остатка, было известно давно. Ещё в 1751 г. французский король Франц I согласился дать алмаз и рубин для опытов по сжиганию, после чего эти опыты даже вошли в моду. Оказалось, что сгорает лишь алмаз, а рубин (окись алюминия с примесью хрома) выдерживает без повреждения длительное нагревание в фокусе зажигательной линзы. Лавуазье поставил новый опыт по сжиганию алмаза с помощью большой зажигательной машины и пришёл к выводу, что алмаз представляет собой кристаллический углерод. Второй аллотроп углерода — графит — в алхимическом периоде считался видоизменённым свинцовым блеском и назывался plumbago; только в 1740 г. Потт обнаружил отсутствие в графите какой-либо примеси свинца
Шееле исследовал графит (1779) и, будучи флогистиком, счёл его сернистым телом особого рода, особым минеральным углём, содержащим связанную «воздушную кислоту» (СО2) и большое количество флогистона.
Двадцать лет спустя Гитон де Морво путем осторожного нагревания превратил алмаз в графит, а затем в угольную кислоту.
Где используется бор?
Борсодержащий рудник, краситель для кожи, инсектициды, гербициды, электронная очистка, косметика, медицина, ингибиторы коррозии цемента, клеи, огнеупоры, дезинфицирующие средства, катализаторы, нейлон, удобрения, огнестойкие материалы, технология ядерного топлива, медицинская промышленность, текстильное стекло волокно, борсодержащие сплавы, Металлургический флюс, Изолированное стекловолокно, Силикат бора, Антисептики, очки для медицинской промышленности, электрические очки, производство борной кислоты, фотография, краска, текстиль, металлургические приложения, устойчивые к прикреплению материалы, промышленность моющих средств, мыловаренная промышленность, промышленность покрытий , эмалевая промышленность, участки стекольной промышленности.
Когда этот рудник стратегически извлекается из почвы, он входит в число промышленных рудников, которые можно использовать как в качестве продуктов рафинированного бора, так и в качестве сырья во всех сферах жизни человека.
Невозможно отрицать вклад этой шахты в опыт и доступ к бору, который используется в космической технике в мире, а также в информационную и электронную эпоху. Scientific American, один из научных журналов в мире, сообщил, что они разработали автомобиль, в котором соединения из бора могут использоваться вместо масла. Вопросы, связанные с использованием борной шахты в транспортных средствах, давно стоят в повестке дня западных компаний.
Физические свойства
Чрезвычайно твёрдое вещество (уступает только алмазу, нитриду бора (боразону), карбиду бора, сплаву бор-углерод-кремний, карбиду скандия-титана). Обладает хрупкостью и полупроводниковыми свойствами (широкозонный полупроводник).
У бора — самый высокий предел прочности на разрыв 5,7 ГПа.
Изотопы бора
В природе бор находится в виде двух изотопов 10 B (19,8 %) и 11 B (80,2 %).
10 B имеет очень высокое сечение захвата тепловых нейтронов, равное 3837 барн (для большинства нуклидов это сечение близко к единицам или долям барна), причём при захвате нейтрона образуются два нерадиоактивных ядра (альфа-частица и литий-7), очень быстро тормозящиеся в среде, а проникающая радиация (гамма-кванты) при этом отсутствует, в отличие от аналогичных реакций захвата нейтронов другими нуклидами:
10 B + n → 11 B* → α + 7 Li + 2,31 МэВ.
Поэтому 10 B в составе борной кислоты и других химических соединений применяется в атомных реакторах для регулирования реактивности, а также для биологической защиты от тепловых нейтронов. Кроме того, бор применяется в нейтрон-захватной терапии рака.
Кроме двух стабильных, известно ещё 12 радиоактивных изотопов бора, из них самым долгоживущим является 8 B с периодом полураспада 0,77 с.
Химические свойства
По многим физическим и химическим свойствам неметалл бор напоминает кремний.
Химически бор довольно инертен и при комнатной температуре взаимодействует только со фтором:
При нагревании бор реагирует с другими галогенами с образованием тригалогенидов, с азотом образует нитрид бора BN, с фосфором — фосфид BP, с углеродом — карбиды различного состава (B4C, B12C3, B13C2). При нагревании в атмосфере кислорода или на воздухе бор сгорает с большим выделением теплоты, образуется оксид B2O3:
-
4 B + 3 O 2 ⟶ 2 B 2 O 3
С водородом бор напрямую не взаимодействует, хотя известно довольно большое число бороводородов (боранов) различного состава, получаемых при обработке боридов щелочных или щелочноземельных металлов кислотой:
При сильном нагревании бор проявляет восстановительные свойства. Он способен, например, восстановить кремний или фосфор из их оксидов:
-
3 SiO 2 + 4 B ⟶ 3 Si + 2 B 2 O 3
-
3 P 2 O 5 + 10 B ⟶ 5 B 2 O 3 + 6 P
Данное свойство бора можно объяснить очень высокой прочностью химических связей в оксиде бора B2O3.
При отсутствии окислителей бор устойчив к действию растворов щелочей. Растворяется в расплаве смеси гидроксида и нитрата калия:
-
2 B + 2 KOH + 3 KNO 3 → t 2 KBO 2 + 3 KNO 2 + H 2 O
В горячей азотной, серной кислотах и в царской водке бор растворяется с образованием борной кислоты H3BO3:
Оксид бора B2O3 — типичный кислотный оксид. Он реагирует с водой с образованием борной кислоты:
-
B 2 O 3 + 3 H 2 O ⟶ 2 H 3 BO 3
При взаимодействии борной кислоты со щелочами возникают соли не самой борной кислоты — бораты (содержащие анион BO33−), а тетрабораты, например:
-
4 H 3 BO 3 + 2 NaOH ⟶ Na 2 B 4 O 7 + 7 H 2 O
В 2014 г. исследователями из Германии был получен бис(диазаборолил) бериллия, в котором атомы бериллия и бора образуют двухцентровую двухэлектронную связь (2c-2e), впервые полученную и нехарактерную для соседних элементов в Периодической таблице.




























