Ссылки
- Selectin. Получено с: en.wikipedia.org.
- L-селектин. Получено с: en.wikipedia.org.
- CA19-9. Получено с: en.wikipedia.org.
- E-selectin. Получено с: en.wikipedia.org.
- X. Zou, V.R. Шинде Патил, Н. Дагия, Л.А. Смит, М.Дж. Варго, К.А. Интерлигги, К. Ллойд, Д.Ф. Тис, Б. Уолчек, М. Лоуренс, Д.Дж. Гетц (2005). PSGL-1, полученный из нейтрофилов человека, является высокоэффективным лигандом для экспрессируемого эндотелием E-селектина в потоке. Американский журнал физиологии. Клеточная физиология.
- К. Закон (2001). Функции селектинов. Результаты и проблемы дифференцировки клеток.
- Selectins. Получено с: wellpath.uniovi.es.
- J.H. Перес и К.Дж. Монтойя. Молекулы адгезии. Получено с: encolombia.com.
- A.C. Сангвинети и Дж. М. Родригес-Тафур (1999). Адгезия и молекулы кожи. Перуанская дерматология.
- Т.Ф. Теддер, Д.А. Стибер, А. Чен, П. Энгель (1995). Селектины: молекулы сосудистой адгезии. Журнал FASEB.
Лектины и пищеварение
Многие люди страдают непереносимостью глютена — наиболее известного из пшеничных лектинов, который воздействует на клетки внутренней оболочки тонкого кишечника, вызывая раздражение и воспаление тканей.
Обнаружено, что некотрые другие лектины, например арахиса и соевых бобов, также оказывают неблагоприятное воздействие на кишечник, вызывая симптомы, неотличимые от целиакии. Установлено, что оболочка кишечника людей, страдающих колитами, болезнью Крона и другими воспалительными заболеваниями кишечника, очень чувствительна к воздействию пищевых лектинов. Скорее всего причиной является нарушение микробиологического равновесия в желудочно кишечном тракте. Угнетение бактерий симбиотов (бифидумбактерий , лактобактерий, дружественных видов кишечной палочки) гельминтами, вирусами, грибками, антибиотиками, бродильными и гнилостными бактериями.
Пищевые лектины, взаимодействующие с тканями желудочно-кишечного тракта, стимулируют выработку гистамина — вещества, вызывающего симптомы аллергии. Лектины и сами являются основной причиной пищевой аллергии. Они повышают проницаемости стенок кишечника и повреждают его внутреннюю оболочку., Лектины и крупные белковые молекулы аллергены попадают в кровь и разрушительно действуют на организм.
Больше всего вреда приносит лектин пшеничных зародышей. Вот вывод ученных после одного из многочисленных исследований: «…заметное количество поступившего с пищей лектина пшеничных зародышей всасывается через стенки кишечника в кровь, а затем оседает на стенках кровеносных и лимфатических сосудов».
Помимо этого, лектин пшеничных зародышей стимулирует увеличение поджелудочной железы с одновременным уменьшением размеров тимуса (вилочковой железы), от деятельности которого зависит работа иммунной системы.
Лектины нарушают переваривание пищи и ухудшают усвоение питательных веществ. Замечено, что после добавления в корм животных лектина пшеничных зародышей наблюдалось резкое снижение активности мальтазы — фермента, под действием которого в тонком кишечнике происходит расщепление молекул сложных сахаров на простые, а также снижение активности аминопептидазы, фермента, расщепляющего белки на аминокислоты.

Лектины могут вызывать увеличение органов из-за высвобождения полиаминов — веществ, усиливающих действие стимуляторов роста. В ряде экспериментов было продемонстрировано увеличение размеров печени, кишечника и поджелудочной железы у лабораторных животных после употребления пищевых лектинов.
Существуют лектины,которые воздействуют на поверхностные рецепторы белых кровяных клеток, вызывая их быстрое размножение. Это лектины-митогены (митоз — процесс воспроизводства клеток). Причем лектины, действующие на один вид клеток могут быть нейтральными по отношению к другим видам.
Лектины активируют антитела при аутоиммунных заболеваниях. В крови каждого человека есть антитела к лектинам. Например, есть данные что антитела, вырабатывающиеся в организме при ревматоидном артрите, требуют активации лектином пшеничных зародышей. При исключении из рациона овощей семейства пасленовых (помидоров и картофеля) многие люди, страдающие артритами, начинают чувствовать себя несколько лучше. И это неудивительно, ведь в овощах семейства пасленовых содержится очень много лектинов.
Нервная ткань очень чувствительна к воздействию пищевых лектинов
Некоторые исследователи обратили внимание, что низкоаллергенное питание оказывает положительный эффект при ряде неврологических расстройств, в том числе нарушении активности и внимания у детей. Не исключено, что свой вклад в улучшение состояния больных при этом вносит и одновременное уменьшение количества лектинов, попадающих в организм
Российские исследователи обратили внимание на то, что при шизофрении ткани мозга становятся более чувствительными к воздействию некоторых лектинов, содержащихся в популярных продуктах питания.
характеристики
Все белки селектины содержат олигосахариды цепей, ковалентно связанные с боковыми цепями аминокислот (гликопротеины). Они являются трансмембранными молекулами, что означает, что они пересекают липидный бислой клетки либо за один этап (один этап), либо за несколько этапов (многоступенчатый).
Они имеют общие характеристики, очень похожие на белки CLEC или лектины типа C. Поскольку, как и лектины типа C, селектинам для связывания требуются ионы кальция.
Происхождение слова «селектин» относится к тому факту, что эти белки избирательно экспрессируются в клетках сосудистой системы, а также содержат лектиновый домен.
Некоторые авторы включают селектины (гликопротеины) в состав лектинов, потому что это молекулы, которые связываются с сахарами. Однако другие авторы разделяют их на основании концепции, согласно которой лектины только распознают углеводы и связываются с ними, в то время как селектины не только распознают и связывают сахара, но также состоят из углеводов.
Регуляция селектинов происходит на уровне транскрипции через протеолитический процессинг, классификацию клеток и регулируемую экспрессию гликозилтрансфераз.
Селектины имеют короткий внутриклеточный домен. Однако они имеют три внеклеточных домена, домен, подобный эпидермальному фактору роста, домен, подобный лектину, и консенсусные повторяющиеся единицы, аналогичные регуляторным белкам комплемента.
PRR в медицине применительно к людям
За последние пять лет несколько исследовательских групп провели исследования участия и потенциального использования иммунной системы пациента в лечении многочисленных патологий: стратегия, получившая название иммунотерапии. Он включает в себя такие методы лечения, как моноклональные антитела, неспецифическая иммунотерапия, вирусно-онколитическая терапия, противораковые вакцины, Т-клеточная терапия.
Цели, связанные с NOD2
NOD2 был связан с болезнью Крона через мутацию потери и приобретения и саркоидоз с ранним началом. Мутации NOD2 в сочетании с факторами окружающей среды приводят к хроническому воспалению кишечника. Поэтому была предложена стратегия борьбы с этим заболеванием путем ингибирования небольших молекул, которые способны модулировать передачу сигналов NOD2, в частности, RIP2.
FDA одобрило две терапевтические стратегии (гефитиниб и эрлотиниб): они ингибируют фосфорилирование RIP2, необходимое для правильного функционирования NOD2.
Также были проведены исследования GSK583, высокоспецифичного ингибитора RIP2, который, по-видимому, хорошо ингибирует передачу сигналов NOD1 и NOD2 и, следовательно, ограничивает воспаление, опосредованное сигнальными путями NOD1 и NOD2.
На моделях мышей было показано, что другой терапевтической стратегией, направленной на устранение симптомов болезни Крона, может быть удаление «сенсора» NOD2. Высокоспецифичные ингибиторы киназы II типа демонстрируют большой потенциал в ограничении TNF, который продуцируется ниже NOD-зависимых путей, поэтому они доказывают, что они являются потенциальными мишенями для лечения опухолей, связанных с воспалением.
Helicobacter Pylori
Прямая корреляция между PRR и здоровьем человека обнаружена при злокачественных опухолях желудка. Многочисленные исследования показали, что наличие Helicobacter Pylori коррелирует с возникновением и развитием опухолей желудочно-кишечного тракта. У здорового человека об инфекции Helicobacter Pylori сообщается по большому количеству PRR, таких как TLR, NLR, RLR и CLR DC-SIGN. В случае их нарушения эти рецепторы могут быть связаны с канцерогенезом.
Когда инфекция Helicobacter Pylori распространяется на кишечник, это приводит к хроническому воспалению, атрофии и, в конечном итоге, к дисплазии, что приводит к развитию рака. Поскольку все типы PRR играют роль в идентификации и уничтожении бактерий, их специфические агонисты вызывают сильный иммунный ответ в ответ на рак и другие родственные PRR. Было показано, что ингибирование TLR2 коррелирует с подавлением аденокарциномы желудка и улучшением здоровья пациентов.
Ссылки
- Белки клеточной адгезии
- Кластеры дифференцировки
Wikimedia Foundation . 2010 .
Смотреть что такое «Селектин» в других словарях:
P-селектин — Обозначения Символы SELP; CD62, PSEL, PADGEM, GMP140, CD62P Entrez Gene … Википедия
E-селектин — Обозначения Символы SELE; ESEL, CD62E Entrez Gene … Википедия
L-селектин — Обозначения Символы SELL; LSEL, LAM1, LAM 1, hLHRc, Leu 8, Lyam 1, PLNHR, CD62L Entrez Gene … Википедия
Тельца Вейбеля–Паладе — Тельца Вейбеля Паладе особые везикулы в клетках сосудистого эндотелия, которые содержат фактор фон Виллебранда и P селектин и секретируют их в случае активации эндотелия при повреждении ткани. Могут быть сферической, овальной или продолговатой… … Википедия
1-я хромосома человека — Идиограмма 1 й хромосомы человека 1 я хромосома человека самая большая из 23 человеческих хромосом, одна из 22 аутосом человека. Хромосома содержит около 248 млн пар оснований … Википедия
Тельца Вейбеля — Паладе особые везикулы в клетках сосудистого эндотелия, которые содержат фактор фон Виллебранда и P селектин и секретируют их в случае активации эндотелия при повреждении ткани. Могут быть сферической, овальной или продолговатой формы. Содержание … Википедия
Т-клетки памяти — Лимфоцит показан в центре изображения Т клетки памяти хранят информацию о ранее действовавших антигенах и формируют вторичный иммунный ответ, осуществляющийся в более короткие сроки, чем первичный иммунный ответ, так как минует основные стадии… … Википедия
Нейтрофилы
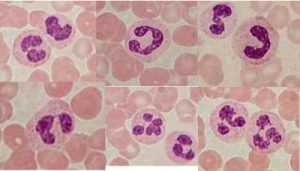 Активация и распознавание образов нейтрофильными гранулоцитами (часто обозначаемые ПЯЛ — полиморфноядерные лейкоциты) способны непосредственно распознавать и фагоцитировать многие бактерии, но не самые важные полисахаридно-капсулированные патогены. Эти агенты распознаются и фагоцитируются после опсонизации комплементом через рецепторы комплемента на нейтрофиле.
Активация и распознавание образов нейтрофильными гранулоцитами (часто обозначаемые ПЯЛ — полиморфноядерные лейкоциты) способны непосредственно распознавать и фагоцитировать многие бактерии, но не самые важные полисахаридно-капсулированные патогены. Эти агенты распознаются и фагоцитируются после опсонизации комплементом через рецепторы комплемента на нейтрофиле.
Как нейтрофилы находят свой путь из крови к месту их действия? С места инфицирования множество молекул диффундируют во всех направлениях, в конечном итоге достигая эндотелиальных клеток соседних сосудов. Эти молекулы включают LPS (липополисахарид) бактерий, C3a, C4a, C5a и сигнальные молекулы из первых локальных макрофагов, например хемокин IL-8, TNF и лейкотриен B4. Эндотелиальные клетки быстро реагируют на эти сигналы изменением картины экспрессии новых белков, таких как ICAM-1 и ICAM-2, на их мембранах, которые затем жестко связываются с контактными белками нейтрофилов и других лейкоцитов.
Нейтрофилы обычно перекатываются вдоль эндотелия динамическими контактами между углеводами сиалированного антигена Lex и белками селектинами на плазматической мембране эндотелия. Связывание ICAM с помощью ПЯЛ-интегринов приводит к внезапной остановке нейтрофилов. Они протискиваются между двумя эндотелиальными клетками и по хемотаксическому градиенту перемещаюся к очагу инфекции. Там нейтрофилы фагоцитируют и убивают бактерии. В процессе фагоцитоза они быстро умирают, поскольку суровые условия, необходимые для уничтожения бактерий, приводят к непоправимому повреждению клеток.(Кл) Их апоптотические тела поглощаются макрофагами.
Источники и структура
Лектины являются гликопротеины , которые находятся в высокой концентрации в большинстве семян из сухих бобовых ( чечевица , фасоль , горох ), зерновые культуры , но и более широко распространены в природе (других семейств растений, грибов и животных тоже).
Первый идентифицированный лектин, известный как гемаглютинин , был выделен из гороха Canavalia ensiformis Петером Германом Стилмарком в 1888 году (Университет Дорпата , Россия ). Очищенная активное соединение представляет собой конканавалин А . Другой популярный лектин — высокотоксичный рицин, получаемый из клещевины . В настоящее время лектины выделяются в больших масштабах и коммерчески разрабатываются для характеристики гликозилированных молекул в протеомике , клеточных структур в клеточной биологии , для очистки гликозилированных молекул и, прежде всего, для фенотипирования клеток крови.
Различают четыре типа лектинов: лектины C, лектины p-типа, лектины l-типа и лектины галектина.
Примечания и ссылки
- Дефранко / Робертсон / Локсли, Иммунитет, иммунный ответ при инфекционно-воспалительных заболеваниях, под ред. Дебок, 2009, стр. 32 , ( ISBN 978-2-8041-5957-3 ) (уведомление BnF п о )
- (в) , ИНТЕРХИМ,2010 г.(доступ 5 мая 2010 г. )
- (in) Андреас Шаллер, Индуцированная устойчивость растений к травоядным , Springer Science & Business Media,2008 г., стр. 291
- С.С., Кавита, М., Свами, М.Дж. Комат , Органическая и биомолекулярная химия, т. 4 ,2006 г., стр. 973–988
- (ru) Элс. JM Van Damme, Willy J. Peumans, Arpad Pusztai, Susan Bardocz, Van Damme EJM, Peumans WJ, Pusztai A., S. Справочник по растительным лектинам: свойства и биомедицинское применение , Wiley ,1998 г., стр. 31–50
- Кацуя Мияке , Тору Танака , Пол Л. Макнил и Ричард Стейнхардт , « (in) Пищевое отравление на основе лектина: новый механизм токсичности белка. », PLoS One , т. 1,2007 г., e687 ( DOI )
- (in) Нил Р. Карлсон , Физиология поведения, 9- е изд. , Бостон, Pearson Education, Inc.,2007 г., 734 с. ( ISBN 978-0-205-46724-2 ) , стр. 144
Биологические функции[править | править код]
Хотя у животных лектины нередко оказывают влияние на процессы в иммунной системе и, как рицин, могут иметь некоторые ферментативные функции, большинство лектинов ферментами не являются и не имеют никакого отношения к иммунитету. Они могут связывать как растворенные углеводы, так и функциональные группы углеводов в составе гликопротеинов или гликолипидов.
Олигосахарид (показан серым), связанный в активном центре растительного лектина (изолектин IV из Griffonia simplicifolia в комплексе с детерминантом группы крови Lewis b). Для ясности показана только часть олигосахарида.
Функции у животныхправить | править код
Лектины и лектиноподобные компоненты выполняют множество разнообразных физиологических функций, в частности, в регуляции клеточной адгезии, синтеза гликопротеинов или уровня белка в крови. Например, они оказывают влияние на процессы активации лимфоцитов в процессе иммунного ответа, а также на эффекторные фазы — комплемент-зависимую и Т-клеточную цитотоксичность. Лектины оказывают митогенный эффект и вызывают бласт-трансформацию лейкоцитов (когда лейкоцит превращается в лейкобласт и начинает делиться). Некоторые лектины, находясь на поверхности клеток печени, связывают галактозу, удаляя ее из крови. Другие лектины являются рецепторами ферментов, содержащих остатки маннозы. Одним из самых известных лектинов, связывающих маннозу, является компонент лектинового пути активации комплемента, который составляет часть системы врожденного иммунитета.
Функции у растенийправить | править код
Функции растительных лектинов до конца еще не изучены. Поскольку их много в семенах растений, предполагают, что они участвуют в прорастании семени. Как и у животных, одной из функций лектинов считается их связывание на поверхности клеток паразитов. Кроме углеводов лектины могут связывать некоторые другие вещества, например, аденин, ауксины, индолуксусную кислоту, которые считаются фитогормонами. Токсичность лектинов может быть причиной расстройства пищеварения в результате поедания растительной пищи, содержащей большое их количество, например, соевых бобов, в которых содержится соевый агглютинин. Он способен нарушить пищеварение в тонком кишечнике, связываясь на поверхности клеток кишечного эпителия. Тепловая обработка обычно понижает токсичность лектинов, но некоторые из них устойчивы к нагреванию. Лектины могут также вызывать повышенное выделение слизи в кишечнике, что сказывается на усваивании пищи (Ayyagari, Narasinga Rao, & Roy, 1989; Duranti, 2006; Francis, Makkar, & Becker, 2001).
Активация макрофагов и дендритных клеток через рецепторы распознавания образов
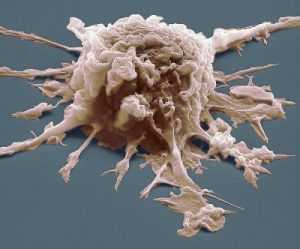 Чтобы ощущать присутствие патогенов, макрофаги и дендритные клетки экспрессируют гораздо более широкий спектр рецепторов, чем нейтрофилы. Это рецепторы распознавания образов (PRR), которые распознают характерные для патогенов молекулярные структуры (PAMPS), которые они экспрессируют на своей поверхности.
Чтобы ощущать присутствие патогенов, макрофаги и дендритные клетки экспрессируют гораздо более широкий спектр рецепторов, чем нейтрофилы. Это рецепторы распознавания образов (PRR), которые распознают характерные для патогенов молекулярные структуры (PAMPS), которые они экспрессируют на своей поверхности.
Многие из рецепторов распознавания образов находятся на плазматической мембране.
- Одна группа рецепторов, лектины С-типа, распознает определенные единицы сахаров, которые обычно расположены в терминальном положении углеводных цепей на поверхностях патогенов. Лектины C-типа включают маннозный рецептор, а также DC-SIGN и лангерин, они характерны для дендритных клеток. «Маннозный рецептор» распознает терминальную маннозу, N-ацетиглюкозамин или фукозу, параллельно с маннан-связывающим лектином.
- Большая группа Toll-подобных рецепторов (TLRs) включает рецепторы для очень разных молекулярных структур патогенов (PAMPS). Так, TLR4 распознаёт бактериальный липополисахарид, TLR1/TLR2 и TLR2/TLR6 — бактериальные липопептиды и пептидогликаны; TLR5 связывает флагеллин, TLR9 — бактериальную ДНК, которая содержит метильные группы, отличные от человеческой ДНК. TLR3 активируется двухцепочечной РНК, типичной для вирусов, TLR7 и TLR8 — одноцепочечной РНК; полинуклеотидсвязывающий TLR распознаёт эндосомы бактерий.
Два других семейства рецепторов распознают PAMPS тогда, когда патогены попадают в цитоплазму.
- NOD-подобные рецепторы (NLR): NOD1 и NOD2, например, распознают компоненты пептидогликанов из клеточной стенки бактерий. При активации NLR образуют большой цитоплазматический комплекс инфламмасому, Инфламмасома способствует активации клеток и играет важную роль в образовании IL-1 и других цитокинов из их неактивных предшественников. В дополнение к PAMPs, некоторые продукты NLR воспринимают продукты, полученные из умирающих Кл, такие как кристаллы мононатриевого урата, метаболиты пурина, образующиеся в результате разрушения ДНК.
- RIG-подобные геликазы (RLH): цитоплазматическая РНК-геликаза RIG-I и родственные белки действуют как вирусные рецепторы. Они экспрессированы клетками всех типов, связывают двунитевую вирусную РНК свободным 5′-трифосфатным концом.
Рецепторы распознавания образов появились на ранней стадии эволюции. В течение длительных периодов времени они, похоже, были основным инструментом конкуренции многоклеточных организмов с бактериями. Например, геном морского ежа содержит более 200 генов для Toll-подобных и NOD-подобных рецепторов.
В дополнение к этим рецепторам распознавания образов (PRR), рецепторам комплемента, например, например, CR3 (CD11b / CD18) и CR4 (CD11c / CD18), иммунные клетки активируются C3-производными, депонированными на вторгающихся патогенах.
Активация этих рецепторов на макрофагах приводит к фагоцитозу и в большинстве случаев приводит к гибели и разрушению проглоченных бактерий. Кроме того, индуцируется глубокое изменение в программе экспрессии генов макрофагов, что приводит к высвобождению коктейля из цитокинов, включая IL-1, TNF, IL-6, IL-8 и IL-12, которые привлекают и активируют другие Кл системы обороны. Через кровоток эти цитокины попадают в печень, где запускают еще один инструмент неспецифической защиты — синтез белков острой фазы. При активации макрофаги и дендритные клетки также экспрессируют определенные, связанные с мембраной белки, например, B7-молекулы (CD80 и CD86), которые необходимы для инициирования адаптивного иммунного ответа.
Сывороточный амилоид А
Члены семейства SAA — важные белки острой фазы у человека. У людей различные представители семейства кодируются четырьмя генами; SAA1 и SAA2 представляют собой типичные печеночные белки острой фазы, которые в совокупности называются A-SAA. Внепеченочный синтез A-SAA в суставах обусловливает высокий уровень SAA в синовиальной жидкости, помимо высокой системной концентрации в плазме . В тонком кишечнике SAA индуцируется интерлейкином-22 в эпителиальных клетках и способствует местной дифференцировке Т-хелперов 17 и эффекторной функции, участвуя в поддержании целостности кишечного барьера .
Сообщалось о цитокиноподобной функциональной активности членов семейства SAA, включая хемотаксис, вызванный прямым взаимодействием с формилпептидными рецепторами, связанными с G-белком. Кроме того, фагоцитарный рецептор B-I (CD36) действует как рецептор эндоцитоза SAA и участвует в SAA-опосредованных иммунных и воспалительных функциях. Также известно, что A-SAA индуцирует смещение популяции макрофагов в М2-подобное (противовоспалительное) состояние и опсонизирует грамотрицательные патогенные бактерии, способствуя их клиренсу и врожденной устойчивости к инфекциям .
Из-за значительного увеличения концентрации в плазме во время воспаления A-SAA использовали в качестве маркера при ряде воспалительных состояний, таких как ревматоидный артрит, сердечно-сосудистые заболевания, злокачественные новообразования и инфекции, включая коронавирусную инфекцию тяжелого острого респираторного синдрома 2 (SARS-CoV-2) . Долгосрочные или периодически возникающие высокие концентрации SAA в плазме (например, вследствие туберкулеза или ревматоидного артрита) в сочетании с аллельными вариантами SAA1 или другими неизвестными факторами могут привести к амилоидозу A (AA) — состоянию, вызванному накоплением фибрилл AA в ряде органов, включая почки, селезенку и печень, что нарушает их функцию. Фибриллы AA образуются в результате сворачивания образующегося из SAA укороченного с С-конца белка AA в чрезвычайно гидрофобные β-листы, которые агрегируют в олигомеры, формируя нерастворимые, устойчивые к протеолизу фибриллы .
Дендритные клетки
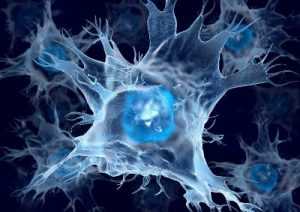 В чем разница между макрофагами и дендритными клетками (ДК)? Макрофаги больше связаны с неадаптивной стороной защиты. Они представляют собой «оборудование для земляных работ», как следует из их названия, способные фагоцитировать большие количества твердых частиц.
В чем разница между макрофагами и дендритными клетками (ДК)? Макрофаги больше связаны с неадаптивной стороной защиты. Они представляют собой «оборудование для земляных работ», как следует из их названия, способные фагоцитировать большие количества твердых частиц.
ДК в основном находятся на адаптивной стороне защиты:
их главная цель — собрать все виды антигенных материалов, доставить их в лимфатический узел и представить их Т-клеткам
Они способны фагоцитировать, но не делают тяжелую работу.
Многие антигены поглощаются макропиноцитозом («пить много»), механизмом приема больших глотков окружающих жидкостей со всеми растворимыми антигенами.
Третий способ ДК собирать антигены — это заражение вирусами, что важно для начала адаптивного противовирусного иммунного ответа.. Многие из наших ДК довольно долговечны, возникли на стадиях развития до рождения из гемопоэтических клеток в стенке желточного мешка или печени плода
Позднее дендритные клетки образуются в костном мозге. Дендритные клетки имеют две стадии жизни: функционально молодые, незрелые, бродят по периферии, собирают антигены, но не имеют инструментов для активации Т-клеток. Куда они идут, определяется хемокиновыми рецепторами, хемокины ведут в периферические ткани. Когда все благополучно, они целыми годами сидят в своих тканях-мишенях, но при инфекции макрофаги тотчас распознают её и освобождают хемокины, которые способствуют экспресии на ДК хоминг-рецептора CCR7,(В7). Теперь это зрелая ДК, способными перемещаться в ближайший лимфатический узел и представлять антигены Т-клеткам. Зрелые дендритные клетки утрачивают способность собирать антигены, но имеют все необходимое для продуктивной связи с Т-клеткам — много молекул МНС и В7. Секретируя хемокин CCL18, эти дендритные клетки привлекают в лимфатические узлы молодые, наивные Т-клетки
Многие из наших ДК довольно долговечны, возникли на стадиях развития до рождения из гемопоэтических клеток в стенке желточного мешка или печени плода. Позднее дендритные клетки образуются в костном мозге. Дендритные клетки имеют две стадии жизни: функционально молодые, незрелые, бродят по периферии, собирают антигены, но не имеют инструментов для активации Т-клеток. Куда они идут, определяется хемокиновыми рецепторами, хемокины ведут в периферические ткани. Когда все благополучно, они целыми годами сидят в своих тканях-мишенях, но при инфекции макрофаги тотчас распознают её и освобождают хемокины, которые способствуют экспресии на ДК хоминг-рецептора CCR7,(В7). Теперь это зрелая ДК, способными перемещаться в ближайший лимфатический узел и представлять антигены Т-клеткам. Зрелые дендритные клетки утрачивают способность собирать антигены, но имеют все необходимое для продуктивной связи с Т-клеткам — много молекул МНС и В7. Секретируя хемокин CCL18, эти дендритные клетки привлекают в лимфатические узлы молодые, наивные Т-клетки.



















