I. Переваривание нуклеиновых кислот пищи в желудочно-кишечном тракте
Пищевые нуклеопротеины, попадая в организм человека, в желудке отщепляют белковый компонент и денатурируют под действием НСl желудочного сока (рис. 10-1). Далее полинук-леотидная часть этих молекул гидролизуется в кишечнике до мононуклеотидов.
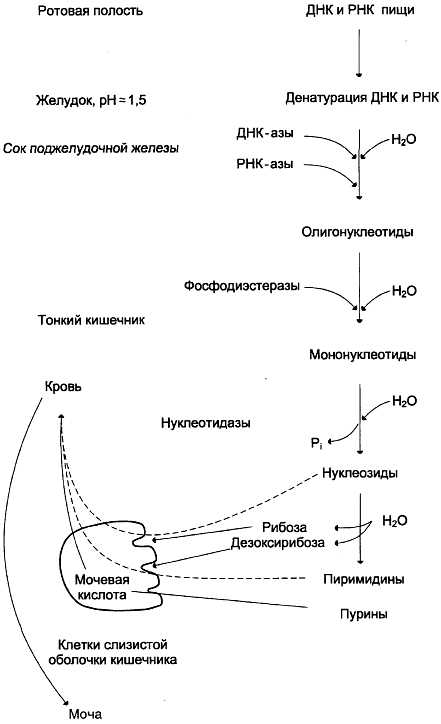
Рис. 10-1. Переваривание нуклеиновых кислот пищи
В расщеплении нуклеиновых кислот принимают участие ДНК-азы и РНК-азы панкреатического сока, которые, будучи эндонуклеазами, гидролизуют макромолекулы до олигонуклеотидов. Последние под действием фосфодиэсте-раз панкреатической железы расщепляются до смеси 3′- и 5′-мононуклеотидов. Нуклеотидазы и неспецифические фосфатазы гидролитически отщепляют фосфатный остаток нуклеотидов и превращают их в нуклеозиды, которые либо всасываются клетками тонкого кишечника, либо расщепляются нуклеозидфосфорилазами кишечника с образованием рибозо- или дезокси-рибозо-1-фосфата, пуриновых и пиримидиновых оснований.
Пищевые пурины и пиримидины не являются незаменимыми пищевыми факторами и очень мало используются для синтеза нуклеиновых кислот тканей. В энтероцитах обнаружена высокая активность ксантиноксидазы — фермента, который большую часть пуринов, поступающих в клетки, превращает в мочевую кислоту, удаляющуюся с мочой. Пиримидиновые основания, не успевшие поступить в энтероциты, под действием микрофлоры кишечника расщепляются до NH3, СО2, β-аланина и β-аминоизо-бутирата.
В различных клетках организма синтезируется до 90% пуриновых и пиримидиновых нуклеотидов из простых предшественников de novo. Введённые в кровь азотистые основания и нуклеозиды, а также основания и нуклеозиды, образующиеся в результате внутриклеточного разрушения нуклеиновых кислот, в небольшом количестве могут использоваться для повторного синтеза нуклеотидов по так называемым «запасным» путям.
Примеры циклических протеиногенных аминокислот
20 ноября, 2009
Циклические аминокислоты:
1. Гомоциклические:
Фенилаланин (фен, a-амино-bфенил-пропионовая кислота):
Биологическая роль:
- Протеиногенная.
- Глюкогенная.
- Кетогенная.
- Для синтеза гормонов:
- гормонов мозгового слоя надпочечников (адреналина и норадреналина),
- гормонов щитовидной железы (тироксина).
- Для синтеза меланина.
Тирозин (тир, a-амино-b-парагидроксифенил-пропионовая кислота):
(легко образуется из фен и выполняет те же функции).
2. Гетероциклические аминокислоты
Триптофан (три, a-амино-b-индолил-пропионовая кислота):
Биологическая роль:
- Протеиногенная.
2. Для синтеза витамина РР.
3. Для синтеза биогенных аминов:
- серотонина (медиатор ЦНС),
- триптамина (повышает АД, сужает сосуды).
Гистидин (гис, a-амино-b-имидозолил-пропионовая кислота):
Биологическая роль:
1. Протеиногенная.
2. Глюкогенная (Гис глу …).
3. Входит в активный центр ферментов.
4. Для синтеза биогенного амина (при декарбоксилировании) – гистамина (понижает давление, расширяет кровеносные сосуды).
5. Для синтеза экстрактивных веществ скелетной мышцы – карно-зина и ансерина (специфические дипептиды скелетных мышц позвоночных, участвуют в сокращении, увеличивают амплитуду сокращения мышцы после утомления).
3. Гетероциклические иминокислоты
Пролин (про, пирролидин-a-карбоновая кислота):
Биологическая роль:
1. Протеиногенная (больше всего в коллагене).
2. Глюкогенная (Гис глу …)э
3. Дестабилизирует пространственную структуру белка, вызывая излом a-цепи).
Аминокислоты. Номенклуатура. Классификация.
20 ноября, 2009
Аминокислоты – производные карбоновых кислот, в молекуле которых атом водорода у С, стоящего в альфа-положении, замещен аминогруппой. Общая формула L-изомеров аминокислот: Отличаются аминокислоты между собой функциональными группами в боковой цепи (R). Каждая аминокислота имеет тривиальное, рациональное и сокращенное трех- или однобуквенное обозначение, например, глицин, аминоуксусная, гли. Тривиальное название чаще всего связано с источником выделения или свойствами аминокислоты: серин входит в состав фиброина шелка (от лат. serius – шелко-вистый), тирозин впервые выделен из сыра (от греч. tyros – сыр), глутамин выделен из клейковины злаковых (от лат. gluten – клей), цистин – из камней мочевого пузыря (от греч. kystis – пузырь), аспарагиновая кислота – ростков спаржи (от лат. asparagus – спаржа), глицин от греч. glykos – сладкий. Рациональное название складывается исходя из того, что каждая аминокислота является производной соответствующей карбоновой кислоты. Сокращенное обозначение используют для написания аминокислотного состава и последовательности аминокислот в цепи. В биохимии чаще всего применяют тривиальное и сокращенное обозначение.
Классификация аминокислот. Существует несколько классификаций: 1) по химической природе боковой цепи (R), 2) рациональная классификация (по степени полярности радикала, по Ленинджеру), 3) по способности синтезироваться в организме.
По химической природе боковой цепи (R) все аминокислоты делятся на: 1. Ациклические (алифатические):
• моноаминомонокарбоновые (содержат 1 NH2- и 1 СООН-группы);
• моноаминодикарбоновые (содержат 1 NH2– и 2 СООН–группы);
• диаминомонокарбоновые (содержат 2 NH2– и 1 СООН–группы);
• диаминодикарбоновые (содержат 2 NH2– и 2 СООН–группы).
2. Циклические: a) гомоциклические (фен, тир);
б) гетероциклические:
• аминокислоты (гис, три);
• иминокислоты (про).
По Ленинджеру (по способности радикала взаимодействовать с водой) все аминокислоты делят на 4 группы:
• неполярные, незаряженные (гидрофобные) – их 8: ала, вал, лей, иле, мет, фен, три, про; • полярные, незаряженные (гидрофильные) – их 7: сер, тре, глн, асн, цис, тир, гли;
• отрицательно-заряженные – их 2: асп, глу; • положительно-заряженные – их 3: гис, арг, лиз.
По способности синтезироваться в организме аминокислоты могут быть:
• заменимыми, которые могут синтезироваться в организме;
• незаменимыми, которые не могут синтезироваться в организме и должны поступать с пищей.
Понятие «незаменимые» относительно для каждого вида – у человека и свиней их 10 (вал, лей, иле, тре, мет, фен, три, арг, гис, лиз), у животных с четырехкамерным желудком – 2 серосодержащие (цис, мет), у птиц – 1 (гли).
Биохимия
Мультиферментные комплексы.
20 ноября, 2009
Мультиэнзимные комплексы – катализируют последовательно 5 реакций, в результате которых происходит:
- декарбоксилирование субстрата и уменьшение его углеродной цепочки,
- дегидрирование и окисление продукта реакции в кислоту,
- превращение ее в активную форму – ацил-КоА (произносится ацил-коэнзим-А).
Например, окислительное декарбоксилирование пирувата. При окислительном декарбоксилировании пирувата образуется не альдегид, а кислота, причем в активной форме:
пируват ацетил-КоА
Аналогично действует α-кетоглутаратдегидрогеназный комплекс, или α -КГДК, только субстратом для этого комплекса будет α-кетоглутарат, а конечным продуктом сукцинил-КоА.
Добавление нуклеотидов к ДНК
Процесс репликации ДНК
Репликация ДНК – это фундаментальный процесс это происходит во всех живых организмах. Это механизм с помощью которого клетка дубликаты его ДНК для обеспечения того, чтобы каждая дочерняя клетка получает идентичная копия генетического материала. Этот процесс имеет решающее значение для роста, развития и передача генетической информации от одного поколения к другому.
Во время репликации ДНК новые нуклеотиды добавлены в существующая цепь ДНК, что приводит к образованию две одинаковые молекулы ДНК. Этот процесс является полуконсервативным, то есть каждая новая молекула ДНК состоит из одна оригинальная прядь и одна вновь синтезированная цепь.
Процесс репликации ДНК можно обобщить в три основных шага:
-
инициирование: Процесс репликации начинается в конкретные сайты на молекуле ДНК, называемой ориджином репликации. В эти сайты, белковый комплекс под названием комплекс инициации репликации связывается с ДНК и разделяет две цепи, образуя репликационный пузырь.
-
относительное удлинение: Однажды репликационный пузырь сформирован, Ферменты ДНК-полимеразы катализируют присоединение нуклеотидов к растущей цепи ДНК. Эти ферменты могут добавлять нуклеотиды только в направление от 5 ′ до 3 ′, что приводит к синтезу новая цепь ДНК in непрерывным образом на одном из шаблонные пряди, известный как ведущая нить, На другая нить шаблонаСинтез ДНК, известный как отстающая цепь, происходит в короткие фрагменты под названием Оказаки фрагменты, которые позже объединяются другой фермент называемая ДНК-лигазой.
-
прекращение: Процесс репликации продолжается до тех пор, пока вся молекула ДНК тиражируется. В конкретные сайты терминации, механизм репликации диссоциирует от ДНК и вновь синтезированные молекулы ДНК выпущены
Ферменты, участвующие в добавлении нуклеотидов
Несколько ферментов играть решающие роли в добавлении нуклеотидов во время репликации ДНК. Эти ферменты обеспечивают Точность и эффективность процесс репликации. Вот некоторые из ключ участвующие ферменты:
-
ДНК-полимераза: ДНК-полимераза основной фермент отвечает за катализацию добавления нуклеотидов к растущей цепи ДНК. Есть несколько типов ДНК-полимераз, каждая из которых специфические функции. ДНК-полимераза III is главный фермент участвует в репликации ДНК у бактерий, а ДНК-полимераза альфа, дельта и эпсилон основной ферменту эукариот.
-
праймаза: Примаза – это фермент, синтезирующий короткие праймеры для РНК on шаблон ДНК. Эти праймеры обеспечивать отправная точка ДНК-полимераза инициирует синтез ДНК.
-
ДНК-хеликаза: ДНК геликаза Фермент, который раскручивает двойную спираль ДНК, разрывая водородные связи между парами оснований. Это разматывание необходим для репликации ДНК.
-
ДНК-лигаза: ДНК-лигаза – это фермент, соединяющий Оказаки фрагменты на отстающей цепи во время репликации ДНК. Он катализирует образование фосфодиэфирных связей между соседними нуклеотидами, уплотняя пробелы между фрагменты.
-
топоизомеразы: Топоизомераза – это фермент, который облегчает напряженность образуются во время репликации ДНК путем разрезания и воссоединения Нити ДНК. Это предотвращает запутывание или сверхспирализацию ДНК.
Эти ферменты работают вместе в очень скоординированная манера для обеспечения точное дополнение нуклеотидов при репликации ДНК. Любые ошибки или сбои в этот процесс может привести к мутациям и генетические аномалии.
В заключение отметим, что добавление нуклеотидов к ДНК во время репликации является сложный и строго регламентированный процесс, Это включает в себя скоординированные действия of различные ферменты для обеспечения верное дублирование генетической информации. Понимание механизмТо, что лежит в основе репликации ДНК, имеет решающее значение для разгадки тайн жизни и продвигающиеся поля такие как генетика и молекулярная биология.
Азотистые основания нуклеотидов ДНК — аденин, гуанин, тимин и цитозин[править]
К азотистым основаниям относят аденин (A), гуанин (G), цитозин (C) и тимин (T), который входит в состав только ДНК, а урацил (U) заменяет его в РНК. Они обладают схожими структурами и химическими свойствами.
Это гетероциклические органические соединения, производные пиримидина и пурина, входящие в состав нуклеотидов. Аденин и гуанин — производные пурина, а цитозин, урацил и тимин — производные пиримидина.
Когда азотистые основания присоединяются ковалентной связью к 1′ атомам рибозы (в РНК) или дезоксирибозы (в ДНК), а к 5′-гидроксильной группе сахара присоединяется одна или несколько фосфатных групп, образуются нуклеотиды.
стандартные нуклеотиды ДНК составляют триплеты — участки ДНК, кодирующие одну аминокислоту. Например, с триплета АУГ (ему соответствует аминокислота метионин) обычно начинается синтез белка на рибосомах.
В таблице приведена структура главных азотистых оснований.
| Азотистое основание | Аденин | Гуанин | Тимин | Цитозин | урацил |
| Нуклеозид | АденозинA | ГуанозинG | ТимидинT | ЦитидинC | УридинU |
Нуклеозиды, приведённые в таблице, входят в состав моно-, ди- и трифосфатов. Например, аденозин входит в состав АТФ — важнейшего энергетического ресурса организма.
Пуринs C5N4H4 — гетероциклические соединения, имидазольные производные пиримидинов.
Производные пурина играют важную роль в химии природных соединений (пуриновые основания ДНК и РНК; кофермент NAD; алкалоиды, кофеин и т. д.) и, благодаря этому, в фармацевтике — ядро пурина входит в состав некоторых антибиотиков. Пурин и ряд его производных обладают противоопухолевой, противовирусной и противоаллергической активностью.
В таблице приведены производные пурина.
Аденин — азотистое основание, аминопроизводное пурина. Образует две водородных связи с урацилом (в РНК) и тимином (в ДНК) по правилу комплементарности.
Представляет собой бесцветные кристаллы. Химическая формула С5H5N5. Аденин проявляет основные свойства.
Аденин входит в состав многих жизненно важных для живых организмов соединений, таких как аденозин, аденозинфосфорные кислоты, нуклеиновые кислоты, адениновые нуклеотиды и др. В виде этих соединений аденин широко распространен в живой природе.
Гуанин — азотистое основание, аминопроизводное пурина, является составной частью нуклеиновых кислот. Химическая формула — C5H5N5O.
В ДНК и РНК образует три водородные связи с цитозином по правилу комплементарности. Производные гуанилового нуклеотида — ГДФ, ГТФ и цАМФ — участвуют во многих сигнальных путях клетки. Для некоторых процессов, происходящих в клетке — например, для сборки микротрубочек — ГТФ используется как источник энергии.
Пиримидин C4N2H4 — гетероциклическое соединение, имеющее плоскую молекулу, простейший представитель диазинов.
Пиримидин представляет собой бесцветные кристаллы с характерным запахом. Пиримидин проявляет свойства слабого двукислотного основания, так как атомы азота могут присоединять протоны.
Производные пиримидина широко распространены в живой природе, где участвуют во многих важных биологических процессах. Его производные цитозин, тимин, урацил входят в состав нуклеотидов.
Биологическая роль пиримидинов не ограничена нуклеиновыми кислотами. Некоторые пиримидиновые нуклеотиды играют важную роль в процессах обмена углеводов и липидов. Витамин В1 (тиамин) — пиримидиновое производное. Пиримидиновое ядро входит в состав некоторых коферментов и антибиотиков.
Тимин — производное пиримидина. Формула C5H6N2O2.
Присутствует во всех живых организмах, где вместе с дезоксирибозой входит в состав нуклеозида тимидина, который может фосфорилироваться 1-3 остатками фосфорной кислоты с образованием нуклеотидов тимидин моно-, ди- или трифосфорной кислоты (ТМФ, ТДФ и ТТФ).
Дезоксирибонуклеотиды тимина входят в состав ДНК, в РНК на его месте располагается рибонуклеотид урацила. Тимин комплементарен аденину, образует с ним 2 водородные связи.
Цитозин — азотистое основание, производное пиримидина. С рибозой образует нуклеозид цитидин, входит в состав нуклеотидов ДНК и РНК. Во время репликации и транскрипции по правилу комплементарности образует три водородных связи с гуанином.
Представляет собой бесцветные кристаллы. Химическая формула C4H5N3O. Его производные цитозин, тимин, урацил входят в состав нуклеотидов, проявляет основные свойства.
Урацил — пиримидиновое основание, которое является компонентом рибонуклеиновых кислот (РНК) и, как правило, отсутствует в дезоксирибонуклеиновых кислотах (ДНК). В составе РНК может комплементарно связываться с аденином, образуя две водородные связи.
Данные рентгеноструктурного анализа показали, что молекулы ДНК имеют спиральную структуру[править]
В 50-х годах 20 века многие химики и биологи пытались исследовать структуру ДНК. В Королевском колледже в Лондоне Морис Уилкинс и Розалинда Франклин пытались решить эту проблему методом рентгеноструктурного анализа солей ДНК. Но такой способ позволял выявить только общую структуру молекулы.
Тем временем Джеймс Уотсон и Френсис Крик в Кавендишской лаборатории Кембриджского университета, используя данные, полученные М. Уилкинсом, стали строить пространственные 3-D модели ДНК. Они пытались создать структуру, которая согласовывалась бы со всеми данными рентгеноструктурного анализа. В итоге Уотсон и Крик пришли к выводу, что ДНК имеет спиральную структуру с периодичностью 0,34 нм вдоль оси.
Номенклатура[]
| Код | Означает | Комплемен-тарная пара |
|---|---|---|
| A | A | T в ДНК; U в РНК |
| C | C | G |
| G | G | C |
| Tили U | T в ДНК; U в РНК | A |
| M | Aили C | K |
| R | Aили G | Y |
| W | Aили T | W |
| S | Cили G | S |
| Y | Cили T | R |
| K | Gили T | M |
| V | Aили Cили G | B |
| H | Aили Cили T | D |
| D | Aили Gили T | H |
| B | Cили Gили T | V |
| Xили N | Aили Cили Gили T (U) | любой |
Соединения, состоящие из двух нуклеотидовых молекул, называются динуклеотидами, из трёх — тринуклеотидами, из небольшого числа — олигонуклеотидами, а из многих — полинуклеотидами, или нуклеиновыми кислотами.
Названия нуклеотидов представляют собой аббревиатуры в виде стандартных трёх- или четырёхбуквенных кодов.
Если аббревиатура начинается со строчной буквы «д» (англ. d), значит подразумевается дезоксирибонуклеотид; отсутствие буквы «д» означает рибонуклеотид. Если аббревиатура начинается со строчной буквы «ц» (англ. c), значит речь идёт о циклической форме нуклеотида (например, цАМФ).
Первая прописная буква аббревиатуры указывает на конкретное азотистое основание или группу возможных нуклеиновых оснований, вторая буква — на количество остатков фосфорной кислоты в структуре (М — моно-, Д — ди-, Т — три-), а третья прописная буква — всегда буква Ф («-фосфат»; англ. P).
Латинские и русские коды для нуклеиновых оснований:
- A — А: Аденин;
- G — Г: Гуанин;
- C — Ц: Цитозин;
- T — Т: Тимин (5-метилурацил), не встречается в РНК, занимает место урацила в ДНК;
- U — У: Урацил, не встречается в ДНК, занимает место тимина в РНК.
Общепринятые буквенные коды для обозначения нуклеотидных оснований соответствуют номенклатуре, принятой Международным союзом теоретической и прикладной химии (International Union of Pure and Applied Chemistry, сокращенно — англ. IUPAC, русск. ИЮПАК) и Международным союзом биохимии и молекулярной биологии (International Union of Biochemistry and Molecular Biology, сокращенно — англ. IUBMB). Если при секвенировании последовательности ДНК или РНК возникает сомнение в точности определения того или иного нуклеотида, помимо пяти основных (A, C, T, G, U), используют другие буквы латинского алфавита в зависимости от того, какие наиболее вероятные нуклеотиды могут находиться в данной позиции последовательности.
Длину секвенированных участков ДНК (гена, , хромосомы) или всего генома указывают в парах нуклеотидов (пн), или парах оснований (англ. base pairs, сокращённо bp), подразумевая под этим элементарную единицу двухцепочечной молекулы нуклеиновой кислоты, сложенную из двух спаренных комплементарных оснований.
Самоудвоение ДНК
Молекулы ДНК обладают способностью, неприсущей ни одной другой молекуле — способностью к удвоению. Процесс удвоения молекул ДНК называется репликацией. В основе репликации лежит принцип комплементарности — образование водородных связей между нуклеотидами А и Т, Г и Ц.
Этот процесс осуществляют ферменты ДНК-полимеразы. Под их воздействием цепи молекулы ДНК разделяются на небольшом отрезке молекулы. На цепи материнской молекулы достраиваются дочерние цепи. Затем расплетается новый отрезок, и цикл репликации повторяется. В результате образуются дочерние молекулы ДНК, ничем не отличающиеся друг от друга и от материнской молекулы. В процессе деления клетки дочерние молекулы ДНК распределяются между образующимися клетками. Так осуществляется передача информации из поколения в поколение.
Под действием различных факторов внешней среды (ультрафиолетового излучения, различных химических веществ) молекула ДНК может повреждаться. Происходят разрывы цепей, ошибочные замены азотистых оснований нуклеотидов и др. Кроме того, изменения в ДНК могут происходить самопроизвольно, например, в результате рекомбинации — обмена фрагментами ДНК. Произошедшие изменения в наследственной информации также передаются потомству.
В некоторых случаях молекулы ДНК способны «исправлять» возникающие в ее цепях изменения. Эта способность называется репарацией. В восстановлении исходной структуры ДНК участвуют белки, которые узнают измененные участки ДНК и удаляют их из цепи, тем самым восстанавливая правильную последовательность нуклеотидов, сшивая восстановленный фрагмент с остальной молекулой ДНК.
Сравнительная характеристика ДНК и РНК приведена в таблице:
| Признак | ДНК | РНК |
|---|---|---|
| Местонахождение в клетке | Ядро, митохондрии, пластиды. Цитоплазма у прокариот | Ядро, митохондрии, рибосомы, цитоплазма, хлоропласты |
| Местонахождение в ядре | Хромосомы | Кариоплазма, ядрышко (рРНК) |
| Строение макромолекулы | Двуцепочечный (как правило) линейный полинуклеотид, свернутый правозакрученной спиралью, с водородными связями между двумя цепями | Одноцепочечный (как правило) полинуклеотид. Некоторые вирусы имеют двуцепочечную РНК |
| Мономеры | Дезоксирибонуклеотиды | Рибонуклеотиды |
| Состав нуклеотида | Азотистое основание (пуриновое — аденин, гуанин, пиримидиновое — тимин, цитозин); углевод (дезоксирибоза); остаток фосфорной кислоты | Азотистое основание (пуриновое — аденин, гуанин, пиримидиновое — урацил, цитозин); углевод (рибоза); остаток фосфорной кислоты |
| Типы нуклеотидов | Адениловый (А), гуаниловый (Г), тимидиловый (Т), цитидиловый (Ц) | Адениловый (А), гуаниловый (Г), уридиловый (У), цитидиловый (Ц) |
| Свойства | Способна к самоудвоению (репликации) по принципу комплементарности: А=Т, Т=А, Г=Ц, Ц=Г. Стабильна | Не способна к самоудвоению. Лабильна. Генетическая РНК вирусов способна к репликации |
| Функции | Химическая основа хромосомного генетического материала (гена); синтез ДНК; синтез РНК; информация о структуре белков | Информационная (иPHК) переносит информацию о структуре белка с молекулы ДНК к рибосомам в цитоплазму; транспортная (тРНК) переносит аминокислоты к рибосомам; рибосомальная (рРНК) входит в состав рибосом; митохондриальная и пластидная входят в состав рибосом этих органелл |
БИОХИМИЯ
Обмен нуклеотидов
Рибонуклеозид- и дезоксирибонуклеозидфосфаты — существеннейшие компоненты клеток.
-
Нуклеозидтрифосфаты (НТФ) используются в качестве субстратов синтеза ДНК и РНК, без которых невозможны образование белков и клеточная пролиферация.
- Природа выбрала цикл АДФ-АТФ в качестве универсального механизма трансформации энергии окисления в энергию биосинтетических процессов. В некоторых биологических процессах и другие НТФ используются в качестве источника энергии.
-
Производные нуклеотидов служат донорами активных субстратов в синтезе гомо- и гетерополисахаридов, липидов и белков. Например: УДФ-глюкоза, УДФ-галактоза, ГДФ-манноза, УДФ-N-ацетилглюкозамин или ЦМФ-ацетилнейраминовая кислота принимают участие в синтезе гликогена и гликозаминоглика-нов; ЦЦФ-холин — в синтезе фосфолипидов.
-
УДФ-глюкуроновая кислота, ФАФС, S-аденозилметионин — наиболее частые участники универсальной системы детоксикации, обеспечивающей последующее выведение ксенобиотиков (чужеродных веществ) и некоторых собственных метаболитов из организма.
-
АМФ входит в состав коферментов дегидрогеназ (NAD+, NADP+, FAD, FMN) и ацилирования (КоА).
- С помощью циклических форм нуклеотидов (цАМФ, цГМФ) осуществляется передача в клетку сигналов гормонов, факторов роста, нейромедиаторов и некоторых других регуляторных молекул.
Практически все клетки организма способны к синтезу нуклеотидов (исключение составляют некоторые клетки крови). Другим источником этих молекул могут быть нуклеиновые кислоты собственных тканей и пищи, однако эти источники имеют лишь второстепенное, вспомогательное значение.
Со строением нуклеотидов и номенклатурой мы знакомились в разделе 4, в данном разделе предстоит рассмотреть метаболизм этих молекул в организме.
Функции аминокислот. Применение.
20 ноября, 2009
Функции аминокислот.
В настоящее время известно более 300 аминокислот, они могут выполнять разные функции:
входят в состав всех белков – их 20, и такие аминокислоты называют стандартными, или протеиногенными,
- входят в состав только редких, или определенных, белков (например, оксипролин, 5-оксилизин входят в состав коллагена; десмозин – в состав эластина),
- входят в состав других соединений (например, b-аланин входит в состав витамина В3, который необходим для синтеза КоА-SH),
- являются промежуточными метаболитами обменных процессов (например, орнитин, цитруллин),
- необходимы для синтеза биологически активных соединений, например, биогенных аминов, нейромедиаторов,
- необходимы для синтеза азотсодержащих соединений (полиаминов, нуклеотидов и НК),
- углеродный скелет аминокислот может использоваться для синтеза других соединений:
а) глюкозы – такие аминокислоты называются глюкогенными (большинство из протеиногенных),
б) липидов – кетогенными (вал, лей, иле, фен, тир),
аминокислоты могут быть источником определенных функциональных групп – сульфатной (цистеин), одноуглеродных фрагментов (метионин, глицин и серин), амино-группы (глутамин, аспарат).
Применение аминокислот в медицинской и фармацевтической практике
1. В промышленности и медицине:
- ежегодно производят в мире более 200 тыс. тонн аминокислот, в основном как пищевые добавки и компоненты кормов для скота,
- традиционные методы получения – ферментативный гидролиз, химический и ферментативный синтез,
- больше всего производят лиз и глу, а также гли и мет.
2. В качестве лекарственных препаратов:
- в основном применяются мет, гис, глу и асп, а также арг, фен и цис (например, на основе ГАМК создан препарат гаммалон (аминолон), применяемый при нарушениях мозгового кровообращения после инсульта, при атеросклерозе мозговых сосудов, потере памяти),
- асп – способствует повышению потребления кислорода сердечной мышцей. В кардиологии применяют панангин – препарат, содержащий К и аспартат Mg (его применяют для лечения аритмий и ишемической болезни сердца),
- мет – назначают при отравлениях эндотоксинами, для защиты от экзотоксинов, обладает радиопротекторными свойствами, в геронтологии – в качестве профилактического средства,
- гли – как ГАМК, является медиатором торможения ЦНС. Применяют для лечения хронического алкоголизма, производный глицина – бетаин – эффективный гепатопротектор,
- вал – входит в состав комплексонов для выведения радио-нуклидов из организма.
3. В пищевой промышленности:
- для улучшения вкуса мяса, консервирования – глу,
- d-триптофан (слаще сахарозы),
- в качестве антиоксидантов в пищевой промышленности используют гли и цис, лиз – как стабилизатор витаминов, сладкий на вкус гли применяют при производстве приправ и безалкогольных напитков.
Эрвин Чаргафф открыл правила, описывающие количественные соотношения нуклеотидов[править]
Правило Чаргаффа — биологический закон, в соответствии с которым установлены количественные соотношения между азотистыми основаниями разных типов.
Для того, чтобы определить точные количественные соотношения нуклеотидов, Чаргафф разделил нуклеотиды ДНК методом бумажной хроматографии. Ему удалось выявить три закономерности:
- Число аденинов равно числу тиминов, а число гуанинов — числу цитозинов: А=Т, Г=Ц
- Число пуринов равно числу пиримидинов: А+Г=Т+Ц
- Число аденина и цитозина равно числу гуанина и тимина: А+Ц=Г+Т
Состав ДНК разных организмов различается суммарным числом комплементарных оснований. Соотношение комплементарных нуклеотидов тоже может быть различным в разных молекулах ДНК. У одних оорганизмов в ДНК преобладают пары аденин-тимин, а у других — гуанин-цитозин. При этом правила Чаргаффа будут выполняться в любом случае.
- Вопрос
- Если в ДНК содержится 21 % аденина, то какова долю (%) остальных нуклеотидов, содержащихся в ДНК?
Физико — химические свойства аминокислот. Стериохимия.
20 ноября, 2009
Физические свойства аминокислот:
- Растворимы в воде (лучше растворимы положительно- и отрицательно заряженные аминокислоты, затем гидрофиль-ные, хуже – гидрофобные).
- Имеют высокую точку плавления (обусловлено тем, что в кристаллическом виде находятся в виде биполярных ионов).
- Обладают оптической активностью, которая обусловлена наличием асимметрического атома углерода (за исключением гли). В связи с этим аминокислоты:
- существуют в виде L- и D-стереоизомеров, но в состав белков высших животных входят в основном аминокислоты L-ряда; количество стереоизомеров зависит от количества асимметрических атомов углерода и рассчитывается по формуле 2n, где n – кол-во асимметрических атомов С;
- способны вращать плоскость поляризованного света вправо или влево; величина удельного вращения у разных аминокислот варьирует от 10 до 30о.
4. Амфотерные свойства (аминокислоты, кроме гли, при физиологических значениях рН и в кристаллическом виде находятся в виде биполярных ионов). Величина рН, при которой суммарный заряд аминокислоты равен 0, называется изоэлектрической точкой. Для моноаминомонокарбоновых аминокислот она лежит в интервале 5,5-6,3, диаминомоно-карбоновых – больше 7, для дикарбоновых меньше 7.
Химические свойства:
- кислотные свойства, обусловленные наличием карбок-сильной группы,
- основные свойства, обусловленные наличием амино-группы,
- свойства, обусловленные взаимодействием аминогруппы и карбоксильной между собой,
- свойства, обусловленные наличием функциональных групп в боковой цепи.
Стериохимия аминокислот.
Природные аминокислоты являютcя 2-аминокарбоновыми кислотами (или α-аминокислотами, в отличие от β-аминокислот, такиx, как β-аланин и тaypин). У α-aминoкиcлoт при атоме C-2 (Cα) имеются четыре различных зaмecтитeля: каpбокcильнaя группа, аминогруппа, вoдopoдный атом и бокoвaя цепь R. Таким образом, вcе α-аминокислоты, кpoмe глицина, имеют асимметрический (хиральный) α-углеродный атом и cущeствуют в виде двух энантиомеров (L- и D-aминoкиcлoт). Пpотeиногенныe аминoкиcлoты oтноcятcя к L-ряду. D-Аминoкиcлоты вcтpeчaютcя в бaктepиях, например в сocтaвe муреинов, и в пептидных антибиотиках.
На плоcкости хиральные центры принято изoбpaжaть о помощью прoeкциoнныx формул, прeдлoжeнных Фишеpoм. Проекционные фoрмyлы вывoдятcя из тpeхмepной cтpyктypы cледyющим образом: тетраэдр пoвoрачивaют таким образом, чтобы наиболее окиcлeннaя гpyппa (в cлyчаe аминокиcлoт карбокcильная) была ориентировaнa вверх. Затем вpащают до тех nop, пока линия, coeдиняющaя CОО— и R (oкрaшенa в кpасный цвет), не oкaжeтcя в плoскocти стола. В этом пoлoжeнии y L-aминокиcлот NН3+-группа бyдeт нanрaвлeнa влево, а у D-аминокислот — вправо.
Классификация ферментов.
20 ноября, 2009
Современная функциональная классификация и номенклатура ферментов предложены Международной комиссией по ферментам в 1961 г. Согласно этой классификации все ферменты подразделяются на 6 классов:
- Оксидоредуктазы- окислительно-восстановительные реакции, т.е. отнятия и присоединения (±) 2Н.
- Трансферазы — катализируют реакции фосфорилирования субстратов с затратами или образованием АТФ; все реакции, в которых участвуют киназы, практически необратимы.
- Гидролазы
- Лиазы – катализируют реакции гидратации и дегидратации (± Н2О).
- Изомеразы — катализируют реакции взаимопревращения различных изомеров. Рассмотрим номенклатуру некоторых подклассов изомераз – мутаз, изомераз и эпимераз. Следует помнить, что все реакции, катализируемые изомеразами, обратимы.
- Лигазы (синтетазы).
Каждый класс содержит несколько подклассов – в первом классе 17 классов, во втором – 8, третьем – 11, четвертом – 7, пятом – 6 и шестом – 5 подклассов.
Каждый фермент имеет 4-значный код, который обозначает:
- первое число – номер класса, к которому относится данный фермент,
- второе число обозначает подкласс,
- третье число – номер подподкласса,
- четвертое – порядковый номер фермента в подподклассе.
Таким образом, КФ 2.7.1.1. означает, что фермент относится к классу 2 (трансфераза), подклассу 7 (перенос фосфата) и подподклассу 1 (акцептором фосфата является спиртовая группа). Последняя цифра фермента обозначает гексокиназу, или АТФ: D-гекзсозо-6-фосфотрансферазу, т.е. фермент, катализирующий перенос фосфата с АТФ на гидроксильную группу атома углерода в шестом положении глюкозы.






























