Питание цыпленка в яйце
В первые дни развития эмбрион использует питательные вещества белка и желтка. Так как в желтке содержится целый комплекс минеральных веществ, жиров и углеводов, он способен обеспечить все первоначальные потребности растущего организма.
После замыкания аллантоиса (11 день развития), происходит перераспределение функций. Зародыш, становится крупнее и принимает положение вдоль длинной оси яйца, головой к тупому концу. Белок к этому моменту сконцентрирован в остром конце яйца.
Вес птенца вкупе с давлением аллантоиса обеспечивает смещение белка и проникновение его через амнион в рот зародыша. Благодаря этому непрерывному процессу обеспечивается быстрый рост и развитие цыпленка в яйце по дням во время инкубации.
С 13 дня минеральные вещества, которые использует цыпленок для дальнейшего развития, доставляются аллантоисом от скорлупы.
Следует знать: Нормальное питание цыпленка, способен обеспечить, только своевременно замкнутый аллантоис у цыпленка. Если, при его смыкании, в остром конце яйца, остался не покрытый сосудами белок, цыпленку не хватит питательных веществ для дальнейшего роста.
Куриные эмбрионы
В середине 30-х годов австралийский вирусолог Ф. Вернет «открыл» новое для вирусологии экспериментальное животное — куриные эмбрионы. Для заражения вирусами обычно используют 10—12-дневные куриные зародыши, у которых в это время хорошо развиты оболочки — хорионаллантоисная и амниотиче-ская. При заражении их разными вирусами может развиться вирусная инфекция. При этом размножение вируса происходит в течение 3—4 дней, когда иммунитет еще не успевает развиться.
Использование куриных эмбрионов позволило выделить еще несколько вирусов человека — парагриппа, свинки, оспы, гриппа (последние два раньше были выделены от обезьян и хорьков). Однако главное достоинство куриных эмбрионов заключалось не в этом. При заражении экспериментальных животных, чувствительных к тому или иному вирусу, этот последний накапливается во внутренних органах или нервной ткани, откуда его трудно выделить в чистом виде, освободив от клеточных белков. Иное дело куриные эмбрионы: размножаясь в зародышевых оболочках, вирус выделяется в аллантоис-ную и амниотическую жидкость, где накапливается в громадных количествах (до нескольких миллиардов вирионов в 1 мл) В дальнейшем вирус может быть осажден в центрифуге и дополнительно очищен разными методами.
Применение куриных эмбрионов привело к подлинной революции в изучении вирусов, которая была продолжена и завершена введением в вирусологическую технику метода культур тканей
Особенно важное значение имела техника культивирования вирусов в куриных эмбрионах для изучения вируса гриппа. Было обнаружено, что вирусы гриппа склеивают (агглютинируют) эритроциты зародыша курицы
На основе этого феномена была разработана техника реакции агглютинации эритроцитов, которая и до сих пор широко применяется для диагностики гриппа и многих других вирусных инфекций. Выделение препаратов очищенного вируса гриппа дало возможность исследовать химический состав вируса гриппа и других вирусов, размножающихся в куриных зародышах, изучить динамику их размножения и др. Техника работы с вирусами на куриных эмбрионах сохранила свое значение и в настоящее время. Кроме куриных эмбрионов, в некоторых случаях используются эмбрионы других птиц — уток, перепелок.
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
|
Terregino et al. |
2008 |
Pathogenicity of a QX strain of infectious bronchitis virus in specific pathogen free and commercial broiler chickens, and evaluation of protection induced by a vaccination programme based on the Ma5 and 4/91 serotypes |
|
Smith et al. |
1977 |
Room humidifiers as the source of Acinetobacter infections |
|
Alexander et al. |
1977 |
Isolation of avian infectious bronchitis virus from experimentally infected chickens |
|
Hanson et al. |
1990 |
Elimination of high titre HIV from fibreoptic endoscopes. |
|
Beard |
1970 |
Demonstration of type-specific influenza antibody in mammalian and avian sera by immunodiffusion |
|
ATE216081T1 |
2002-04-15 | Methode zur geschlechtsbestimmung von vögeln in ovo |
|
Work et al. |
1953 |
Isolation of West Nile virus from hooded crow and rock pigeon in the Nile delta. |
|
RU2402208C2 |
2010-10-27 | Способы продуцирования гамет у птиц |
|
NL2024701B1 |
2021-09-08 | Egg Positioning Device |
|
Fazekas et al. |
1948 |
Destruction of influenza virus receptors in the mouse lung by an enzyme from V. cholerae. |
|
RU2116796C1 |
1998-08-10 | Способ выделения вируса из аллантоисной жидкости зараженного куриного эмбриона |
|
EP3406275A1 |
2018-11-28 | Wound treatment apparatus |
|
SE7808686L |
1979-12-17 | Forfarande for pavisning av alstrare i blod |
|
Guy |
2008 |
Isolation and Propagation of Coronaviruses inEmbryonated Eggs |
|
CN106065030A |
2016-11-02 | 鸡包涵体肝炎的卵黄抗体及其制备方法 |
|
Manwell et al. |
1951 |
Mammalian toxoplasmosis in birds |
|
Nurgeldiyeva et al. |
2014 |
Correlation of atherogenesis with an infection of Candida albicans |
|
Timms |
1977 |
The estimation of prothrombin time of chicken and turkey plasma using a phenol-saline thromboplastin or Russell viper venom |
|
Gray |
1976 |
The cellular response of the fowl small intestine to primary and secondary infections of the cestode Raillietina cesticillus (Molin) |
|
Hahon et al. |
1957 |
Method of chorioallantoic membrane inoculation which decreases nonspecific lesions |
|
Salle et al. |
1938 |
An improved method for the evaluation of germicidal substances |
|
Morris et al. |
2001 |
Microinjection methods for analyzing the functions of kinesins in early embryos |
|
Guy |
2020 |
Isolation and Propagation of Coronaviruses in Embryonated Eggs |
|
Hofmeister et al. |
1995 |
Ear biopsy location influences detection of Borrelia burgdorferi by PCR, but not by culture in naturally infected Peromyscus leucopus |
|
Barber et al. |
1977 |
Construction of an improved tracheal pouch in the ferret |
Info
- Publication number
- RU2116796C1
RU2116796C1
RU95100163A
RU95100163A
RU2116796C1
RU 2116796 C1
RU2116796 C1
RU 2116796C1
RU 95100163 A
RU95100163 A
RU 95100163A
RU 95100163 A
RU95100163 A
RU 95100163A
RU 2116796 C1
RU2116796 C1
RU 2116796C1
Authority
RU
Russia
Prior art keywords
virus
chicken embryo
fluid
isolation
study
Prior art date
1995-01-05
Application number
RU95100163A
Other languages
English (en)
Other versions
RU95100163A
(ru
Inventor
С.З. Пискунов
Г.З. Пискунов
Ф.Н. Завьялов
Original Assignee
Разиньков Сергей Петрович
Priority date (The priority date is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the date listed.)
1995-01-05
Filing date
1995-01-05
Publication date
1998-08-10
1995-01-05Application filed by Разиньков Сергей Петрович
filed
Critical
Разиньков Сергей Петрович
1995-01-05Priority to RU95100163A
priority
Critical
patent/RU2116796C1/ru
1997-02-27Publication of RU95100163A
publication
Critical
patent/RU95100163A/ru
1998-08-10Application granted
granted
Critical
1998-08-10Publication of RU2116796C1
publication
Critical
patent/RU2116796C1/ru
Молекулярная вирусология
В 1962 г. вирусологи многих стран собрались на симпозиуме в США, чтобы подвести первые итоги развития молекулярной вирусологии. На этом симпозиуме звучали не совсем привычные для вирусологов термины: архитектура вирионов, нуклеокапсиды, капсомеры. Начался новый период в развитии вирусологии — период молекулярной вирусологии.
Молекулярная вирусология, или молекулярная биология вирусов, — составная часть общей молекулярной биологии и в то же время — раздел вирусологии. Это и неудивительно. Вирусы — наиболее простые формы жизни, и поэтому вполне естественно, что они стали и объектами изучения, и орудиями молекулярной биологии. На их примере можно изучать фундаментальные основы жизни и ее проявления.
С конца 50-х годов, когда начала формироваться синтетическая область знаний, лежащая на границе неживого и живого и занимающаяся изучением живого, методы молекулярной биологии хлынули обильным потоком в вирусологию. Эти методы, основанные на биофизике и биохимии живого, позволили в короткие сроки изучить строение, химический состав и репродукцию вирусов.
Поскольку вирусы относятся к сверхмалым объектам для ,их изучения нужны сверхчувствительные методы С помощью электронного микроскопа удалось увидеть отдельные вирусные частицы, но определить их химиче ский состав можно только, собрав воедино триллионь таких частиц. Для этого были разработаны методь ультрацентрифугирования. Современные ультрацентри фуги — это сложно устроенные приборы, главной частые которых являются роторы, вращающиеся со скоростью в десятки тысяч оборотов в секунду.
Здесь нет надобности рассказывать о других методах молекулярной вирусологии, тем более что они меняются и совершенствуются из года в год быстрыми темпами Если в 60-х годах основное внимание вирусологов было фиксировано на характеристике вирусных нуклеи новых кислот и белков, то к началу 80-х годов была расшифрована полная структура многих вирусных генов и геномов и установлена не только аминокислотная пос ледовательность, но и третичная пространственная струк тура таких сложных белков, как гликопротеид гемагглю тинина вируса гриппа. В настоящее время можно не только связать изменения антигенных детерминан’ вируса гриппа с заменой в них аминокислот, но и рассчи тывать прошедшие, настоящие и будущие изменения этих антигенов
| <<< Назад | Дальше >>> |
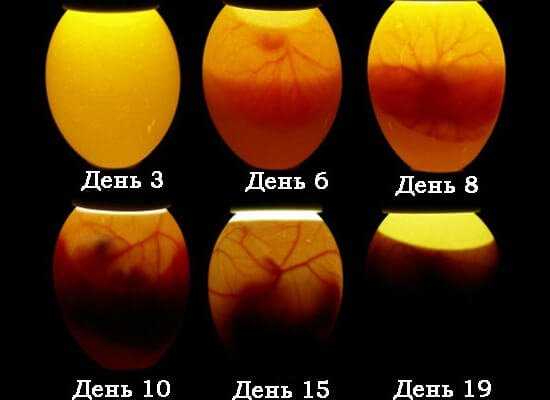
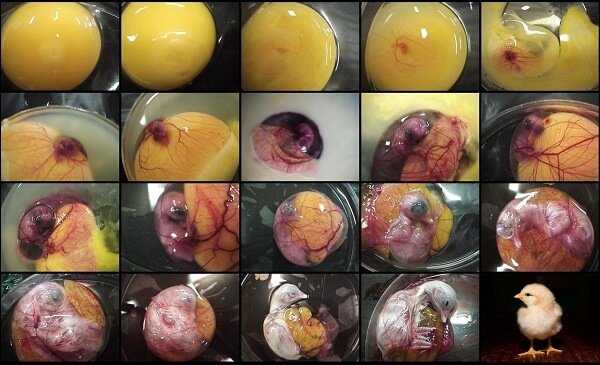
Развитие цыпленка в яйце по дням фото

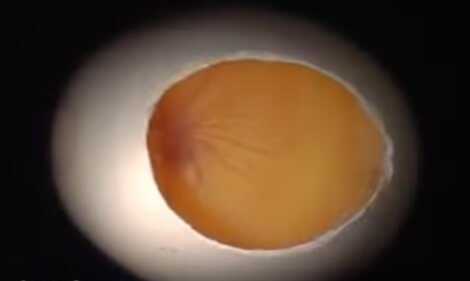
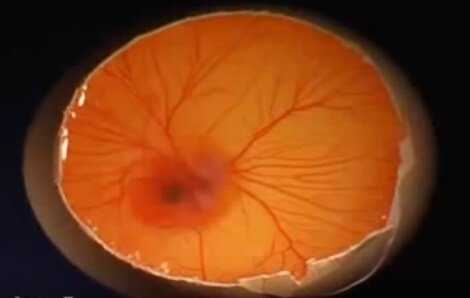

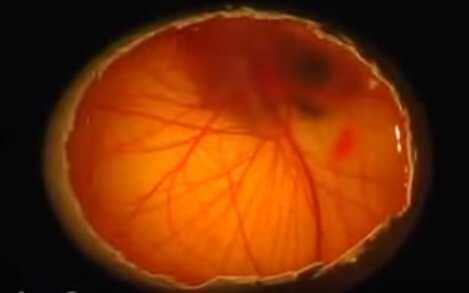
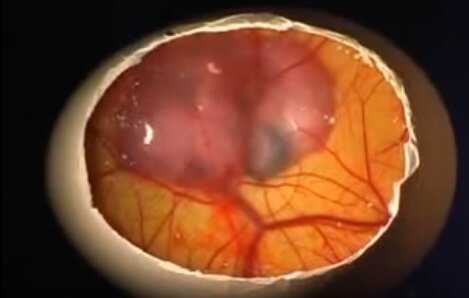
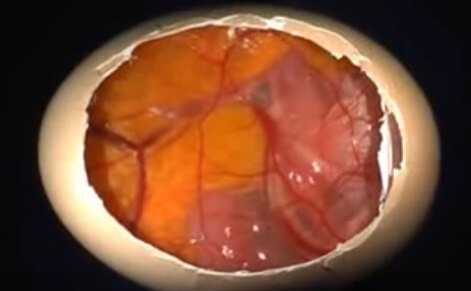

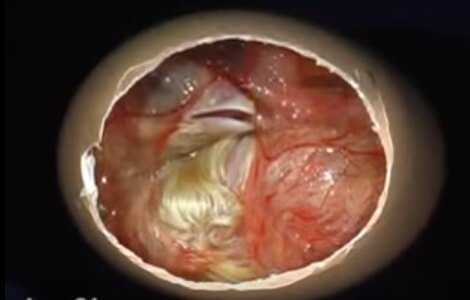
Бластодиск
Развитие цыпленка начинается с бластодиска. Бласодиск – это небольшой сгусток цитоплазмы, находящийся на поверхности желтка. В месте нахождения бластодиска плотность желтка значительно ниже, что способствует неизменному всплыванию желтка бластодиском вверх.
Эта особенность обеспечивает лучшее прогревание в процессе инкубации. Оплодотворенный бластодиск начинает деление еще в организме курицы и к моменту снесения он уже полностью окружен бластодермой. Выглядит бластодиск как небольшое белое пятнышко размером около 2 мм.
Светлый ореол, кольцом окружающий зародышевый диск является бластодермой.
При попадании яйца в благоприятные окружающие условия, остановившееся после снесения, деление клеток продолжается.

На 2 – 3 сутки инкубации начинается развитие провизорных оболочек:
- Амнион у цыпленка
- Аллантоис у цыпленка
Все они являются, по сути, временными органами, призванными выполнять функции обеспечения жизнедеятельности зародыша до момента его окончательного формирования.
Амнион у цыпленка
Представляет собой оболочку, предохраняющую зародыш от физического воздействия и высыхания, благодаря наполнению жидкостью. Амнион у цыпленка регулирует количество жидкости в зависимости от возраста зародыша.
Эпителиальная поверхность амниотического мешка способна наполнять водой полость с эмбрионом, а также обеспечивает отток жидкости по мере его роста.
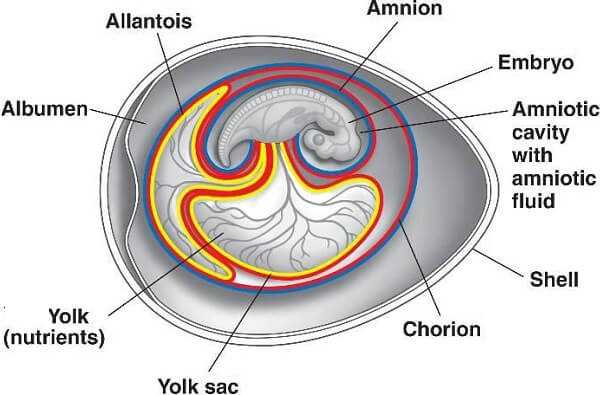
Аллантоис у цыпленка
Один из временных органов, выполняющий множество функций:
- снабжение эмбриона кислородом;
- изолирует от эмбриона отходы жизнедеятельности;
- участвует в транспорте жидкости и питательных веществ;
- осуществляет доставку минеральных веществ и кальция от скорлупы к зародышу.
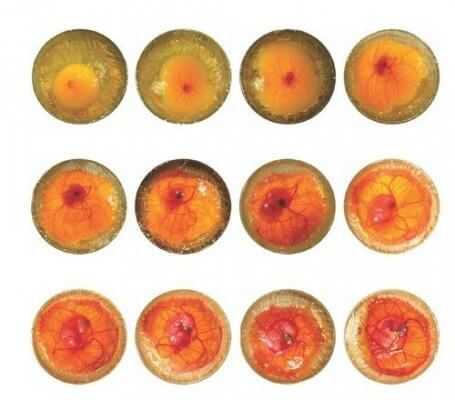
Аллантоис у цыпленка, в процессе роста, создает разветвленную сосудистую сеть, которая выстилает всю внутреннюю поверхность яйца и соединяется с птенцом через пуповину.
Культуры тканей
Попытки выращивать клетки вне организма, притом успешные, предпринимались еще в прошлом столетии. Однако только в конце 40-х годов XX века в связи с развитием производства тонких химических реактивов стало возможным получение питательных сред для выращивания клеток вне организма в виде однослойной культуры тканей. Такие однослойные культуры клеток обезьян были получены американским ученым Д. Эндерсом и его сотрудниками, и на них был выращен вирус полиомиелита. Вскоре были получены культуры разных тканей человека и многих видов животных. За этим последовал настоящий взрыв открытий вирусов человека и животных. Примерно /3 ныне известных вирусов были открыты за два десятилетия, прошедшие после введения в вирусологию метода однослойных культур тканей.
При заражении животного патогенным для него вирусом развивается болезнь с характерными для нее симптомами. При заражении культуры клеток вирусом, к которому эта культура чувствительна, обычно наблюдаются так называемые цитопатические проявления, т. е.
изменения или повреждения клеток, характерные для того или иного вируса. Так, вирус полиомиелита вызывает гибель клеток и разрежение клеточного пласта, аденовирус вызывает округление клеток и постепенную их гибель, при заражении вирусом кори происходит слияние клеток и образование гигантских клеток (сим-пласты), содержащих несколько ядер, при заражении клеток вирусами оспы в них появляются своеобразные включения, в которых происходит размножение вируса. Цитопатическое действие проявляется различно у разных вирусов и на разных клетках.
При смешивании вируса с иммунной к нему сывороткой происходит нейтрализация вируса, и поэтому в клетках, зараженных такой смесью, цитсшатический эффект не проявляется. Это наблюдение легло в основу метода титрования вирусов по цитопатическому эффекту. Титрование — это прием количественного определения вируса, при котором разведениями вируса 1:10, 1:100, 1:1000 и т. д. заражают чувствительные к нему клетки. Максимальное разведение вируса, вызывающее цитопа-тический эффект у единичных клеток клеточного пласта (монослоя), принимают за инфекционную дозу вируса. Подобным образом определяют и активность иммунных сывороток, только в этом случае берут одну и ту же дозу вируса, которую смешивают с разными разведениями иммунной сыворотки.
При использовании культур тканей, так же как и на куриных эмбрионах, удается получить очищенный вирус, который выделяется из клеток в жидкую культуральную среду. Отсюда его можно выделить, осадив в центрифуге, а затем очистить, применяя для этой цели разные методы.
Различают первичные и перевиваемые культуры тканей. Первичные готовят из органов умерщвленного животного или трупа человека, взятых в течение ближайших часов после смерти, когда большинство клеток еще сохраняют свою жизнеспособность. Кусочки органов тщательно измельчают для удаления мертвых клеток. Клеточную взвесь переваривают раствором трипсина. Затем клетки отмывают, взвешивают в культуральной (питательной) среде и разливают в плоскодонные бутылки (матрацы) или чашки. Для соблюдения стерильности все процедуры проводят в специальных боксах и к культурам клетки добавляют антибиотики, препятствующие росту случайно попавших бактерий.
Если выросшие клетки перенести в новые матрацы и чашки, то может вырасти вторичная культура, а при многократных перевивках удается получить перевиваемые культуры тканей. В настоящее время имеются многие сотни разных перевиваемых культур тканей человека и животных, которые чувствительны к разным вирусам и широко применяются для проведения вирусологических исследований.
Мы уже говорили, что культуры тканей в вирусологии произвели подлинную революцию в этой науке, так как позволили перейти от изучения вирусной инфекции к изучению самого вируса — его строения, химического состава, способа репродукции (размножения); обеспечили возможность следующего этапа развития вирусологии — выхода ее на молекулярный и субмолекулярный уровни. Разновидностью культур клеток и тканей являются органные культуры — кусочки легких, трахеи, печени, почек и других органов, которые в процессе выращивания сохраняют свойственную данному органу структуру. Некоторые вирусы более успешно выращиваются в органных культурах, чем в культурах тканей.
Положение яйца и развитие цыпленка
В последнее время все шире практикуется инкубация куриных яиц в вертикальном положении. Но такой способ не самым лучшим образом сказывается на развитии цыпленка.
При вертикальном положении, максимальный наклон при поворотах равен 45°. Этого наклона недостаточно для нормального роста аллантоиса и своевременного его смыкания. Особенно это касается крупных яиц.
При инкубации в горизонтальном положении поворот обеспечивается на 180°, что положительно влияет на рост аллантоиса и как следствие питание птенчика.
Как правило, пушистики, выведенные при вертикальном положении яиц, имеют вес на 10% ниже, чем выведенные при горизонтальном положении.
Значение поворачивания яйца для развития цыпленка
Поворачивание яиц во время инкубации необходимо на всех стадиях развития, кроме первых суток и двух последних. В первые сутки необходимо интенсивное прогревание бластодиска, а в последние сутки маленький пискун уже принял положение для пробивания скорлупы.
На начальных стадиях развития поворачивание яиц устраняет риск прилипания бластодермы или амниона к внутренней стороне скорлупы.
Поворачивание также способствует:
- сокращению амниона;
- равномерности прогревания яиц;
- принятию эмбрионом правильного положения;
- улучшению газообмена;
- своевременному смыканию аллантоиса;
- улучшению питания зародыша.
Теперь, после прочтения статьи, можно судить о сложности процессов, происходящих с маленьким петушком или курочкой во время его развития от нескольких клеток до маленькой птички. Этот процесс не менее сложен, чем развитие человеческого ребенка или, например, котенка в утробе матери, где гарантированы постоянные условия.
Развитие цыпленка в яйце по дням полностью зависит от внешних условий, обеспечение которых и является инкубацией.
Желаем всем удачного вывода желтых, серых и других пушистиков!

Подпишитесь на обновления сайта, чтобы первыми узнать куриные новости, которые помогут решить все проблемы.
Вот фото от нашей постоянной читательный Юлии Арептевой, цыпленок вывелся под !

Обновлено: 29.06.2020
103583
Лабораторные животные
А началось, как уже было сказано в первой главе, с того, что научились отличать вирусы от бактерий, а точнее — вирусные инфекции от бактериальных с помощью ультрафильтров Шамберлана и Беркефельда. Этот немудреный прием позволил Д. И. Ивановскому открыть мир вирусов, а сами вирусы многие годы обозначались как фильтрующиеся вирусы, или ультравирусы.
Вплоть до середины 30-х годов экспериментальные заражения животных или растений и ультрафильтрация являлись главными методами распознавания вирусов. Наиболее часто в качестве экспериментальных животных использовались белые мыши, белые крысы, морские свинки и кролики. Их и теперь можно встретить в вирусологических лабораториях, где они применяются с другой целью, чем на заре развития вирусологии.
К сожалению, жатва, собранная при использовании экспериментальных животных, была относительно невелика, так как они невосприимчивы к большинству вирусных инфекций человека. Когда речь шла о вирусах домашних животных, работа облегчалась: эти животные и становились экспериментальной моделью. Таким путем гениальный Л. Пастер выделил и ослабил, сделав возможным применение для прививок, вирус бешенства путем внутримозговых пассажей на кроликах еще до начала вирусологической эры. Второй из открытых вирусов — вирус ящура, поражавший крупный рогатый скот, был выделен путем заражения телят фильтратами пораженных тканей. Таким же путем были выделены от кур и пассированы на курах онкогенные вирусы (миелоб-ластоза и саркомы Рауса). К ним надо добавить вирусы чумы птиц, ложного бешенства, чумы собак и рогатого скота, бородавок разных видов животных, а также некоторые вирусы насекомых и несколько десятков вирусов растений.
К середине 30-х годов с помощью лабораторных животных были открыты возбудители гриппа и герпеса. К вирусу гриппа весьма чувствительными оказались хорьки. Использование обезьян в качестве лабораторных животных позволило открыть вирусы оспы, полиомиелита, желтой лихорадки, денге. В 40-е — 50-е годы была показана высокая чувствительность новорожденных животных — мышей, крыс и хомяков к разным вирусам, особенно к вирусам, передающимся членистоногими (арбо-вирусы). Именно путем естественного заражения (укусы насекомых в природных очагах арбовирусов) или при введении вируссодержащего материала в мозг было открыто подавляющее большинство известных в настоящее время арбовирусов. Открытие новых вирусов этими методами продолжается до сих пор.
В настоящее время стандартные лабораторные животные — мыши, крысы, морские свинки, кролики, нечувствительные к большинству вирусов человека и животных, нашли другое применение. Для идентификации любого вируса требуется сыворотка, содержащая антитела против него. Такую сыворотку можно получить путем иммунизации лабораторных животных препаратами вируса, желательно хорошо очищенного от примесей. Такая сыворотка нейтрализует только тот вирус, которым были иммунизированы лабораторные животные. В каждой вирусологической лаборатории имеется набор сывороток, специфически нейтрализующих разные вирусы. Без постановки реакций вируса с антителами (иммунологическая диагностика вирусов) были бы невозможными не только исследования, но и первичная идентификация вирусов.
Дыхание цыпленка в яйце
Кислородообмен в яйце в зависимости от стадии развития цыпленка имеет различный механизм. На начальной стадии развития, кислород поступает из желтка напрямую в клетки бластодермы.
С появлением кровеносной системы, кислород поступает уже в кровь, по-прежнему из желтка. Но желток не может полностью обеспечить дыхание быстрорастущего организма.
Начиная, с 6 дня функция обеспечения кислородом, постепенно, перекладывается на аллантоис. Рост его начинается в сторону воздушной камеры яйца и достигнув ее, покрывает все большую внутреннюю площадь скорлупы. Чем больше растет цыпленок, тем большую площадь покрывает аллантоис.
При овоскопировании он выглядит как розоватая сеть, охватывающая все яйцо и замыкающаяся с острой его стороны.


![Вирусы [1986 черкес ф.к., богоявленская л.б., бельская н.а. - микробиология]](http://lesniepolyani.ru/wp-content/uploads/6/e/b/6ebe3579e588f00ba29212e8040623b4.jpeg)



















![Вирусы [1986 черкес ф.к., богоявленская л.б., бельская н.а. - микробиология]](http://lesniepolyani.ru/wp-content/uploads/4/1/a/41a7fab65846bb582f333e8d1e9fc2f8.jpeg)






