Вопрос-ответ:
Чем отличается бром от йода?
Бром и йод являются различными химическими элементами, принадлежащими к группе галогенов. Основные отличия между ними заключаются в физических свойствах, таких как цвет, запах, температура плавления и кипения.
Какой цвет имеет бром?
Бром является красно-коричневым элементом. Его цвет может варьироваться от ярко-красного до красно-коричневого, в зависимости от его концентрации.
Какова температура плавления брома и йода?
Температура плавления брома составляет около -7,2 градусов Цельсия, в то время как температура плавления йода составляет около 113,7 градусов Цельсия.
Какие особенности у йода?
Йод является темно-синим или фиолетовым элементом. Он имеет характерный запах и может образовывать пары при комнатной температуре.
В каких областях применяется бром?
Бром находит широкое применение в различных областях. Он используется как антибактериальное средство, а также в производстве огнезащитных материалов, фотосенсибилизаторов и фармацевтических препаратов.
Что можно сказать о применении йода?
Йод имеет множество применений. Он используется в медицине для лечения заболеваний щитовидной железы, а также в производстве пищевых добавок, антисептиков и косметики.
Можно ли использовать бром и йод вместе?
Бром и йод могут использоваться вместе в различных химических реакциях и процессах. Они могут взаимодействовать друг с другом и образовывать новые соединения.
Страницы
- Главная страница
- ОСНОВЫ ОБЩЕЙ ХИМИИ
- 1.1 Важнейшие классы неорганических веществ
- 2.1 Вещества. Атомы
- 2.2 Размеры атомов
- 2.3 Молекулы. Химические формулы
- 2.4 Простые и сложные вещества
- 2.5 Валентность элементов
- 2.6 Моль. Молярная масса
- 2.7 Закон Авогадро
- 2.8 Закон сохранения массы веществ
- 2.9 Вывод химических формул
- 3.1 Строение атома. Химическая связь
- 3.2 Строение атома
- 3.4 Строение электронной оболочки атома
- 3.5 Периодическая система химических элементов
- 3.6 Зависимость свойств элементов
- 3.7 Химическая связь и строение вещества
- 3.8 Гибридизация орбиталей
- 3.9 Донорно-акцепторный механизм образования
- 3.10 Степени окисления элементов
- 4.1 Классификация химических реакций
- 4.2 Тепловые эффекты реакций
- 4.3 Скорость химических реакций
- 4.4 Необратимые и обратимые реакции
- 4.5 Общая классификация химических реакций
- НЕОРГАНИЧЕСКАЯ ХИМИЯ
- 5.1 Растворы. Электролитическая диссоциация
- 5.2 Количественная характеристика состава растворов
- 5.3 Электролитическая диссоциация
- 5.4 Диссоциация кислот, оснований и солей
- 5.5 Диссоциация воды
- 5.6 Реакции обмена в водных растворах электролитов
- 5.7 Гидролиз солей
- 6.1 Важнейшие классы неорганических веществ
- 6.2 Кислоты, их свойства и получение
- 6.3 Амфотерные гидроксиды
- 6.4 Соли, их свойства и получение
- 6.5 Генетическая связь между важнейшими классами
- 6.6 Понятие о двойных солях
- 7.1 Металлы и их соединения
- 7.2 Электролиз
- 7.3 Общая характеристика металлов
- 7.4 Металлы главных подгрупп I и II групп
- 7.5 Алюминий
- 7.6 Железо
- 7.7 Хром
- 7.8 Важнейшие соединения марганца и меди
- 8.1 Неметаллы и их неорганические соединения
- 8.2 Водород, его получение
- 8.3 Галогены. Хлор
- 8.4 Халькогены. Кислород
- 8.5 Сера и ее важнейшие соединения
- 8.6 Азот. Аммиак. Соли аммония
- 8.7 Оксиды азота. Азотная кислота
- 8.8 Фосфор и его соединения
- 8.9 Углерод и его важнейшие соединения
- 8.10 Кремний и его важнейшие соединения
- ОРГАНИЧЕСКАЯ ХИМИЯ
- 9.1 Основные положения органической химии. Углеводороды
- 9.2 Электронные эффекты заместителей в органических соединениях
- 9.3 Предельные углеводороды (алканы)
- 9.3.1 Насыщенные УВ. Метан
- 9.4 Понятие о циклоалканах
- 9.5 Непредельные углеводороды
- 9.6 Диеновые углеводороды (алкадиены)
- 9.7 Алкины
- 9.8 Ароматические углеводороды
- 9.9 Природные источники углеводородов
- 10.1 Кислородсодержащие органические соединения
- 10.2 Фенолы
- 10.3 Альдегиды
- 10.4 Карбоновые кислоты
- 10.5 Сложные эфиры. Жиры
- 10.6 Понятие о поверхностно-активных веществах
- 10.7 Углеводы
- 11.1 Амины. Аминокислоты
- 11.2 Белки
- 11.3 Понятие о гетероциклических соединениях
- 11.4 Нуклеиновые кислоты
- 12.1 Высокомолекулярные соединения
- 12.2 Синтетические волокна
Неметаллы
Йод в кристаллахХлор. Получение в лабораторииЙод в спиртовом растворе (справа), переход йода в органическое соединение (справа) Хлор, бром, йод, собраны в колбы (слева направо) — представители ряда галогенов Хлор, собранный в колбы
Хлор, собранный в колбы
Неметаллы — это простые вещества. К типичным неметаллам относятся газы и жидкости. Неметаллы в отличии от металлов на много хуже проводят электрический ток, существенно отличаются по физико-механическим свойствам и температуре перехода в агрегатные состояния.
Однако, некоторые неметаллы обладают выраженными металлическими свойствами — блеском (например кристаллическая сера, кристаллический йод, углерод и т.д.).
В таблице Менделеева металлические свойства простых веществ (или химических элементов) уменьшаются слева направо, а неметаллические свойства увеличиваются. По своей природе это можно объяснить изменением (увеличением!) количества электронов на последнем орбитальном уровне (их ещё называют валентными электронами). Чем более выражены неметаллические свойства у химического элемента, тем он «проще» вступает в химические реакции с типичными металлами, восполняя свою последнюю орбиталь недостающими электронами и образуя при этом прочные (с точки зрения химии) химические соединения.
Получение и применение галогенов
1. Галогены получают с помощью электролиза растворов или расплавов галогенидов:
2. Галогены получают при реакции окисления галогенводородных кислот:
Применение галогенов
1. Фтор (F):
- ядерная промышленность;
- металлургия;
- химический синтез;
- окислитель ракетного топлива.
2. Хлор (Cl):
- органический и полимерный синтез;
- химическая промышленность;
- очистка воды;
- хлорирование руд для извлечения металлов.
3. Бром (Br):
- органический синтез;
- производство фото;
- фармацевтика;
- повышение детонационной стойкости бензина.
4. Йод (I):
- металлургия;
- деревообработка;
- промышленность;
- фармацевтика, медицина;
- пищевые добавки.
Распределение в природе и добыча
Содержание брома в земной коре и иода в ней невысоко: 310⁻⁵% и 410⁻⁶% соответственно. Однако, существуют множество источников, которые позволяют получить эти элементы.
Промышленное получение бромной воды осуществляется, главным образом, из некоторых соляных озер (содержание 0,01-0,5% Br) и морской воды (0,007% Br в среднем). Кроме того, бром добывается из бромистых соединений, которые часто являются примесями в природных месторождениях калийных солей, и из буровых вод нефтеносных месторождений вблизи (содержание 0,01-0,1% Br).
Добыча иода в промышленных масштабах обычно осуществляется из объема буровых вод, которые в среднем содержат 0,003% J. Зола морских водорослей также является дополнительным источником этого элемента.
Химические свойства галогенов
Ключевые слова конспекта: химические свойства галогенов, реакция галогенов с металлами, реакции с неметаллами, реакции галогенов с водой, со щелочами, с солями-галогенидами.
Раздел ОГЭ: 3.1.2. Химические свойства простых веществ-неметаллов: водорода, кислорода, галогенов, серы, азота, фосфора, углерода, кремния
Вначале необходимо прочитать конспект «Галогены: характеристика, строение, получение»
1. Реакция с металлами.
Галогены реагируют практически со всеми металлами (кроме благородных металлов) с образованием галогенидов. Например, натрий горит в хлоре: 2Na + Cl2 = 2NaCl
Со фтором реакции идут очень бурно, с йодом – только при нагревании, часто требуется вода как катализатор.
Окислительная активность галогенов снижается от фтора к йоду
Это можно продемонстрировать на примере окисления железа (обратите внимание на его степень окисления в галогенидах):. В ходе реакции с бромом Вг2 может образоваться как FeBr3, так и FeBr2:
В ходе реакции с бромом Вг2 может образоваться как FeBr3, так и FeBr2:
В реакции с йодом I2 при температуре 500 °С образуется Fel2:
Фтор, хлор и бром окисляют железо глубже (до Fe3+), чем йод.
2. Реакции с неметаллами.
Окислительную способность галогенов можно сопоставить и в реакциях с неметаллами. Галогены реагируют со многими неметаллами (исключением являются благородные газы, азот N2, кислород O2).
Галогены реагируют с водородом, при этом условия проведения реакции зависят от того, с каким из галогенов проводится реакция:
Со фтором реакция может начинаться даже при t° = –250 °С, с хлором реакция идёт при сгорании водорода в хлоре или даже при комнатной t° на свету. С бромом и йодом реакция идёт при температуре 350–500 °С или при наличии катализатора платины Pt. Реакция образования йодоводорода HI обратима. Таким образом, по мере увеличения относительной молекулярной массы галогена от фтора F2 к иоду I2 условия проведения реакции должны быть более жёсткими.
Галогены реагируют с серой. Фтор взаимодействует с серой даже при температуре жидкого воздуха, окисляя её до высшей степени окисления:
Реакция серы с хлором приводит к образованию либо SCl2, либо S2Cl2:
Обратите внимание: здесь встретилась сравнительно редкая для серы степень окисления +2. С йодом сера не реагирует
Более глубокое окисление серы в реакции со фтором демонстрирует более высокую окислительную способность фтора
С йодом сера не реагирует. Более глубокое окисление серы в реакции со фтором демонстрирует более высокую окислительную способность фтора.
Галогены реагируют с фосфором. Красный и белый фосфор уже при комнатной температуре самовоспламеняется во фторе и хлоре, реагирует с жидким бромом. При этом в реакции со фтором происходит более глубокое окисление фосфора:
В реакциях фосфора с хлором и бромом могут образоваться РCl3 и РВг3, но по мере повышения температуры в результате окисления фосфора глубина окисления возрастает – образуются РCl5 и РВг5.
Фтор реагирует с графитом при температуре выше 900 °С:
Остальные галогены не реагируют с простыми веществами, образованными углеродом (алмазом, графитом).
3. Реакции с водой.
Рассмотрим реакции галогенов со сложными веществами. Галогены взаимодействуют с водой. При этом фтор окисляет кислород воды. Пары воды горят в атмосфере F2:
Хлор обратимо реагирует с водой, но при этом не происходит окисление кислорода. В этой реакции хлор сам является как окислителем, так и восстановителем (такие реакции называют реакциями диспропорционирования):
5. Реакции галогенов с солями-галогенидами.
Галогены способны вытеснять друг друга из солей-галогенидов и из галогеноводородов. Фтор F2 вытесняет все остальные галогены из галогеноводородов и галогенидов (в растворах параллельно идёт реакция окисления воды). Хлор Cl2 вытесняет бром и йод из НВг, бромидов, HI и иодидов. Бром Вг2 вытесняет йод из йодидов и йодоводорода. Йод I2 не вытесняет другие галогены:
Признаком данной реакции в растворе является изменение окраски с бесцветной на жёлтую.
Конспект урока по химии «Химические свойства галогенов». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
Хлор
Типичными неметаллами являются газы. Они не проявляют при нормальных условиях ни одного сходного с металлами свойства.
Элемент хлор (Сl2). При нормальных условиях хлор — это желтовато–зелёный газ с резким удушливым запахом. Хлор очень ядовит даже при такой малой концентрации как 0,001 мг на 1 дм3 воздуха. Этот газ в 2.5 раза тяжелее воздуха, поэтому всегда будет находится у самой земли в виде желтовато-зелёного тумана.
При содержании хлора в воздухе 0,9 мл/л смерть наступает в течение пяти минут. В небольших количествах (человек чувствует хлор уже при концентрации его в воздухе 0,003 мл/л), он сильно раздражает слизистые оболочки дыхательных путей и вызывает кашель.
Хлор напрямую не взаимодействует с кислородом, азотом, углеродом и инертными газами. Окислительные свойства хлора проявляются в реакциях с простыми веществами (металлическим натрием Na, железом Fe, фосфором P, серой S) и некоторыми сложными веществами.
Хлор содержится в земной коре по массе 0,017%. В некоторых горных районах он покрывает основание грунта и потому приводит к гибели насекомых, мелких грызунов и микроорганизмов. Температура кипения хлора равна (- 33,6 °С), а температура плавления (-100,98 °С).
Хлор относится к ряду галогенов (фтор F2, хлор Cl2, бром Br2, йод I2, астат At2 ), что придаёт ему некоторые особенности в химических реакциях. В реакциях с другими галогенами он вытесняет любой из галогенов, стоящих после него (бром, йод и астат).
Газообразный хлор отлично растворяется в холодной воде, 1 объём воды растворяет около 2 объёмов хлора с образованием двух кислот: соляной кислоты (HCl) и хлорноватистой (HClO), последняя не стойкая и распадается на атомарный кислород и соляную кислоту. Полученная кислота является одной из сильных кислот.
Хлор имеет прекрасное дезенфицирующее свойство. Он уничтожает практически все живые организмы в сфере своего влияния, что делает его полезным в медицине и домашнем хозяйстве (порошки, хлорка – то же хлорная вода, соды с содержанием хлора). Сухой хлор такой способности не имеет. Раствор хлора в воде носит название «хлорной воды» которая имеет прекрасное свойство отбеливания материалов (тканей, дерева, бумаги и т.д.). Раствор хлора «уничтожает» краску на одежде, поэтому если не хотите, чтобы ваша кофточка или рубашка покрылась белыми пятнами — не используйте такую воду при стирке цветного белья. Достаточно просто поместить влажную крашенную ткань в струю хлора, как вскоре она потеряет свой цвет и превратится в чисто-белую.
Как хлорная вода влияет на волосы при купании например в бассейне (можно ознакомиться на странице ).
Получение хлора
Хлор — ядовитый газ, тяжелее воздуха, поэтому при реакции будет скапливаться на дне колбы
Для проведения химической реакции нам понадобится и соляная кислота.
В одну колбу насыпьте немного перманагната калия, присоедините к этой колбе трубку для отвода хлора, который выделится при реакции с марганцовки с соляной кислотой. Другой конец трубки опустите в пустую колбу (её желательно накрыть крышкой (чтобы случайно не вдохнуть!). Желательна такая конструкция, как на картинке слева. Если всё готово, приступим:
Прилейте соляную кислоту к марганцовке. Наблюдайте выделение жёлто-зелёного газа — это хлор. Реакция протекает следующим образом:
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O
Вещества, которые образуются при реакции (кроме хлора) — 2 соли — хлорид калия KCl и хлорид марганца MnCl2, а также вода.
Химические свойства водорода
С точки зрения свойств водорода как простого вещества, он, все-таки, имеет больше общего с галогенами. Водород, также как и галогены, является неметаллом и образует аналогично им двухатомные молекулы (H2).
В обычных условиях водород представляет собой газообразное, малоактивное вещество. Невысокая активность водорода объясняется высокой прочностью связи между атомами водорода в молекуле, для разрыва которой требуется либо сильное нагревание, либо применение катализаторов, либо и то и другое одновременно.
Взаимодействие водорода с простыми веществами
с металлами
Из металлов водород реагирует только с щелочными и щелочноземельными! К щелочным металлам относятся металлы главной подгруппы I-й группы (Li, Na, K, Rb, Cs, Fr), а к щелочно-земельным — металлы главной подгруппы II-й группы, кроме бериллия и магния (Ca, Sr, Ba, Ra)
При взаимодействии с активными металлами водород проявляет окислительные свойства, т.е. понижает свою степень окисления. При этом образуются гидриды щелочных и щелочноземельных металлов, которые имеют ионное строение. Реакция протекает при нагревании:
Следует отметить, что взаимодействие с активными металлами является единственным случаем, когда молекулярный водород Н2 является окислителем.
с неметаллами
Из неметаллов водород реагирует только c углеродом, азотом, кислородом, серой, селеном и галогенами!
Под углеродом следует понимать графит или аморфный углерод, поскольку алмаз — крайне инертная аллотропная модификация углерода.
При взаимодействии с неметаллами водород может выполнять только функцию восстановителя, то есть только повышать свою степень окисления:
Взаимодействие водорода со сложными веществами
с оксидами металлов
Водород не реагирует с оксидами металлов, находящихся в ряду активности металлов до алюминия (включительно), однако, способен восстанавливать многие оксиды металлов правее алюминия при нагревании:
c оксидами неметаллов
Из оксидов неметаллов водород реагирует при нагревании с оксидами азота, галогенов и углерода. Из всех взаимодействий водорода с оксидами неметаллов особенно следует отметить его реакцию с угарным газом CO.
Смесь CO и H2 даже имеет свое собственное название – «синтез-газ», поскольку из нее в зависимости от условий могут быть получены такие востребованные продукты промышленности как метанол, формальдегид и даже синтетические углеводороды:
c кислотами
С неорганическими кислотами водород не реагирует!
Из органических кислот водород реагирует только с непредельными, а также с кислотами, содержащими функциональные группы способные к восстановлению водородом, в частности альдегидные, кето- или нитрогруппы.
c солями
В случае водных растворов солей их взаимодействие с водородом не протекает. Однако при пропускании водорода над твердыми солями некоторых металлов средней и низкой активности возможно их частичное или полное восстановление, например:
Физические свойства галогенов
Рассматривая вещества, нужно обратить внимание на физическое состояние и свойства этой химической группы элементов. В ходе исследований стало известно, что галогены способны сохранять первоначальное молекулярное строение во всех агрегатных состояниях (жидкость, газ, твердый элемент)
Их активность во взаимодействии с другими веществами достаточно высокая.
Галогены — простые вещества, имеющие несложный молекулярный состав (2 атома с ковалентной неполярной связью). Формулы, соответственно, пишутся следующим образом:
- Cl₂.
- F₂.
- I₂.
- Br₂.
Заряд ядра равен порядковому номеру элемента в периодической таблице Менделеева. Вещества проявляют способность к кипению и плавлению. Свойственна им и электропроводимость. Но рассматриваемая группа веществ плохо проводит электричество и тепло.
Их электроотрицательность постепенно снижается с возрастанием порядкового номера.
Нужно также обратить внимание и на то, какой кристаллический рисунок имеют вещества этой группы. Галогены обладают интересной решёткой
Атомы в количестве 2-х единиц, содержат на внешнем энергетическим уровне 7 электронов. Эти вещества способны окислять, так как до завершения уровня им не хватает всего 1-го электрона.
В результате окислительные свойства выраженные и достаточно яркие. Именно по этой причине в природе в чистом виде эти вещества встречаются крайне редко. Встретить галогены можно в составе разнообразных солей. Нужно отметить, что реакция с кислотами, в состав которых включены рассматриваемые элементы, возрастает с увеличением показателей их атомной массы.

Некоторые галогены встречаются крайне редко
Также к физическим свойствам следует отнести характерный резкий и достаточно неприятный запах. Растворимость в воде плохая, токсичность высокая (пример: хлор).
Особенностью является тот факт, что с увеличением показателей атомной массы окраска галогена становится более насыщенной и темной. По этой же причине возрастает температура, которая требуется для начала плавления и кипения.
Вдыхать испарения нельзя. Работать с веществами из этой группы рекомендуется в защите (глаза, руки, органы дыхания).
Краткая характеристика соединений брома и йода
Чтобы начать рассмотрение различий, нужно обратить внимание на характеристику каждого из элементов. Только после сравнения будет наглядно видна разница между ними
Для того чтобы определить основное отличие рассматриваемых веществ, рекомендуется рассмотреть их основные свойства.
Бром обозначается в периодической таблице, как Br. Атомный номер (число, по которому можно найти) — 35.
В обычных условиях, при комнатной температуре и без нагревания или охлаждения вещество имеет коричнево-красный оттенок. Представляет собой жидкость.
Особенность брома состоит в том, что этот химический элемент хотя и относится к группе неметаллов, но когда температура комнатная, он находится в жидком агрегатном состоянии.
Особенности, которые необходимо учитывать:
- галогенид;
- имеет неприятный запах;
- пары коричневого цвета.
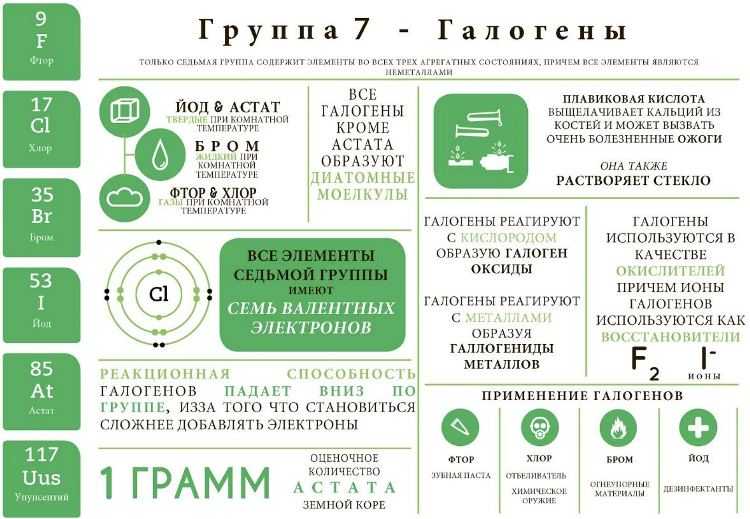
Галогены инфографика
Молекула обозначается в формулах, как Br₂ . Если сравнивать его с йодом, то с химической точки зрения этот металл является более активным, чем йод. Одновременно он уступает по этому показателю таким веществам, как хлор или фтор (или соединениям, таким как фторид).
Бром — вещество природного происхождения. Месторождения имеются в Китае или Америке.
С помощью электролиза можно извлечь бром из солевых отложений. Это первое вещество, которое удалось получить из морской воды.
Теперь нужно разобраться с тем, что представляет собой молекула йода и вещество в целом. Объединяет его с бромом то, что элемент является галогеном. Атомный номер — 53.
Нужно обратить внимание на то, что вещество находится в твердом состоянии при нормальных условиях (комнатной температуре и обычном давлении). Йод относится к группе неметаллов
Важен тот факт, что вещество представляет собой кристалл. Цвет черный с характерным блеском.
Если же происходит нагрев и последующее кипение, элемент преобразуется. Возникает пар, который имеет фиолетовый оттенок. В воде йод и его соединения растворяется плохо, но достаточная активность проявляется при взаимодействии с неполярными растворителями, такими, как, например, гексан.

Йод в привычном виде
Применение:
Хлор применяют во
многих отраслях промышленности, науки и бытовых нужд:
— В производстве поливинилхлорида, пластикатов, синтетического каучука;
— Для отбеливания ткани и бумаги;
— Производство хлорорганических инсектицидов — веществ, убивающих вредных для
посевов насекомых, но безопасных для растений;
— Для обеззараживания воды — «хлорирования»;
— В пищевой промышленности зарегистрирован в качестве пищевой добавки E925;
— В химическом производстве соляной кислоты, хлорной извести, бертолетовой
соли, хлоридов металлов, ядов, лекарств, удобрений;
— В металлургии для производства чистых металлов: титана, олова, тантала,
ниобия.
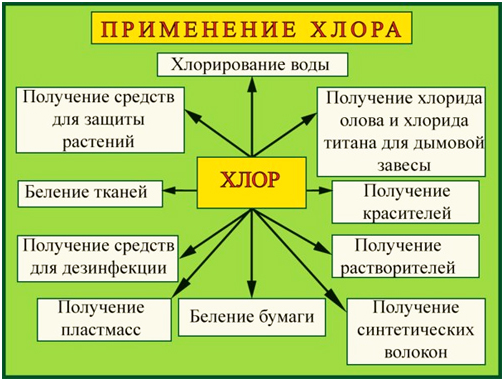
Применение в промышленности
Бром и йод широко используются в различных отраслях промышленности благодаря своим уникальным свойствам и характеристикам.
Бром
- Бромистый огонь, получаемый путем сжигания брома, используется в фотографии и киноиндустрии для создания эффектов дыма и пожара.
- Бром применяется в производстве огнезащитных средств, таких как огнезащитные краски и покрытия, которые защищают материалы от возгорания.
- Бромные соединения используются в процессе получения полимеров, таких как пластмассы и синтетические волокна.
- Бром содержится в многих химических реагентах, применяемых в лабораторных исследованиях и анализе.
Йод
Йод используется в медицинской промышленности для производства антисептических растворов, таких как йодированный спирт и йодированное масло. Йод используется в производстве фоточувствительных материалов для фотографии. Йод является важным компонентом в производстве красителей, лекарственных препаратов и косметических средств
Йод применяется в процессе получения органических соединений, таких как йодоорганические соединения, которые имеют важное значение в фармацевтической и агрохимической промышленности
Оба вещества также могут использоваться в процессах очистки воды и в производстве электроники и полупроводников. Их применение в промышленности зависит от их химических свойств и потенциальных преимуществ в конкретной области.
Применение брома
Бром это элемент химической таблицы, который имеет множество применений. Он используется для выработки моторных бензинов с повышенным качеством, а также находит широкое применение в фотографии и медицине.
Например, соединения брома широко применяются в производстве фотопленок и фотобумаги. Они также используются в медицине для лечения заболеваний щитовидной железы и как анестетики. Кроме того, бром используется в производстве огнезащитных составов, которые помогают предотвратить распространение огня в зданиях и автомобилях.
Таким образом, можно сделать вывод, что бром является важным элементом в нашей жизни, который находит широкое применение в различных областях, начиная от производства моторных бензинов и заканчивая медициной и огнезащитными составами.
В медицине
Бром, химический элемент принадлежащий к галогенам, широко применяется в медицине для лечения многих заболеваний. К примеру, бромиды используются как успокоительные и снотворные средства, а также как антиконвульсанты при лечении эпилепсии. Бром также применяется в качестве противовоспалительного средства, антисептика, противогрибкового и противовирусного препарата. Бром помогает уменьшить аллергические реакции, улучшить кровообращение, а также может снижать уровень тревожности и нервозности у пациентов. В некоторых случаях, бром может быть использован для лечения дерматита и других кожных заболеваний.
В фотографиях
Фотографические эмульсии и фоточувствительные материалы содержат бромиды, которые играют важную роль в создании изображений. Бромиды используются в фотоэмульсиях для улучшения их светочувствительности и контрастности. Они также могут служить в качестве промежуточных продуктов при синтезе других химических соединений. Кроме того, бромиды могут применяться в медицине, в частности, в качестве противосудорожного средства при лечении эпилепсии.
В химической промышленности
Бромовые соединения – это группа химических соединений, которые нашли широкое применение в различных областях науки и промышленности. Например, бромиды – это важный ингредиент в фотохимических процессах и медицине. Бромиды используются для лечения различных заболеваний, таких как эпилепсия, болезнь Паркинсона и т.д. Органобромные соединения, с другой стороны, широко используются в качестве реагентов в различных синтезах, таких как синтез медицинских препаратов и пищевых добавок. Бром также может использоваться в качестве катализатора в различных процессах, таких как полимеризация, альдольная конденсация и др. Например, бром может быть использован в производстве поликарбонатов, которые широко используются в автомобильной и строительной промышленности. Кроме того, бром может быть использован в качестве антипиренных и антисептических добавок в различных материалах, таких как текстиль, дерево и пластмассы.
Слайды и текст этой презентации
Слайд 1Выполнила: Студентка 1-го курса специальности География и Английский язык 181
гр. НГПУ Третьяк ЛидияЙод и бром в природных водах юга
Западной Сибири
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
НОВОСИБИРСКИЙ ГОСУДАРСТВЕННЫЙ ПЕДАГОГИЧЕСКИЙ УНИВЕРСИТЕТ

и на каких территориях концентрация больше.

Слайд 3 Грунтовые
и подземные воды территории
Барабинской и Кулундинской равнин, территории Васюганской и Предалтайской равнин, территории Сибирских Увалов и Горного Алтая
Изученные воды

периода, с атомным номером 35. Обозначается символом Br. Химически активный
неметалл, относится к группе галогенов.
Элемент 17-й группы периодической таблицы химических элементов, пятого периода, с атомным номером 53. Обозначается символом I. Химически активный неметалл, относится к группе галогенов.

в природных водах- молекулярная, ионная.
Йод и бром
*по классификации Перельмана

Слайд 6
Нахождение в природе: в щелочных водах
в кислой среде
Йод и бром
йодид, йодат-анионы, свободный йод, гиппойодит-анион
бромид-анион, гипобромит-анион, свободный бром
Йодид, свободный галоген
Бромид, свободный галоген

Слайд 7 Содержание этих галогенов в водоисточниках определяется высокой растворимостью
их водных перемещений или препятствующие им.
Йод и бром

3,61 – 22,8
Йод и бром


Слайд 10 Адсорбция галогенов породами и почвами на пути движения
от моря
Йод и бром
Факторы, влияющие на исчезновение элементов из вод:

вод.(Минерализация — сумма всех растворимых в воде веществ — ионов,
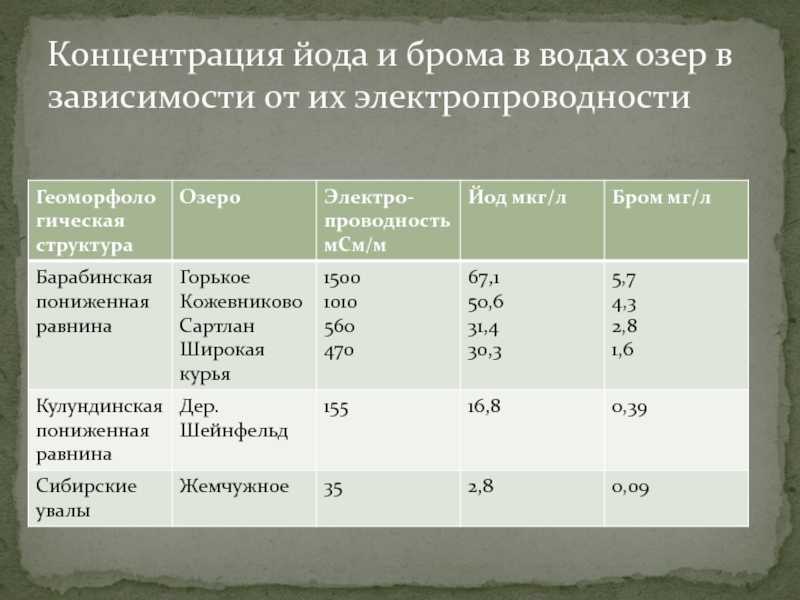
биологически активных элементов (исключая газы), выражается в граммах на 1 л воды) Концентрация в природных водах является функцией их минерализации. Так же замечено, что в водах с высокой электропроводностью(Электропроводностью воды называется её способность пропускать электрический ток, которая выражена в числовой форме) концентрация йода и брома возрастает. Это связанно с повышением уровня минерализации и содержанием катионов, связывающих бром и йод.
Йод и бром

формированию солонцово-солончаковых почвенных комплексов)
Йод и бром

меньше, чем на Барабинской равнине( легкие по составу породы и
сформировавшиеся почвы, большая выровненность поверхности)
Йод и бром

из почв)
Йод и бром


Слайд 18Концентрация йода и брома в воде отражает йодойно-бромный уровень местности.
Она свидетельствует о наличии подвижных соединений элементов, доступных для усвоения
растительностью и поступления в организм человека и животных.Концентрация йода – 3,0-3,5 мкг/л(ниже нормы)Концентрация брома меняется от 0,15-,18 в питьевой воде и 0,2 мкг/л в природных.
Йод и бром

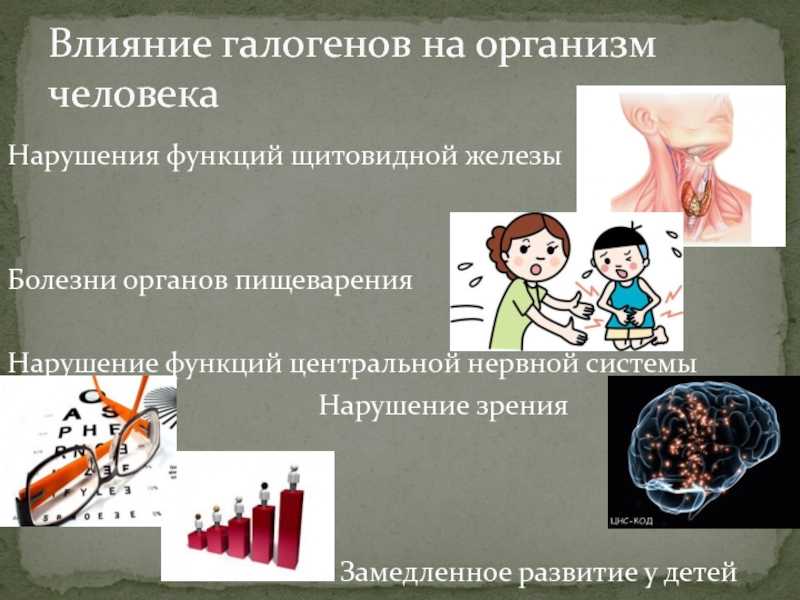
Нарушение зрения За Замедленное развитие у детей
Влияние галогенов на организм человека
Кулунды, которые обеспечены бромом. Стабильно низкий уровень йода и брома
в питьевой воде.Выяснилось, что компенсированием недостатка йода в питьевой воде является хлорирование, йодирование.
Йод и бром. Выводы

Заключение
Если рассматривать строение веществ, то атомы брома и иода отличаются радиусом (у брома он меньше, так как он находится в 4-м периоде). Также и
хлор отличается от элемента брома агрегатным состоянием. В первом случае — это газ, во втором — жидкость. С возрастаем порядкового номера у веществ возрастает плотность, они начинают лучше реагировать на присутствие кислорода или водорода. Наблюдается различных реакционный механизм. Так фтор или хлор могут взрываться при взаимодействии с водой или кислородом, но йод нет. Влияет на это строение веществ и их порядковые номера в периодической таблице.






























