ДНК-полимеразная реакция (ПРЦ)
Полимеразная цепная реакция (ПЦР) – экспериментальный метод молекулярной биологии, при котором малые концентрации определенных фрагментов нуклеиновых кислот в биологической пробе многократно увеличиваются. Это позволяет точнее определить вид или другую систематическую категорию исследуемого биологического объекта.
Применение ДНК-полимеразной реакции позволяет значительно увеличить точность метода ДНК-зондов. В основе полимеразной цепной реакции (ПЦР) лежит многократный процесс удвоения специфического участка нуклеотидной последовательности, ускоряемое по принципу катализа ДНК-зависимой ДНК-полимеразой, а так же применение соответствующего праймера.
Праймер – это фрагмент ДНК, несущий наиболее специфичную для данного микроорганизма нуклеотидную последовательность участка гена или гена в целом. С помощью праймера обнаруживают искомый фрагмент идентифицируемого микроорганизма.
Исследование ферментативной активности и метаболизма
Исследование ферментативной активности и метаболизма бактериальных клеток начинается с подбора питательных сред, на которых изучаемые микроорганизмы смогут проявить нужные исследователю свойства.
Для приготовления питательных сред используются:
- продукты животного происхождения;
- продукты растительного происхождения;
- органические и неорганические соединения определенного химического состава.
По своему составу питательная среда должна быть:
с подходящим для конкретного вида микроорганизмов уровнем рН (кислотностью);
с достаточным уровнем влажности, поскольку для бактерий важно состояние осмотического давления внешней среды;
изотоничной и стерильной.
После создания питательной среды осуществляется посев на нее биологического материала и выделение чистой культуры.
После выделения и идентификации чистой культуры изучаются ее биохимические свойства и ферментативная активность.
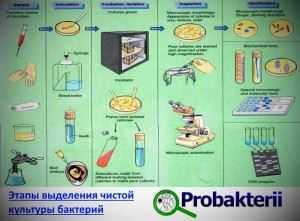
Для определения ферментативной активности бактериальной клетки выделенную культуру засевают на дифференциально-диагностические питательные среды, которые заранее созданы под выявление того или иного фермента.
- Для обнаружения сахаролитической биохимической активности клетки исследуемой культуры засевают в пять пробирок, в которые закладывают разные органические сахара. В зависимости от того, в какой из пробирок будет выявлена биохимическая активность (сработает цветовой индикатор), определяется, какими сахаролитическими свойствами обладает исследуемая бактериальная клетка.
- Для определения протеолитической активности чистую бактериальную культуру засевают на мясопептонный желатин. Там, где под действием протеолитического фермента происходит расщепление белков желатина (разжижение), там и фиксируется присутствие протеолитического фермента. Для определения глубины работы протеолитических ферментов при данных анализах проводят исследование на выявление индола и сероводорода (конечных продуктов протеолитического распада).
- Установление редуцирующей способности бактерий производится с засеванием лакмусового молока. Присутствие редуктазы проявляется специфическим обесцвечиванием молока.
- Выявление каталазы происходит путем фиксации на плотной питательной среде в чашке Петри появления пузырьков газа, который выделяется в результате расщепления перекиси водорода под действием каталазы.
Данные исследования позволяют определить основные свойства тех или иных микробов. Так, присутствие протеолитического или сахаролитического фермента – свидетельство наличия патогенных для человека, животных и растений свойств изучаемого микроорганизма.
Изучение морфологии и подвижности
Морфологическое исследование в основном направлено на идентификацию бактерий.
Изучение форм и выявление подвижности проводится методом микроскопирования живых бактерий.
Основные структуры микроорганизма анализируются в препаратах раздавленной или висячей капли. Это способ нанесения бульонного раствора с бактериальной культурой на предметное стекло.
Этот метод определения строения бактерии может проводиться путем наблюдений в «темном поле зрения».

Анализ с использованием различных способов окрашивания предполагает, что окрашиваться будут убитые микробные клетки, поскольку они лучше окрашиваются.
Для проведения анализа необходимо осуществить несколько манипуляций:
- Приготовить мазок исследуемого материала. В эту стадию входит работа с исследуемым материалом (кровь, мокрота и т.д.).
- Высушивание и фиксация мазка химическим или физическим способом.
- Выбор вида окрашивания (сложный или простой).
Простым способом бактериальные клетки окрашивают в большинстве случаев только для того, чтобы выявить в исследуемом материале присутствие микроорганизмов. Этот способ представляет собой окрашивание мазка метиленовым синим. Данный краситель окрашивает фон мазка на порядок слабее, чем клетки самих микроорганизмов.
Обнаружение основных структур бактериальной клетки осуществляется с использованием сложного окрашивания:
- метод Грама (определение свойств клеточной стенки);
- окраска на выявление спор;
- окраска по Романовскому-Гимзе окрашивает в разные цвета основные структуры клетки;
- выявление капсул по способу Гинса;
- выявление зерен волютина (внутриплазматические гранулы, состоящие из неорганических полифосфатов), их присутствие указывает на наличие возбудителя дифтерии.

Определение нуклеотидных последовательностей (секвенирование)
Определение нуклеотидных последовательностей (секвенирование) – метод, позволяющий проводить сопоставительный анализ последовательностей в различных молекулах РНК и ДНК. Секвенирование всего генома бактерии – трудоемкая и дорогостоящая процедура. В этой связи чаще всего анализируются нуклетотидные последовательности рибосомных РНК– 16S-рРНК.
Установлено, что 16S-рРНК универсально распространена, функционально постоянна и достаточно консервативна. Чем больше различий в последовательности нуклеотидов данной РНК двух бактерий, тем раньше началось расхождение между ними и тем дальше отстоят они друг от друга в филогенетических отношениях.
41.4. Селекция микроорганизмов. Биотехнология
Научная основа этой промышленности — умение создавать микроорганизмы с новыми, заранее определенными генетическими свойствами и умение использовать их в промышленных масштабах.
Селекция микроорганизмов (в отличие от селекции растений и животных) имеет ряд особенностей:
- у селекционера имеется неограниченное количество материала для работы — за считанные дни в чашках Петри или пробирках на питательных средах можно вырастить миллиарды клеток;
- более эффективное использование мутационного процесса, поскольку геном микроорганизмов гаплоидный, что дозволяет выявить любые мутации уже в первом поколении;
- организация генома бактерий более проста: меньше генов в геноме, менее сложна и генетическая регуляция взаимодействия генов.
Эти особенности накладывают свой отпечаток на методы селекции микроорганизмов, которые во многом существенно отличаются от методов селекции растений и животных.
Например, в селекции микроорганизмов обычно используются их естественные способности синтезировать какие-либо полезные для человека соединения (аминокислоты, витамины, ферменты и др.). В случае использования методов генной инженерии можно заставить бактерии и другие микроорганизмы продуцировать те соединения, синтез которых в естественных природных условиях им никогда не был присущ (например, гормоны человека и животных, биологически активные соединения).
Природные микроорганизмы, как правило, обладают низкой продуктивностью тех веществ, которые интересуют селекционера.
Для использования в микробиологической промышленности нужны высокопродуктивные штаммы, которые создают различными методами селекции, в том числе отбором среди, природных микроорганизмов.
Отбору высокопродуктивных штаммов предшествует целенаправленная работа селекционера с генетическим материалом исходных микроорганизмов.
В частности, широко используют различные способы рекомбинирования генов: конъюгацию, трансдукцию, трансформацию и другие генетические процессы. Например, конъюгация (обмен генетическим материалом между бактериями) позволила создать штамм, способный утилизировать углеводороды нефти.
Часто прибегают к трансдукции (перенос гена из одной бактерии в другую посредством бактериофагов), трансформации (перенос ДНК, изолированной из одних клеток, в другие) и амплификации (увеличение числа копий нужного гена).
Так, у многих микроорганизмов гены биосинтеза антибиотиков или их регуляторы находятся в плазмиде, а не в основной хромосоме.
Поэтому увеличение путем амплификации числа этих плазмид позволяет существенно повысить производство антибиотиков.
Важнейшим этапом в селекционной работе является индуцирование мутаций. Экспериментальное получение мутаций открывает почти неограниченные перспективы для создания исходного материала в селекции. Вероятность (частота) возникновения мутаций у микроорганизмов (10-10 — 10-6) ниже, чем у всех других организмов (10-6 — 10-4).
Но вероятность выделения мутаций по данному гену у бактерий значительно выше, чем у растений и животных, поскольку получить многомиллионное потомство у микроорганизмов довольно просто и быстро.
Для выделения мутаций служат селективные среды, на которых способны расти мутанты, но погибают исходные родительские особи дикого типа.
Проводится так же отбор по окраске и форме колоний, скорости роста мутантов и диких форм и т. д.
Отбор по продуктивности (например, продуцентов антибиотиков) осуществляется по степени антагонизма и угнетения роста чувствительного штамма. Для этого штамм-продуцент высевается на «газон» чувствительной культуры. По размеру пятна, где отсутствует рост чувствительного штамма вокруг колонии штамма-продуцента, судят о степени активности (в данном случае антибиотической).
Для размножения, естественно, отбираются наиболее продуктивные колонии. В результате селекции производительность продуцентов удается увеличить в сотни-тысячи раз. Например, комбинируя мутагенез и отбор в работе с грибом Penicillium, выход антибиотика пенициллина увеличили примерно в 10 тыс. раз по сравнению с исходным диким штаммом.
Роль микроорганизмов в микробиологической, пищевой промышленности, в сельском хозяйстве и других областях трудно переоценить
Особенно важно отметить то, что многие микроорганизмы для производства ценных продуктов используют отходы промышленного производства, нефтепродукты и тем самым производят их разрушение, предохраняя от загрязнения окружающую среду
Реферат
Лекция № 3 Совершенствование биологических объектов методами мутагенеза и селекции
Например, путем комбинирования мутагенеза и отбора в работе с грибом Penicillium был увеличен выход антибиотика пенициллина примерно в 10 тыс. раз по сравнению с исходным диким штаммом.
Важным подходом в селекционной работе с микроорганизмами является получение рекомбинантов путем слияния протопластов, или гибридизации, разных штаммов бактерий.
Слияние протопластов позволяет объединить генетические материалы и таких микроорганизмов, которые в естественных условиях не скрещиваются.
К микроорганизмам относятся прежде всего прокариоты (бактерии, актиномицеты, микоплазмы и др.) и одноклеточные эукариоты — простейшие, дрожжи и др.
Из более 100 тыс. видов, известных в природе микроорганизмов, в хозяйственной деятельности человека используется уже несколько сотен, и число это растет. Качественный скачок в их использовании произошел в последние 20—30 лет, когда были установлены многие генетические механизмы регуляции биохимических процессов, происходящих в клетках микроорганизмов.
Микроорганизмы играют исключительно важную роль в биосфере и в жизни человека.
Многие из них продуцируют десятки видов органических веществ — аминокислот, белков, антибиотиков, витаминов, липидов, нуклеиновых кислот, ферментов, пигментов, сахаров и т, п., широко используемых в разных областях промышленности и медицины.
Такие отрасли пищевой промышленности, как хлебопечение, производство спирта, некоторых органических кислот, виноделие и многие другие, основаны на деятельности микроорганизмов.
Микробиологическая промышленность предъявляет к продуцентам различных соединений жесткие требования, которые важны для технологии производства: ускоренный рост, использование для жизнедеятельности дешевых субстратов и устойчивость к заражению микроорганизмами.
Типы гибридизационных зондов
Гибридизационный зонд бывает двух типов, например;
-
-
- ДНК-зонд
- РНК-зонд
-
1. ДНК-зонд
-
- ДНК-зонд представляет собой фрагмент ДНК, который имеет нуклеотидную последовательность, специфичную для интересующего гена или хромосомной области. ДНК-зонды используют гибридизацию нуклеиновых кислот со специально помеченными последовательностями для быстрого обнаружения комплементарных последовательностей в тестируемом образце.
- Зонды гибридизации ДНК в основном используются для обнаружения комплементарной ДНК в исследуемом образце.
- Размер зонда для гибридизации ДНК варьируется от 100 до 10000 пар оснований.
- ДНК-зонды могут быть получены с использованием химического метода или метода амплификации или с использованием библиотеки кДНК.
Пример ДНК-зонда:
A. Зонд TaqMan:
-
- Зонд TaqMan впервые обнаружен Кэри Маллис.
- TaqMan представляет собой тип зонда для гидролиза, который используется в ПЦР в реальном времени.
- На 5′-конце этого зонда содержится флуорофор, а на 3′-конце — тушитель. молекула что является близостью флуорофора.
- Зонды TaqMan используются для количественного определения ДНК или генов и исследований экспрессии генов.
Механизм зонда Taqman:
-
-
- Как только зонд Taqman связывается со своей комплементарной последовательностью, ДНК-полимераза фермент начнет синтезировать новую цепь, но в то же время он удалит зонд за счет экзонуклеазной активности от 3 ‘до 5’.
- После этого зонд не гасится, а флуорофоры отрываются от молекулы гасителя и испускают флуоресценцию.
- Затем зонд TaqMan гидролизуется и начинает излучать флуоресценцию, которую измеряет детектор.
-
B. Молекулярный маяк:
-
- Молекулярный маяк — это тип шпилечного зонда, который используется в количественном анализе.
- Молекулярные маяки содержат два комплементарных конца, которые присоединены друг к другу с помощью флуорофора на одном конце и молекулы гасителя на другом конце.
- Краситель-гаситель находится близко к флуоресцентной молекуле. Вот почему флуорофор не может излучать флуоресценцию.
2. РНК-зонд
-
- РНК-зонды представляют собой участки одноцепочечной РНК, используемые для обнаружения наличия комплементарных последовательностей нуклеиновых кислот (последовательностей-мишеней) путем гибридизации.
- РНК-зонды обычно метят, например, радиоизотопами, эпитопами, биотином или флуорофорами, чтобы обеспечить их обнаружение.
- Эти зонды синтезируются путем транскрипции in vitro и могут быть заменены ДНК-зондами почти во всех приложениях.
- РНК-зонды, также известные как рибозонды или кРНК-зонды.
- РНК-зонды используются для обнаружения мРНК в тестируемом образце.
- После того, как РНК-зонды будут сконструированы для нозерн-блот-гибридизации, они будут использованы для гибридизации на нитроцеллюлозной бумаге.
- Затем сигнал гибридизации на нитроцеллюлозной бумаге с иммобилизованной одноцепочечной нуклеиновой кислотой-мишенью можно обнаружить с помощью авторадиографии.
РИСУНОК: Связывание молекулярного маяка с комплементарной последовательностью и не комплементарной последовательностью. | Источник изображения: geneticeducation.co.in
Общие положения
К общим положениям при изучении методов исследования микробов можно отнести порядок выбора того инструмента, которым будут производиться лабораторные анализы бактериальной клетки, и последовательность интерпретации тех выводов, на основании которых будут фиксироваться окончательные заключения по изучаемому микроорганизму.
Выбор метода изучения в первую очередь зависит от предмета исследований:
- Если планируется изучить строение и морфологию клетки, ее ультраструктуру (составные структуры и компоненты) и установить наличие подвижности, используется два вида микроскопии: микроскопия бактериальных клеток в живом состоянии и в окрашенном виде.
- Изучение метаболизма и ферментативной активности микроорганизмов производится путем посева выращенных колоний на дифференциально-диагностические питательные среды.
- Определение чувствительности к антибиотикам производится методом диффузии в агар.
- Изучение генетики микроорганизмов (их наследственности и изменчивости) осуществляется путем проведения перераспределительного теста, методом реплик и ряда других специализированных исследований.
Каждый из указанных методов имеет свои вариации исполнения, которые зависят от особенностей условия проведения анализа и от изучаемого материала.

Кроме того, есть масса узкоспециальных микробиологических экспериментов, которые позволяют определить те или иные особенности структуры или свойств бактериальной клетки.
5 Данные и отчет
5.1 Данные
5.1.1 Обработка результатов
Данные должны быть представлены как число колоний ревертантов на чашку. Должно быть приведено число колоний ревертантов на чашку как в вариантах с отрицательным (контроль с растворителем и, если используется, необработанный контроль), так и с положительным контролем.
Число колоний ревертантов на каждую чашку, среднее число колоний на чашку и стандартное отклонение приводится для каждой дозы исследуемого вещества, положительного и отрицательного (необработанного и/или с растворителем) контролей.
Не требуется проверка четкого положительного результата. Сомнительные результаты следует уточнить в дальнейших исследованиях, используя модификацию условий тестирования. Отрицательные результаты нуждаются в подтверждении в каждом конкретном случае. Если подтверждение отрицательного результата не требуется, должно быть предусмотрено научное обоснование.
Модификация параметров исследования, направленная на расширение предела условий, должна проводиться в последующих экспериментах. Параметры исследования, которые могут быть модифицированы, включают: интервал концентраций, метод обработки (введение вещества на чашку или преинкубация в жидкости) и условия метаболической активации.
5.1.2 Оценка и интерпретация результатов
Существуют различные критерии для определения положительного результата, такие как зависимое от концентрации увеличение эффекта в исследуемом диапазоне концентраций и/или воспроизводимое увеличение числа колоний ревертантов на чашку при одной или более концентрациях, как минимум, на одном штамме с системой метаболической активации или без нее. Биологическая значимость результатов должна быть рассмотрена в первую очередь. Статистические методы могут использоваться при оценке результатов испытания. Однако статистическая значимость не должна быть единственным определяющим фактором для заключения о положительном эффекте.
Испытуемое вещество, результаты исследования которого не соответствуют вышеупомянутым критериям, рассматриваются как не мутагенные в данном тесте.
Хотя в большинстве экспериментов получаются четкие положительные или отрицательные результаты, в редких случаях, совокупность данных будет исключать определенную оценку об активности испытуемого вещества. Результаты могут оставаться сомнительными или проблематичными независимо от числа повторов эксперимента.
Положительные результаты в тесте оценки обратных мутаций на бактериях свидетельствуют о том, что вещество индуцирует точковые мутации типа замены пар оснований или сдвига рамки считывания в геноме Salmonella typhimurium и/или Escherichia coli. Отрицательные результаты показывают, что в условиях опыта испытуемое вещество является не мутагенным для тестируемых видов.
5.2 Отчет
5.2.1 Информация об испытании, которую должен включать отчет Исследуемое соединение:
— идентификационные данные и CAS no (если известны);
— физическая природа и чистота;
— физико-химические свойства, относящиеся к проведению исследования;
— стабильность соединения (если известна).
Растворитель/среда:
— обоснование выбора растворителя/среды;
— растворимость и стабильность испытуемого вещества в растворителе/среде (если известно).
Штаммы:
— используемые штаммы;
— число клеток на культуру;
— характеристики штаммов.
Условия испытания:
— количество испытуемого вещества на чашку (мг/чашка или мкг/чашка) с обоснованием выбора дозы и числа чашек на концентрацию;
— используемая среда;
— тип и состав системы метаболической активации, включающей критерий приемлемости;
— процедуры обработки.
Результаты:
— признаки токсичности;
— признаки преципитации;
— количество колоний ревертантов на каждую чашку;
— среднее число колоний ревертантов на чашку и стандартное отклонение;
— зависимость эффекта от дозы, где возможно;
— статистическая обработка, если есть;
— данные по отрицательным (растворитель/среда) и положительным контролям, с пределами колебаний, средними и стандартными отклонениями;
— данные по ранее полученным (лабораторным) отрицательным (растворитель/среда) и положительным контролям: диапазоны колебаний, средние и стандартные отклонения.
5.2.2 Обсуждение результатов
5.2.3 Заключение
Реферат Селекция микроорганизмов.
Работа добавлена на сайт bukvasha.ru: 2015-10-28
Селекция микроорганизмов.Согласно общепринятому определению, Генетика) микроорганизмов, раздел общей генетики, в котором объектом исследования служат бактерии, микроскопические грибы, актинофаги, вирусы животных и растений, бактериофаги и др.
микроорганизмы. До 40-х гг. 20 в. считалось, что, поскольку у микроорганизмов нет ядерного аппарата и мейоза, на них не распространяются Менделя законы и хромосомная теория наследственности.
С начала 40-х гг. микроорганизмы становятся объектом интенсивных генетических исследований. Именно на них были решены многие кардинальные вопросы современные генетики.
Так, первое указание на то, что материальным носителем наследственности служит дезоксирибонуклеиновая кислота (ДНК (было получено в опытах на пневмококках (американские генетики О. Т. Эйвери, К.
Мак-Леод и М. Маккарти). Примерно в то же время были начаты интенсивные генетические исследования на хлебной плесени — нейроспоре. Изучение многочисленных биохимических мутантов нейроспоры (Дж. У. Бидл и Э. Л
Тейтем США привело к установлению очень важного положения: «один ген — один фермент» (ныне это положение более точно формулируется так: «один ген — одна полипептидная цепь»). Генетические (исследования микроорганизмов особенно интенсивно стали развиваться после того, как американские генетики С
Лурия М. Дельбрюк показали на кишечной палочке (Escherichia coli), что и бактерии подчиняются мутационным закономерностям (см. Изменчивость Мутации Ранее существовавшее представление об адекватной, адаптивной изменчивости у бактерий возникло вследствие методической ошибки, заключавшейся в изучении культуры как единицы изменчивости.
Был предложен новый принцип изучения изменчивости у бактерий — клональный анализ, т. е. изучение потомства одной клетки — родоначальницы клона
Важной вехой в развитии Г. м
явился разработанный американскими генетиками Дж. и Э. Ледербергами метод реплик, или отпечатков, позволивший доказать, что мутации возникают у бактерий независимо от условий культивирования, и, кроме того, значительно упростивший приёмы отбора вариантов микроорганизмов с желаемыми свойствами. Оказалось, что в больших популяциях бактериальных клеток мутации возникают спонтанно.
В 1946 был открыт половой процесс у бактерий (конъюгация), что позволило применить для их исследования генетический анализ.
Исследование чувствительности к антибиотикам

Исследование чувствительности микроорганизмов к антибиотикам осуществляется по принципу деления бактерий на чувствительных и устойчивых к воздействию антибиотиков.
Изучение этого свойства особенно важно для практической медицины, где постоянно необходимо исследовать инфицированный материал и подбирать антибиотики для лечения
- Для начала при помощи исследований патогенного материала определяют, какой микроб ведущий в очаге заражения (определение ведется, в том числе, и методом количественного подсчета).
- Если установлен ведущий микроорганизм, то его чувствительность определяется путем диффузии в агар с применением бумажных дисков. Специально разработанные и выпускаемые бумажные диски заранее обработаны антибиотиками в нужной концентрации. Чувствительность к определенному антибиотику на бумажном диске определяется по замедленному росту колонии на соответствующих зонах диска и по разному окрашиванию дисков.
Кроме метода с использованием бумажных дисков, также для определения чувствительности бактерий к антибиотикам применяется способ стерильных разведений. Бульонные культуры микробов вносят в разведенные растворы антибиотиков. В процессе изучения микробов на чувствительность к антибиотикам пробирки инкубируют и выдерживают определенное количество времени.
Результаты исследования изучают по таблице чувствительности, где указаны исходные и конечные данные концентрации антибиотиков и биологического материала.






























