Способы производства
Существует два основных метода получения чистого O2:
- Из воздуха: на начальном этапе воздух очищается от мелких примесей и влаги посредством многоступенчатого компрессора и воздушных фильтров. Следующим этапом является сжижение и последующее разделение O2 и N2 (жидкий азот закипает при -196°C, поэтому при медленном увеличении температуры он испаряется раньше).
- Из воды: через дистиллированную воду пропускают ток (реакция электролиза), в результате чего происходит разделение: 2H2O → 2H2 + O2. Учитывая то, что абсолютно чистая вода – это диэлектрик, перед подачей тока в нее добавляют электролиты (KOH, NaOH).
«Воздушный» метод считается наиболее выгодным. Чтобы получить кислород технический в объеме 1 м³ данным способом, расходуется порядка 0,5-1,5 кВт/ч электричества. Тогда как для электролиза требуется 10-20 кВт/ч.
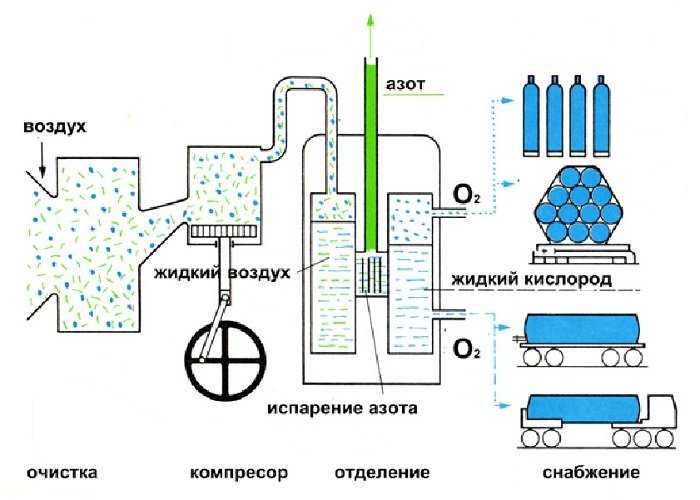
На рисунке изображен «воздушный» способ получения
Финансовые расчеты
Стартовый капитал
Расходы, связанные с запуском цеха по производству кислорода, представлены в таблице
| Вид расходов | Сумма, рублей |
| Оформление документов | 5 000 |
| Строительство, обустройство цеха | 400 000 |
| Оборудование | 860 000 |
| 15 000 | |
| Итого | 1 275 000 |
Ежемесячные расходы
| Вид расходов | Сумма, рублей |
| Заработная плата персонала | 60 000 |
| Налоги | 10 000 |
| Коммунальные платежи | 15 000 |
| Тара под готовый кислород | 50 000 |
| Итого | 135 000 |
Сколько можно заработать?
Чистая прибыль будет зависеть от того, какой способ производства кислорода применялся. Например, если изготавливался продукт из баллонного воздуха, то рентабельность составит около 100%, а если основным компонентом был атмосферный воздух, то 150%. Уже на втором месяце работы предприятие выйдет на стабильную чистую прибыль в размере 150 000 рублей.
Адсорбционные воздухоразделительные установки
Для потребителей газообразного азота и кислорода выпускаются адсорбционные воздухоразделительные установки. Их работа основана на селективном поглощении компонентов воздуха молекулярными адсорбентами по технологии Короткоцикловой безнагревной адсорбции (КБА) или в английском варианте Pressure Swing Adsorption (PSA).
При прохождении сжатого воздуха через один из двух попеременно работающих адсорберов происходит преимущественное поглощение азота или кислорода (одновременно с водяными парами, двуокисью углерода и углеводородными соединениями) из воздуха, а оставшийся газ направляется потребителю. Регенерация адсорбента осуществляется при сбросе давления в адсорбере и его продувке. Рабочий процесс на осуществляется при положительной температуре в полностью автоматическом режиме.
К числу факторов, обеспечивающих конкурентоспособность установок КБА (PSA), относится их сравнительная дешевизна, простота монтажа, эксплуатации и технического обслуживания. Кроме того, установки этого типа отличает компактность оборудования, высокая степень безопасности, надежности, автоматизации технологического процесса (включая пуск и остановку), короткий период пуска и практически неограниченная продолжительность рабочей кампании.
Адсорбционный метод разделения воздуха в достаточно большом диапазоне производительности и концентрации отличается большей экономичностью по сравнению с криогенным методом, что связано с меньшим давлением в цикле. Однако этот метод не позволяет получать чистый технический кислород и сжиженные газы.
Промышленные способы получения кислорода: методы и технологии
Лииндовский метод – это наиболее распространенный способ получения кислорода в промышленности. Он основан на разделении сжатого воздуха на кислород и азот с помощью физического явления низкотемпературного ректификации. Воздух сначала сжимается до давления около 200 атмосфер, затем охлаждается до температуры около -180°C, и азот и кислород разделяются с помощью цикла ректификации. Кислород собирается в жидком состоянии, а затем испаряется для получения газообразного кислорода.
Электролиз – это процесс получения кислорода путем разложения воды на составные элементы с помощью электрического тока. В электролизере вода разлагается на водород и кислород под действием постоянного электрического тока. Кислород отделяется от воды и собирается в газообразном состоянии. Этот метод требует электрической энергии, поэтому его эффективность зависит от стоимости электричества.
Адсорбция – это метод получения кислорода с использованием специальных материалов, способных адсорбировать кислород из воздуха. Специальные адсорбенты используются для поглощения молекул кислорода, позволяя разделить их от других компонентов воздуха. Затем кислород отделяется от адсорбента с помощью изменения условий, таких как изменение давления или температуры.
Геттерный метод – это метод получения кислорода с использованием геттеров, которые являются веществами со способностью активно взаимодействовать с кислородом. Геттеры обладают высокой поглощающей способностью для кислорода и позволяют его отделять от других компонентов. После насыщения геттера кислород отделяется с помощью повышения температуры или изменения физических условий.
Фотохимический метод – это метод получения кислорода с использованием фотохимической реакции. При этом световая энергия используется для разложения молекул воздуха, что приводит к отделению кислорода. Этот метод требует специального оборудования и не является наиболее распространенным в промышленности.
Промышленные способы получения кислорода предоставляют надежный и эффективный способ обеспечения этого газа для различных промышленных процессов. Каждый метод имеет свои преимущества и ограничения, и выбор метода зависит от конкретного применения и требований производства.
Химические свойства[]
Сильный окислитель, взаимодействует практически со всеми элементами, образуя оксиды. Степень окисления −2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры (см. Горение). Пример реакций, протекающих при комнатной температуре:
- 4Li+O2→2Li2O{\displaystyle ~{\mathsf {4Li+O_{2}\rightarrow 2Li_{2}O}}}
- 2Sr+O2→2SrO{\displaystyle ~{\mathsf {2Sr+O_{2}\rightarrow 2SrO}}}
Окисляет соединения, которые содержат элементы с не максимальной степенью окисления:
- 2NO+O2→2NO2↑{\displaystyle ~{\mathsf {2NO+O_{2}\rightarrow 2NO_{2}\uparrow }}}
Окисляет большинство органических соединений:
- CH3CH2OH+3O2→2CO2+3H2O{\displaystyle ~{\mathsf {CH_{3}CH_{2}OH+3O_{2}\rightarrow 2CO_{2}+3H_{2}O}}}
При определённых условиях можно провести мягкое окисление органического соединения:
- CH3CH2OH+O2→CH3COOH+H2O{\displaystyle ~{\mathsf {CH_{3}CH_{2}OH+O_{2}\rightarrow CH_{3}COOH+H_{2}O}}}
Кислород реагирует непосредственно (при нормальных условиях, при нагревании и/или в присутствии катализаторов) со всеми простыми веществами, кроме Au и инертных газов (He, Ne, Ar, Kr, Xe, Rn); реакции с галогенами происходят под воздействием электрического разряда или ультрафиолета. Косвенным путём получены оксиды золота и тяжёлых инертных газов (Xe, Rn). Во всех двухэлементных соединениях кислорода с другими элементами кислород играет роль окислителя, кроме соединений со фтором (см. ниже ).
Кислород образует пероксиды со степенью окисления атома кислорода, формально равной −1.
Например, пероксиды получаются при сгорании щелочных металлов в кислороде:
- 2Na+O2→Na2O2{\displaystyle ~{\mathsf {2Na+O_{2}\rightarrow Na_{2}O_{2}}}}
Некоторые оксиды поглощают кислород:
- 2BaO+O2→2BaO2{\displaystyle ~{\mathsf {2BaO+O_{2}\rightarrow 2BaO_{2}}}}
По теории горения, разработанной А. Н. Бахом и К. О. Энглером, окисление происходит в две стадии с образованием промежуточного пероксидного соединения. Это промежуточное соединение можно выделить, например, при охлаждении пламени горящего водорода льдом, наряду с водой, образуется пероксид водорода:
- H2+O2→H2O2{\displaystyle ~{\mathsf {H_{2}+O_{2}\rightarrow H_{2}O_{2}}}}
В надпероксидах кислород формально имеет степень окисления −½, то есть один электрон на два атома кислорода (ион O−2). Получают взаимодействием пероксидов с кислородом при повышенных давлении и температуре:
- Na2O2+O2→2NaO2{\displaystyle ~{\mathsf {Na_{2}O_{2}+O_{2}\rightarrow 2NaO_{2}}}}
Калий K, рубидий Rb и цезий Cs реагируют с кислородом с образованием надпероксидов:
- K+O2→KO2{\displaystyle ~{\mathsf {K+O_{2}\rightarrow KO_{2}}}}
Озониды содержат ион O−3 со степенью окисления кислорода, формально равной −1/3. Получают действием озона на гидроксиды щелочных металлов:
- KOH+O3→KO3+H2O+O2↑{\displaystyle ~{\mathsf {KOH+O_{3}\rightarrow KO_{3}+H_{2}O+O_{2}\uparrow }}}
В ионе диоксигенила O2+ кислород имеет формально степень окисления +½. Получают по реакции:
- PtF6+O2→O2PtF6{\displaystyle ~{\mathsf {PtF_{6}+O_{2}\rightarrow O_{2}PtF_{6}}}}
Фториды кислорода
Дифторид кислорода, OF2 степень окисления кислорода +2, получают пропусканием фтора через раствор щелочи:
- 2F2+2NaOH→2NaF+H2O+OF2↑{\displaystyle ~{\mathsf {2F_{2}+2NaOH\rightarrow 2NaF+H_{2}O+OF_{2}\uparrow }}}
Монофторид кислорода (Диоксидифторид), O2F2, нестабилен, степень окисления кислорода +1. Получают из смеси фтора с кислородом в тлеющем разряде при температуре −196 °C:
- F2+O2→O2F2{\displaystyle ~{\mathsf {F_{2}+O_{2}\rightarrow O_{2}F_{2}}}}
Пропуская тлеющий разряд через смесь фтора с кислородом при определённых давлении и температуре, получают смеси высших фторидов кислорода O3F2, О4F2, О5F2 и О6F2.
Квантовомеханические расчёты предсказывают устойчивое существование иона трифторгидроксония (англ.) OF3+. Если этот ион действительно существует, то степень окисления кислорода в нём будет равна +4.
Кислород поддерживает процессы дыхания, горения, гниения.
В свободном виде элемент существует в двух аллотропных модификациях: O2 и O3 (озон). Как установили в 1899 году Пьер Кюри и Мария Склодовская-Кюри, под воздействием ионизирующего излучения O2 переходит в O3.
Принцип работы мембранного картриджа
Инновационные газоразделительные мембраны, в отличие от старых аналогов, представляют собой уже не плоскую пластинку или пленку, а полое волокно. Для мембранного метода разделения газов применяют поволоконные мембраны, состоящие из пористого полимерного волокна с нанесением на внешнюю поверхность газоразделительного слоя. Визуально поволоконная мембрана изготавливается в виде картриджа цилиндрической формы, представляющего собой катушку, обмотанную специальным образом полимерным волокном. Само пористое волокно обладает сложной ассиметричной структурой и более высокой плотностью по мере сокращения расстояния до внешней поверхности волокна.
Использование пористых подложек с ассиметричной структурой обеспечивает разделения газов при высоком уровне давления, вплоть до 6,5МПа, с учетом того, что толщина газоразделительного слоя мембраны не превышает 0,1мкм, и тем самым обеспечивает высокий уровень проницаемости газов через полимерную мембрану. Существующий в современных реалиях уровень развития технологий обеспечивает изготовление полимерных материалов, обладающих высоким уровнем селективности во время осуществления разделения различных газов, тем самым обеспечивая высокий уровень чистоты газообразных продуктов.
Оборудование для производства кислорода включает в себя:
- Специальный инновационный мембранный модуль;
- Корпус каркасного типа;
- Сменный мембранный картридж.
Следует отметить, что плотность укладки волокон в картридже составляет от 500 до 700м2 полимерного волокна на 1м3 картриджа, тем самым обеспечивая максимальную минимизацию габаритов инновационных кислородных установок.
Применение кислородных установок
Сегодня кислородные установки пользуются самым широким применением во множестве технологических процессов, практически во всех существующих отраслях современной промышленности, а также в медицине и в агросельскохозяйственном комплексе. Наиболее полезными в медицине и промышленности считаются его окислительные свойства, а также его способность поддерживать процесс горения в течение долгого времени. Тут следует вспомнить результаты исследований палеонтологов, которые обнаружили, что во времена Каменноугольного периода (Карбон) воздух содержал не 21% кислорода, а 81%!
Воздух мог взорваться на ровном месте, а от удара молнии выгорали площади, равные территории современной Канады! Наибольшим спросом кислородные установки пользуются в процессах металлообработки, и в частности – резки, сварки и пайки металла. В химической, нефтехимической и нефтегазовой отрасли кислород в больших объемах применяется в качестве окислителя необходимого для выполнения химических реакций.
Получение кислорода и азота из воздуха
Огромные запасы кислорода в атмосфере позволяют получать и использовать его в различных производствах. В промышленных условиях кислород, азот и некоторые другие газы (аргон, неон) получают из воздуха.
Для этого воздух сначала превращают в жидкость (рис. 79) путем охлаждения до такой низкой температуры, при которой все его компоненты переходят в жидкое агрегатное состояние.

Затем эту жидкость медленно нагревают, в результате чего при разных температурах происходит последовательное выкипание (т. е. переход в газообразное состояние) веществ, которые содержатся в воздухе. Собирая выкипающие при разных температурах газы, по отдельности получают азот, кислород и другие вещества.
Краткие выводы урока:
- В лабораторных условиях кислород получают разложением некоторых сложных веществ, в состав которых входят атомы кислорода.
- Катализатор — вещество, которое ускоряет протекание химической реакции, но само при этом не расходуется.
- Источником кислорода на нашей планете являются зеленые растения, в которых протекает процесс фотосинтеза.
- В промышленности кислород получают из воздуха.
Надеюсь урок 17 «Получение кислорода» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Кислород: история открытия
Все эти элементы, а также ряд других, способствовали развитию эволюции жизни на нашей планете в том виде, в котором мы сейчас наблюдаем. Среди всех компонентов именно кислорода в природе больше остальных элементов.
Кислород как отдельный элемент был открыт 1 августа 1774 года В ходе эксперимента по получению воздуха из окалины ртути путём нагревания при помощи обычной линзы он обнаружил, что свеча горит необычно ярким пламенем.
Долгое время Пристли пытался найти этому разумное объяснение. На тот момент этому явлению было дано название «второй воздух». Несколько ранее изобретатель подводной лодки К. Дреббель в начале XVII века выделил кислород и использовал его для дыхания в своём изобретении. Но его опыты не оказали влияния на понимание того, какую роль играет кислород в природе энергообмена живых организмов. Однако учёным, официально открывшим кислород, признан французский химик Антуан Лоран Лавуазье. Он повторил эксперимент Пристли и понял, что образующийся газ является отдельным элементом.
Кислород взаимодействует практически со всеми простыми и кроме инертных газов и благородных металлов.
Применение кислорода
Помимо того, что все живые существам в природе, за исключением немногих микроорганизмов, при дыхании потребляют кислород, он широко применяется во многих отраслях промышленности: металлургической, химической, машиностроении, авиации, ракетостроении и даже в медицине.
В химической промышленности его применяет:
- при получении ацетилена из природного газа (метана);
- при производстве кислот (азотной, серной);
- для газификации твердого топлива;
- для производства аммиака, формальдегида и метанола.
В металлургии его используют:
- при получении цветных металлов из руд;
- при выплавке чугуна в доменных печах;
- при выплавке стали в мартеновских и электрических печах;
- кислородно-конверторной выплавке стали.
В медицинских целях больным, у которых нарушена нормальная деятельность органов дыхания или кровообращения, искусственно увеличивают содержание O2 в воздухе или дают дышать непродолжительное время чистым O2. Медицинский кислород, выпускаемый ГОСТ 5583, особенно тщательно очищают от всех примесей.
Применение кислорода в сварке
Сам по себе O2 является негорючим газом, но из-за свойства активно поддерживать горение и увеличения интенсивности (интенсификации) горения газов и жидкого топлива его используют в ракетных энергетических установках и во всех процессах газопламенной обработки. В таких процессах газопламенной обработки, как газовая сварка, поверхностная закалка высокая температура пламени достигается путем сжигания горючих газов в O2, а при газовой резке благодаря ему происходит окисление и сгорание разрезаемого металла.
При полуавтоматической сварке (MIG/MAG) кислород O2 используют как компонент защитных газовых смесей с аргоном (Ar) или углекислым газом (CO2).
Кислород добавляют в аргон при полуавтоматической сварке легированных сталей для обеспечения устойчивости горения дуги и струйного переноса расплавленного металла в сварочную ванну. Дело в том, что как поверхностно активный элемент он уменьшает поверхностное натяжение жидкого металла, способствуя образованию на конце электрода более мелких капель.
При сварке низколегированных и низкоуглеродистых сталей полуавтоматом O2 добавляют в углекислый газ для обеспечения глубокого проплавления и хорошего формирования сварного шва, а также для уменьшения разбрызгивания.
Чаще всего кислород используют в газообразном виде, а в виде жидкости используют только при его хранении и транспортировке от завода-изготовителя до потребителей.
Кислород в природе
Огромное количество газообразного кислорода содержится в атмосфере, растворено в водах морей и океанов. Кислород необходим всем живым организмам для дыхания. Без кислорода невозможно было бы получать энергию за счет сжигания различных видов топлива. На эти нужды ежегодно расходуется примерно 2% атмосферного кислорода.
Откуда берется кислород на Земле и почему его количество остается примерно постоянным, несмотря на такой расход? Единственным источником кислорода на нашей планете являются зеленые растения, производящие его под действием солнечного света в процессе фотосинтеза. Это очень сложный процесс, включающий много стадий. В результате фотосинтеза в зеленых частях растений углекислый газ и вода превращаются в глюкозу C6H12O6 и кислород. Суммарное уравнение реакций, протекающих в процессе фотосинтеза, можно представить следующим образом:
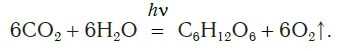
Установлено, что примерно одну десятую часть (11%) производимого зелеными растениями кислорода дают наземные растения, а остальные девять десятых (89%) — водные растения.
Урок 17. Получение кислорода – HIMI4KA
Архив уроков › Химия 8 класс
В уроке 17 «Получение кислорода» из курса «Химия для чайников» выясним, как получают кислород в лабораторных условиях; узнаем, что такое катализатор, и как растения влияют на производство кислорода на нашей планете.
Наиболее важным для человека и других живых организмов веществом, входящим в состав воздуха, является кислород
Большие количества кислорода используются в промышленности, поэтому важно знать, как можно его получать
Получение кислорода в лабораторных условиях
В химической лаборатории кислород можно получать нагреванием некоторых сложных веществ, в состав которых входят атомы кислорода. К числу таких веществ относится вещество KMnO4, которое имеется в вашей домашней аптечке под названием «марганцовка».
Вы знакомы с простейшими приборами для получения газов. Если в один из таких приборов поместить немного порошка KMnO4 и нагреть, то будет выделяться кислород (рис. 76):
Кислород можно также получить разложением пероксида водорода H2O2. Для этого в пробирку с H2O2 следует добавить очень небольшое количество особого вещества — катализатора — и закрыть пробирку пробкой с газоотводной трубкой (рис. 77).
Для данной реакции катализатором является вещество, формула которого MnO2. При этом протекает следующая химическая реакция:
Обратите внимание на то, что ни в левой, ни в правой частях уравнения формулы катализатора нет. Его формулу принято записывать в уравнении реакции над знаком равенства
Для чего же добавляется катализатор? Процесс разложения H2O2 при комнатных условиях протекает очень медленно. Поэтому для получения заметных количеств кислорода необходимо много времени.
Однако эту реакцию можно резко ускорить путем прибавления катализатора.
Катализатор — это вещество, которое ускоряет химическую реакцию, но само в ней не расходуется.
Именно потому, что катализатор не расходуется в реакции, мы не записываем его формулу ни в одной из частей уравнения реакции.
При этом протекает следующая химическая реакция:
Кислород в природе
Огромное количество газообразного кислорода содержится в атмосфере, растворено в водах морей и океанов. Кислород необходим всем живым организмам для дыхания. Без кислорода невозможно было бы получать энергию за счет сжигания различных видов топлива. На эти нужды ежегодно расходуется примерно 2% атмосферного кислорода.
Откуда берется кислород на Земле и почему его количество остается примерно постоянным, несмотря на такой расход? Единственным источником кислорода на нашей планете являются зеленые растения, производящие его под действием солнечного света в процессе фотосинтеза.
Это очень сложный процесс, включающий много стадий. В результате фотосинтеза в зеленых частях растений углекислый газ и вода превращаются в глюкозу C6H12O6 и кислород.
Суммарное уравнение реакций, протекающих в процессе фотосинтеза, можно представить следующим образом:
Установлено, что примерно одну десятую часть (11%) производимого зелеными растениями кислорода дают наземные растения, а остальные девять десятых (89%) — водные растения.
Получение кислорода и азота из воздуха
Огромные запасы кислорода в атмосфере позволяют получать и использовать его в различных производствах. В промышленных условиях кислород, азот и некоторые другие газы (аргон, неон) получают из воздуха.
Для этого воздух сначала превращают в жидкость (рис. 79) путем охлаждения до такой низкой температуры, при которой все его компоненты переходят в жидкое агрегатное состояние.
https://youtube.com/watch?v=bMDdeYmAD5k
Затем эту жидкость медленно нагревают, в результате чего при разных температурах происходит последовательное выкипание (т. е. переход в газообразное состояние) веществ, которые содержатся в воздухе. Собирая выкипающие при разных температурах газы, по отдельности получают азот, кислород и другие вещества.
Краткие выводы урока:
- В лабораторных условиях кислород получают разложением некоторых сложных веществ, в состав которых входят атомы кислорода.
- Катализатор — вещество, которое ускоряет протекание химической реакции, но само при этом не расходуется.
- Источником кислорода на нашей планете являются зеленые растения, в которых протекает процесс фотосинтеза.
- В промышленности кислород получают из воздуха.
Надеюсь урок 17 «Получение кислорода» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Вам также будет интересно
Редакция Без Сменки
15 июня, 2022
1 мин
Структуры данных
Рассмотрим основные структуры данных:
️Список(list)
Список в Python представляет собой…
374
Редакция Без Сменки
26 мая, 2022
1 мин
Пирамида, вписанная в конус
На плоскости в планиметрии в окружность можно вписать треугольник, четырехугольник или любой другой…
572
Редакция Без Сменки
01 июля, 2022
1 мин
Авторская позиция
Авторская позиция проявляется в:
️ точках зрения на события и героев
️чувствах и мыслях…
651
Редакция Без Сменки
22 мая, 2022
1 мин
Сравнительные конструкции с прилагательными + устойчивые выражения
Главная сравнительная конструкция в английском — это, конечно, as… as… (такой же, как…/ так…
628
Редакция Без Сменки
11 января, 2022
1 мин
Как установить Python
Мы сделали этот мини-гайд, чтобы вы с лёгкость смогли установить себе Python. Тут подробно описано,…
726
Редакция Без Сменки
15 июня, 2022
1 мин
Рекурсивные алгоритмы — кодом
Задача:
найти наименьшее значение n, при котором сумма чисел, которые будут выведены при вызове…
1730
Преимущества и недостатки различных способов получения кислорода
Одним из самых распространенных способов получения кислорода является его разделение из воздуха методом линдового криогенного разделения. Преимуществом этого метода является его относительная простота и доступность. Недостатком является высокая энергозатратность и большие инвестиционные затраты на оборудование.
Другой способ получения кислорода – электролиз воды. Этот метод позволяет производить кислород непосредственно на месте его использования. Преимуществом электролиза воды является его экологическая чистота, поскольку при этом не выделяются вредные вещества. Однако недостатком данного способа является высокая стоимость производства и необходимость подключения к электросети.
Еще одним способом получения кислорода является фотохимический способ, основанный на использовании света для промышленного разложения воды на кислород и водород. Преимуществом этого метода является его высокая эффективность и экономическая целесообразность. Недостатком является необходимость использования специального оборудования и управления фотохимическим процессом.
Каждый из этих способов получения кислорода имеет свои преимущества и недостатки, и выбор нужного метода зависит от конкретных условий и требований производства.
Получение и применение кислорода
Кислород находит достаточно широкое применение в промышленности и медицине:
- в металлургии кислород используется при выплавке стали (чугуна);
- в химической промышленности кислород нужен для производства кислот (серной и азотной), метанола, ацетилена, альдегидов;
- в космической промышленности кислород используется в качестве окислителя ракетного топлива;
- в медицине кислород применяют в дыхательных аппаратах;
- в природе кислород играет исключительно важную роль, — в процессе окисления углеводов, жиров и белков происходит высвобождение энергии, необходимой для живых организмов.
Способы получения кислорода:
-
промышленные способы:
- сжижением воздуха с последующим разделением жидкой смеси газов на компоненты;
- электролиз воды: 2H2O = 2H2 + O2.
-
лабораторные способы (разложение солей при нагревании):
- перманганат калия: 2KMnO4 = K2MnO4 + MnO2 + O2;
- бертолетова соль: 2KClO3 = 2KCl + 3O2.
- термическое разложение нитратов щелочных металлов: 2NaNO3 = 2NaNO2+O2↑
- каталитическое разложение пероксида водорода (катализатор MnO2): 2H2O2 = 2H2O+O2↑;
- взаимодействие пероксидов углекислого газа с пероксидами щелочных металлов: 2CO2+2Na2O2 = 2Na2CO3+O2↑.
Происхождение названия[]
Слово кислород (именовался в начале XIX века ещё «кислотвором») своим появлением в русском языке до какой-то степени обязано М. В. Ломоносову, который ввёл в употребление, наряду с другими неологизмами, слово «кислота»; таким образом слово «кислород», в свою очередь, явилось калькой термина «оксиген» (фр. oxygène), предложенного А. Лавуазье (от др.-греч. ὀξύς — «кислый» и γεννάω — «рождаю»), который переводится как «порождающий кислоту», что связано с первоначальным значением его — «кислота», ранее подразумевавшим вещества, именуемые по современной международной номенклатуре оксидами.
3 причины начать собственное производство кислорода или азота
Организация собственного производства газа имеет следующие преимущества:
- независимость предприятия от неприятных сюрпризов со стороны поставщика («нет в наличии», «остановилось производство», «водитель не может доехать», «повышение цен» и т д.);
- снижение затрат на азот или кислород (после приобретения станции стоимость затрат на газ будет равна сумме затрат на электроэнергию и воду, необходимых для его производства);
- доступность газа (кислородную станцию можно установить в отдаленных и труднодоступных для проезда заправочных автоцистерн районах. Это особенно актуально для многих регионов Сибири и Крайнего Севера).






























