Использование теста ингибирования гемагглютинации
- Инфекции, вызванные ортомиксовирусами (гриппа), парамиксовирусами (кори, эпидемического паротита), мононуклеозом, арбовирусами-тогавирусами (включая краснуху), флавивирусами и буньявирусами, обычно диагностируют с помощью реакции торможения гемагглютинации.
- Гемагглютинация позволяет обнаружить присутствие вируса в инфицированных культурах клеток; особенности подавления гемагглютинации позволяют определить принадлежность вируса или антител к сыворотке больного.
- Хотя вирусы гриппа можно обнаружить с помощью реакции гемадсорбции, реакция торможения гемагглютинации является наиболее эффективным методом для изотипа (РТГ).
3.Реакция непрямой гемагглютинации (рнга)
Основана на том, что эритроциты, на которых предварительно адсорбированы антигены, приобретают способность агглютинироваться в присутствии гомологичных сывороток (антител).
Эритроциты при этом выполняют роль носителей со специфическими детерминантами, агглютинация которых происходит в результате реакции антиген + антитело.
Эритроциты, к поверхности которых прочно присоединены антигены, называют эритроцитарным антигенным диагностикумом, или эритроцитами, сенсибилизированными антигеном.
Другой тип РНГА — на поверхности эритроцитов адсорбированы антитела и последующая их агглютинация происходит в присутствии гомологичного антигена. В этом случае такие эритроциты называют эритроцитарным антительным диагностикумом, или эритроцитами, сенсибилизированными антителами.
Приготовление эритроцитарных диагностикумов включает следующие этапы:
• фиксация эритроцитов формальдегидом или глютаровым, или акриловым альдегидами. Такие обработанные эритроциты длительно сохраняются. Чаще для этой цели используют эритроциты барана, человека, кур и др.;
• обработка фиксированных эритроцитов раствором танина. В результате эритроциты приобретают свойство необратимо адсорбировать на своей поверхности белки (вирусы и антитела);
• сенсибилизация танизированных эритроцитов вирусами или антителами.
Методика постановки РНГА для обнаружения и определения титра антител заключается в следующем:
• к последовательным 2-кратным разведениям сыворотки добавляют равные дозы эритроцитов, сенсибилизированных антигеном;
• смесь оставляют на 2—3 ч при комнатной температуре или на 16—18 ч при 4 °С;
• учитывают результаты. Если в сыворотке содержатся антитела к вирусу, которым были сенсибилизированы эритроциты, наблюдают гемагглютинацию, которую оценивают в крестах.
РНГА позволяет решать следующие диагностические задачи:
• обнаружить антитела и определить их титр в сыворотке крови с помощью известного эритроцитарного антигенного диагностикума;
• обнаружить и идентифицировать неизвестный вирус с помощью известного эритроцитарного антительного диагностикума.
Достоинства РНГА: высокая чувствительность, простота техники постановки и быстрота ответа
Однако важно отметить, что возникают большие трудности в приготовлении стабильных эритроцитарных диагностикумов (большая зависимость от чистоты используемых компонентов, необходимость подбора режима фиксации, танизации и сенсибилизации эритроцитов для каждого вида вируса).
Принцип Гемагглютинация Тест на ингибирование
- При сближении вирусов кори и эритроцитов происходит гемагглютинация (см. рисунок а). Однако если сыворотку человека, инфицированного вирусом кори, соединить с эритроцитами и вирусом кори, эритроциты не будут агглютинировать.
- Это явление называется торможением гемагглютинации. Поскольку гемагглютинины заняты и не могут прикреплять и агглютинировать эритроциты, это происходит из-за наличия в сыворотке инфицированного человека антител, нейтрализующих вирусы кори (положительный результат).
- Если в сыворотке пациента отсутствуют антитела к поверхностным белкам тестируемого вируса, произойдет гемагглютинация, поскольку поверхностные молекулы могут свободно гемагглютинировать эритроциты (отрицательный результат).
- Предпосылка анализа HAI заключается в том, что антитела к этому конкретному вирусу (например, вирусу кори) будут препятствовать присоединению вируса к эритроцитам. Поэтому гемагглютинация подавляется в присутствии антител.
- Если в сыворотке отсутствуют антитела, реагирующие с вирусом кори, то во всех лунках будет наблюдаться гемагглютинация.
- Точно так же, если присутствуют антитела, специфичные к вирусу кори, гемагглютинация не произойдет до тех пор, пока антитела не будут достаточно разбавлены.
- Наличие неспецифических ингибиторов вирусной гемагглютинации и встречающихся в природе агглютининов эритроцитов может осложнить тест на ИСМП. Во избежание вводящих в заблуждение положительных или отрицательных результатов сыворотки должны быть обработаны перед использованием.
Принцип реакции торможения гемагглютинации
Титр ГАИ: Максимальное разведение сыворотки (Ab), которое ингибирует гемагглютинацию, известно как титр HAI сыворотки.
Контроль качества
- Выявленная положительная сыворотка
- У сыворотки плохая репутация.
- сыворотки и неантигенных клеток (для выявления неспецифической агглютинации).
- Обратное титрование гемагглютинирующей активности антигена (для проверки того, что исследованы четыре гемагглютинирующих вируса (ГАУ)).
Реакция торможения гемагглютинации (РТГА)
В основе РГА лежит способность эритроцитов склеиваться при адсорбции на них определенных антигенов. В качестве исследуемого материала при гемагглютинации используют аллантоисную, амниотическую жидкость, суспензию хорионаллантоисных оболочек куринных эмбрионов, взвеси и экстракты из культур или органов животных, зараженных вирусами, нативный инфекционный материал. РГА не является серологической, поскольку происходит без участия иммунной сыворотки и используется для выбора рабочего разведения антигена для постановки РТГА или наличия антигена (вируса) в исследуемом материале (например, при гриппе). В реакции используются эритроциты животных, птиц, человека I (0) группы крови.
Для постановки ориентировочной РГА на предметное стекло наносят каплю 5% взвеси эритроцитов и каплю испытуемого материала, тщательно смешивают. При положительном результате через 1-2 минуты макроскопически наблюдают появление хлопьевидной агглютинации эритроцитов.
Для постановки РГА в развернутом ряду в лунках полистероловых планшетов готовят двукратно возрастающие разведения исследуемого материала на физиологическом растворе в объёме 0,5 мл. Во все пробирки вносят по 0,5 мл 0,25 — 1% взвеси эритроцитов. Результаты учитывают после полного оседания эритроцитов в контроле (эритроциты + физиологический раствор). Реакцию учитывают по характеру осадка эритроцитов. В положительных случаях степень агглютинации отмечают плюсами. Четырьмя плюсами оценивают реакцию, имеющую вид тонкой пленки из склеившихся эритроцитов, покрывающей дно пробирки (зонтик), реакцию с просветами в пленке отмечают тремя плюсами, наличие пленки с фестончатыми кружевными краями из склеившихся эритроцитов обозначают двумя плюсами, хлопьевидный осадок эритроцитов, окруженный зоной комочков агглютинированных эритроцитов соответствует одному плюсу. Резко очерченный осадок эритроцитов, неотличимый от контроля показывает отсутствие агглютинации. За титр принимают предельное разведение исследуемого материала, вызвавшее агглютинацию эритроцитов на два плюса.
При положительном результате РГА исследование продолжают, определяя тип выделенного вируса с помощью реакции торможения гемагглютинации типоспецифическими сыворотками.
РТГА основана на свойстве антисыворотки подавлять вирусную гемагглютинацию, так как нейтрализованный специфичными антителами вирус утрачивает способность агглютинировать эритроциты. При ориентировочном типировании вирусов используют капельный метод на стекле. Для окончательного установления типовой принадлежности выделенного вируса и титрования антител в сыворотках ставят развернутую РТГА в пробирках или в лунках. С этой целью готовят двухкратные разведения сывороток на физиологическом растворе и разливают по 0,25 мл. К разведениям сыворотки прибавляют по одной капле материала, содержащего вирус и по одной капле 1% взвеси эритроцитов.
При использовании РТГА для определения типа вируса, используют типоспецифические сыворотки, которые добавляют к равному объему рабочего разведения антигена. Типовую принадлежность выделенного вируса устанавливают по специфической иммунной сыворотке, показавшей наивысший титр антител к этому вирусу.
РГА и РТГА широко применяется для диагностики вирусных инфекций (клещевой энцефалит, грипп и др.) с целью обнаружения специфических антител и для идентификации многих вирусов по их антигенам.
Ограничения
- Для получения оптимальных и стабильных результатов необходимо настроить несколько переменных, включая продолжительность инкубации, концентрацию эритроцитов и тип эритроцитов.
- Помехи и ошибочные уровни титра могут быть вызваны неспецифическими компонентами в образце. Например, соединения в образце помимо вирусспецифических антител могут препятствовать агглютинации между вирусом и эритроцитами, а также предотвращать связывание антител с вирусом.
- Как правило, перед анализом материалы обрабатывают ферментами, разрушающими рецепторы (RDE), для предотвращения неспецифического ингибирования.
- Квалифицированный специалист должен проанализировать данные HA или HI, прочитав планшет и определив значения титра.
- Ручная интерпретация увеличивает вероятность различий в тестах из-за субъективности результатов и неравномерного согласия среди читателей.
- Кроме того, отсутствует цифровая запись планшета или определения титра, что делает первую интерпретацию трудоемкой и обычно выполняется в двух экземплярах. Разнообразие потенциальных переменных и расхождения между профессиональными читателями могут затруднить сравнение лабораторных данных.
Реакция торможения гемагглютинации: что это?
Реакция торможения гемагглютинации — серологическая реакция, основанная на способности антител предотвращать агглютинацию эритроцитов гемагглютинирующими видами вирусов (аденовирусами, арбовирусами, некоторыми энтеровирусами, вирусами гриппа и парагриппа, кори, реовирусами).
Специфические антивирусные антитела взаимодействуют с поверхностными молекулами гемагглютининов вирионов этих вирусов и блокируют их связывание с комплементарными им молекулами мембраны эритроцитов.
В последнее время реакция широко используется в лабораториях клинической вирусологии для определения титров специфических антител к тем или иным вирусам, а также для серологической идентификации и типирования изолятов вирусов из клинического материала от больных.
Используют несколько ограничено в силу наличия в сыворотке крови людей неспецифических ингибиторов вирусов, а также естественных антител — агглютининов.
Реакция нейтрализации — реакция торможения гемагглютинации (РТГА).
РТГА применяется:
- -для серотипирования вирусов;
- -для серодиагностики инфекций.
Выделяют два способа постановки:
- — капельный способ на стекле (ориентировочная реакция), применяется для серо копирования вирусов;
- — развернутый в пробирках.
Механизм.
У некоторых вирусов (например, гриппа) есть гемагглютинин, вызывающий агглютинацию эритроцитов различных животных, в зависимости от вида вируса.
При наличии в сыворотке антител — антигемагглютининов наблюдаются ингибирования активности вирусов.
РТГА.
Цель: серотипирование вируса гриппа А
Компоненты:
1. Исследуемый материал — аллантоисная жидкость куриного эмбриона,
2. Диагностические противогриппозные типоспецифические сыворотки,
3. 5 % взвесь куриных эритроцитов.
4. Физиологический раствор.
Реакция ставится на стекле капельным способом. На стекло наносят по 1 капле диагностических сывороток и исследуемого материала, перемешивают, затем добавляют 1 каплю взвеси эритроцитов. При положительной реакции наблюдается гомогенное покраснение, а при отрицательной выпадение хлопьев красного цвета (гемагглютинация).
Принцип метода РТГА
Принцип РТГА состоит в том, что в пробирке смешивают равные объемы сыворотки крови и суспензии вируса и после экспозиции определяют, сохранился ли в смеси вирус, путем добавления суспензии эритроцитов.
Агглютинация эритроцитов указывает на наличие, а отсутствие гемагглютинации – на отсутствие вируса в смеси. Исчезновение вируса из смеси вирус + сыворотка расценивается как признак взаимодействия антител сыворотки и вируса.
Но антитела с антигенами взаимодействуют в строго определенных количественных соотношениях. Поэтому, для того чтобы определенное количество вируса было лишено гемагглютинирующей способности, требуется определенный минимум антител, а так как один из компонентов РТГА всегда неизвестен, приходится реакцию ставить в ряду пробирок с различными дозами антител и одинаковыми дозами вируса или наоборот.
Это достигается тем, что берут или разные разведения сыворотки и одно и то же разведение вируса, или разные разведения вируса и одно и то же разведение сыворотки.
РТГА позволяет решать следующие задачи: определять титр антител к гемагглютинирующему вирусу в сыворотке; идентифицировать неизвестный гемагглютинирующий вирус по известным сывороткам; установить степень антигенного родства двух вирусов.
Достоинства РТГА: простота техники, быстрота, не требуется стерильной работы, специфичность, дешевизна. Недостаток: РТГА возможна только с гемагглютинирующими вирусами.
Принцип титрования антител в РТГА состоит в следующем:
- – готовят ряд последовательных (обычно 2-кратных) разведений исследуемой сыворотки в одинаковых объемах (чаще по 0,25 или 0,2 мл);
- – к каждому разведению добавляют такие же объемы гомологичного вируса в титре 4 ГАЕ;
- – смеси выдерживают определенное время при определенной температуре (для вируса ньюкаслской болезни 40–60 мин при комнатной температуре);
- – ко всем смесям добавляют равные объемы 1%-ной суспензии отмытых эритроцитов;
- – после экспозиции оценивают гемагглютинацию в каждой смеси в крестах.
В реакции предусматриваются контроли сыворотки, вируса и эритроцитов.
То наивысшее разведение сыворотки, которое еще полностью тормозит гемагглютинацию, принимается за показатель титра антител в этой сыворотке.
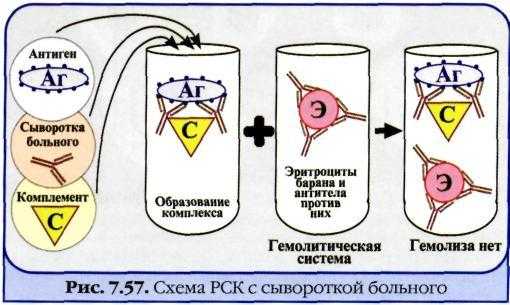
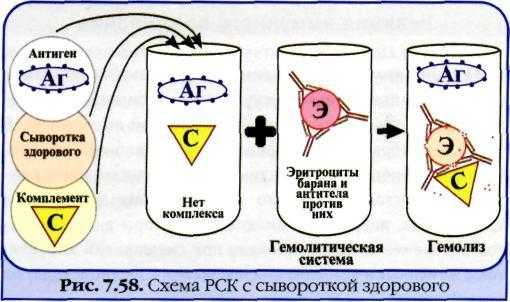
Реакция связывания комплемента. Механизм. Компоненты. Применение.
Реакция
связывания комплемента
(РСК)
заключается
в том, что при соответствии друг другу
антигены и антитела образуют иммунный
комплекс, к которому через Fc-фрагмент
антител присоединяется комплемент (С),
т. е. происходит связывание комплемента
комплексом антиген-антитело. Если
же комплекс антиген-антитело не
образуется, то комплемент остается
свободным.
Специфическое
взаимодействие АГ и AT
сопровождается адсорбцией (связыванием)
комплемента. Поскольку процесс связывания
комплемента не проявляется визуально,
Ж. Борде и О.Жангу предложили использовать
в качестве индикатора гемолитическую
систему (эритроциты барана + гемолитическая
сыворотка), которая показывает,
фиксирован ли комплемент комплексом
АГ-АТ. Если АГ и AT
соответствуют друг другу, т. е. образовался
иммунный комплекс, то комплемент
связывается этим комплексом и гемолиза
не происходит. Если AT
не соответствует АГ, то комплекс не
образуется и комплемент, оставаясь
свободным, соединяется со второй системой
и вызывает гемолиз.
Компоненты
.
Реакция связывания комплемента (РСК)
относится к сложным серологическим
реакциям. Для ее проведения необходимы
5 ингредиентов, а именно: АГ, AT
и комплемент (первая система), эритроциты
барана и гемолитическая сыворотка
(вторая система).
Антигеном
для РСК могут быть культуры различных
убитых микроорганизмов, их лизаты,
компоненты бактерий, патологически
измененных и нормальных органов, тканевых
липидов, вирусы и вирусосодержащие
материалы.
В
качестве комплемента
используют свежую или сухую сыворотку
морской свинки.
Механизм
.
РСК проводят в две фазы: 1-я фаза —
инкубация смеси, содержащей три компонента
антиген + антитело + комплемент; 2-я фаза
(индикаторная) — выявление в смеси
свободного комплемента путем добавления
к ней гемолитической системы, состоящей
из эритроцитов барана, и гемолитической
сыворотки, содержащей антитела к
ним. В 1-й фазе реакции при образовании
комплекса антиген-антитело происходит
связывание им комплемента, и тогда во
2-й фазе гемолиз сенсибилизированных
антителами эритроцитов не произойдет;
реакция положительная. Если антиген и
антитело не соответствуют друг другу
(в исследуемом образце нет антигена
или антитела), комплемент остается
свободным и во 2-й фазе присоединится к
комплексу эритроцит — ан-тиэритроцитарное
антитело, вызывая гемолиз; реакция
отрицательная.
Применение
.
РСК применяют для диагностики многих
инфекционных болезней, в частности
сифилиса (реакция Вассермана).
| » |
Использование в вирусологии реакции гемадсорбции
РГАд. Гемадсорбция – соединение эритроцитов с поверхностью пораженных вирусом клеток – впервые была обнаружена Фогелем и Щелоковым (1957) на культуре ткани, инфицированной вирусом гриппа. В основе этого явления лежит родство рецепторов вируса, находящихся на поверхности пораженной клетки, с рецепторами эритроцита, что приводит к их взаимному сцеплению аналогично реакции гемагглютинации. Преимущество этой реакции состоит в том, что она становится положительной еще до появления отчетливых цитопатических изменений в инфицированных клетках.
Методика РГАд состоит в следующем. На 3–4-й день после инфицирования клеток берут две пробирки с одинаковой культурой клеток, из которых одна заражена вируссодержащим материалом, а вторая контрольная. Из обеих пробирок сливают культуральную жидкость и вносят в обе по 2–3 капли 0,5%-ной суспензии отмытых эритроцитов.
Обе пробирки оставляют на 5–10 мин так, чтобы эритроциты были на поверхности клеток (кладут горизонтально на стол), а затем слегка споласкивают физраствором и исследуют под микроскопом (малое увеличение). В контрольной пробирке эритроциты полностью удаляются с физраствором, а некоторые из оставшихся плывут вместе с жидкостью. Если в зараженной пробирке эритроциты не удалились с физраствором и не плывут, а прикреплены к поверхности клеток, следует считать РГАд положительной.
В зависимости от вируса и вида клеток расположение эритроцитов может быть трояким:
- – эритроциты адсорбированы только по периферии клеточного пласта в виде «ожерелья» (вирус африканской чумы свиней);
- – эритроциты расположены на слое клеток очагами или скоплениями (вирус гриппа);
- – эритроциты расположены на слое клеток диффузно (вирус парагриппа).
- Каждый вирус способен адсорбировать эритроциты крови животных определенных видов.
Серологическая диагностика вирусных болезней по приросту титра антител в парных сыворотках крови.
Реакция гемагглютинации (рга)
Аг (эритроциты крови) + АТ (стандартная сыворотка) + электролит = гемагглютинат
На плоскость (тарелку, планшет) наносят глазной пипеткой, индивидуальной для каждой ампулы, по 2 кап. (0,1 мл) стандартной сыворотки двух различных серий каждой группы слева направо: Оab(I), Аb(II), Вa(III). Итого 6 капель на расстоянии 3-4 см друг от друга. Рядом со стандартными сыворотками наносят по 1 кап. исследуемой крови величиной с булавочную головку — 0,01 мл 20% взвеси исследуемых эритроцитов. Встряхиванием перемешивают сыворотку с кровью, периодически покачивают и смотрят результат через 5 минут. В те капли, где наступила агглютинация, вносят по 1 кап. физиологического раствора.
Оценка результатов
Нет агглютинации во всех сыворотках — это Оab(I) группа крови
Агглютинация в сыворотках Оab(I) и Вa(III) — это Аb(II) группа крови
Агглютинация в сыворотках Оab(I) и Аb(II) — это Вa(III) группа крови
Агглютинация во всех сыворотках — это АВ0(IV) группа крови
Рис. 13. Результат РГА при определении группы крови АВО: а) — отрицательная РГА (нет гемагглютинации); б) — положительная РГА (гемагглютинация).
Если сыворотки всех трех групп дали положительную реакцию, то для исключения неспецифической агглютинации необходимо провести дополнительное контрольное исследование со стандартной сывороткой АВ0(IV) группы. Для этого на плоскость наносят большую (0,1 мл) каплю сыворотки АВ0(IV) и к ней добавляют маленькую (0,01 мл) каплю исследуемой крови и смотрят результат через 5 минут. Лишь отсутствие агглютинации в этой капле при наличии ее в каплях со стандартными сыворотками групп Оab(I), Аb(II) и Вa(III) позволяет считать реакцию специфической и отнести исследуемую кровь к группе АВ0(IV).
-
Липома конъюнктивы: признаки, гистология, лечение, прогноз
-
Как ухаживать за центральным венозным катетером, если он не используется?
-
Солитарная отграниченная астроцитарная пролиферация сетчатки: признаки, гистология, лечение, прогноз
-
Клиника и диагностика злокачественной меланомы
- Источники и дозы ионизирующего облучения




























