Классификация белков
Существует несколько критериев, по которым можно классифицировать белковые соединения. По составу различают простые и сложные белки. Сложные белковые вещества содержат в своем составе неаминокислотные группы, химическая природа которых может быть различной. В зависимости от этого выделяют:
- гликопротеины;
- липопротеины;
- нуклеопротеины;
- металлопротеиды;
- фосфопротеины;
- хромопротеиды.
Также существует классификация по общему типу строения:
- фибриллярные;
- глобулярные;
- мембранные.
Протеинами называют простые (однокомпонентные) белки, состоящие лишь из остатков аминокислот. В зависимости от растворимости они делятся на следующие группы:
| Название протеина | Растворимость | Примеры |
| Проламины |
Слабо растворимы в воде, хорошо – в 70-80% этаноле. Содержат большое количество аргинина. |
Белки характерны для семян злаков (гордеин содержится в ячмене, зеин – в кукурузе). |
| Гистоны | Растворяются в слабой соляной кислоте. | Присутствуют в составе хроматина, из которого состоят хромосомы. |
| Склеропротеины (протеноиды) |
Не растворяются в воде, солевых жидкостях, разбавленных кислотах и щелочах. |
Содержатся в опорных тканях (костях, волосах, хрящах, сухожилиях). Включают много пролина, аланина, глицина. |
| Альбумины | Растворяются в воде и растворах солей. | Лактоальбумин – молочный белок, сероальбумин –сыворотки крови. |
| Глобулины | Хорошо растворяются растворах солей слабой концентрации. | Входят в состав бобовых и масленичных растений (фазеолин – семена фасоли, легумин – семена гороха и др.). |
| Протамины | Растворяются в кислотах. | В немалом количестве находятся в половых клетках человека и животных. Например, в сперме рыб (сальмин – семейство лососевых). |
| Глютелины | Растворимы в щелочах. | Содержатся в растениях: плодах и зеленых частях. Глиадин зерновки пшеницы вместе с глютенином образует клейковину, за счет которой тесто становится эластичным. |
Подобная классификация не совсем точна, ведь согласно последним исследованиям многие простые белки связаны с минимальным количеством небелковых соединений. Так, в состав некоторых протеинов входят пигменты, углеводы, иногда липиды, что делает их больше похожими на сложные белковые молекулы.
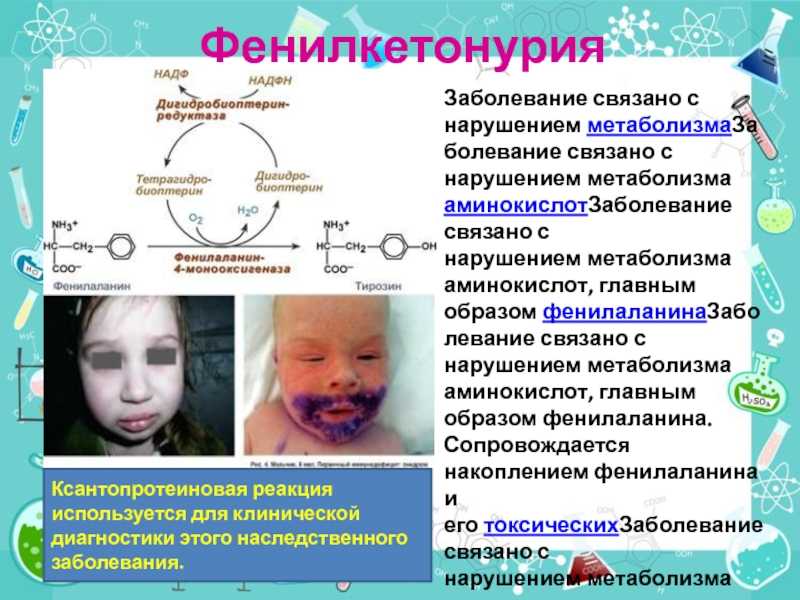
Слайд 40Фенилкетонурия Заболевание связано с нарушением метаболизмаЗаболевание связано с нарушением метаболизма аминокислотЗаболевание связано с нарушением метаболизма
аминокислот, главным образом фенилаланинаЗаболевание связано с нарушением метаболизма аминокислот, главным образом фенилаланина. Сопровождается накоплением фенилаланина и его токсическихЗаболевание связано с нарушением метаболизма аминокислот, главным образом фенилаланина. Сопровождается накоплением фенилаланина и его токсических продуктов, что приводит к тяжёлому поражению ЦНСЗаболевание связано с нарушением метаболизма аминокислот, главным образом фенилаланина. Сопровождается накоплением фенилаланина и его токсических продуктов, что приводит к тяжёлому поражению ЦНС, проявляющемуся, в частности, в виде нарушения умственного развития.Диагностика заболевания:Капнуть на мокрую пеленку новорожденного HNO3: если появляется желтое пятно — ребенок болен (лечение – введение недостающего фермента).
Ксантопротеиновая реакция используется для клинической диагностики этого наследственного заболевания.
Биологическое значение
Б. выполняют многочисл. функции. Обмен веществ (пищеварение, дыхание, выделение и др.) и жизнь клетки в целом неразрывно связаны с активностью ферментов – высокоспецифических катализаторов биохимич. реакций, являющихся Б. Защитные системы высших организмов формируются защитными Б., к которым относятся иммуноглобулины, Б. комплемента, цитокины иммунной системы, Б. системы свёртывания крови (в т. ч. плазмин, тромбин, фибрин). Важную группу составляют регуляторные Б., контролирующие биосинтез Б. и нуклеиновых кислот. К их числу относятся также пептидно-белковые гормоны. Информация о состоянии внешней среды, разл. регуляторные сигналы воспринимаются клеткой с помощью рецепторных Б., располагающихся на наружной поверхности плазматич. мембраны. За передачу сигналов внутрь клетки ответственны Б. сигнальных систем ($\ce{G}$-белки, Б.-эффекторы), которые играют важную роль в передаче нервного возбуждения и в ориентированном движении клетки (хемотаксис). В активном транспорте ионов, липидов, сахаров и аминокислот через биологич. мембраны участвуют транспортные Б., или Б.-переносчики. Среди них, напр., гемоглобин и миоглобин, осуществляющие перенос кислорода. Основу костной и соединит. тканей, шерсти, роговых образований составляют структурные Б. (в т. ч. коллаген, кератин, эластин). Они же формируют клеточный скелет и межклеточный матрикс. Расхождение хромосом при делении клетки, движение жгутиков, работа мышц животных и человека осуществляются по единому механизму при посредстве Б. сократительной системы (актина, миозина, тропомиозина, тубулина и др.). Б. – важнейшая составная часть пищи человека и кормов животных. Особое значение при этом имеют запасные Б. растений и животных (напр., казеин, проламины). Преобразование и утилизация энергии, поступающей в организм с пищей, а также энергии солнечного излучения происходят при участии Б. биоэнергетической системы (напр., родопсина, цитохромов). Среди пептидно-белковых веществ имеются антибиотики (в т. ч. грамицидины, полимиксины, энниатины), токсины и др. биологически активные вещества.
ТОП-10 малоизвестных фактов о белке

Интересный факт! Первый белок выделили из муки
- Белки начали изучать с 1728 года, именно тогда итальянец Якопо Бартоломео Беккари выделил белок из муки.
- Сейчас широкое распространение получили рекомбинантные белки. Их синтезируют путем модификации генома бактерий. В частности, таким способом получают инсулин, факторы роста и другие белковые соединения, которые используют в медицине.
- У антарктических рыб были обнаружены белковые молекулы, предотвращающие замерзание крови.
- Белок резилин отличается идеальной эластичностью и является основой мест крепления крыльев насекомых.
- В организме есть уникальные белки шапероны, которые способны восстанавливать корректную нативную третичную или четвертичную структуру других белковых соединений.
- В ядре клетки присутствуют гистоны – белки, которые принимают участие в компактизации хроматина.
- Молекулярную природу антител – особых защитных белков (иммуноглобулинов) – начали активно изучать с 1937 года. Тиселиус и Кабат применяли электрофорез и доказали, что у иммунизированных животных увеличена гамма-фракция, а после абсорбции сыворотки провоцирующим антигеном, распределение белков по фракциям возвращалось к картине интактного животного.
- Яичный белок – яркий пример реализации белковыми молекулами резервной функции.
- В молекуле коллагена каждый третий аминокислотный остаток образован глицином.
- В составе гликопротеинов 15-20% составляют углеводы, а в составе протеогликанов их доля – 80-85%.
Биологическое значение белка
Рис. 4. Структура фермента аланинаминотрансферазы
Благодаря своим физическим и химическим свойствам белки выполняют большое количество биологических функций, в перечень которых входят:
- каталитическая (белки-ферменты);
- транспортная (гемоглобин);
- структурная (кератин, эластин);
- сократительная (актин, миозин);
- защитная (иммуноглобулины);
- сигнальная (рецепторные молекулы);
- гормональная (инсулин);
- энергетическая.
Белки важны для организма человека, поскольку участвуют в образовании клеток, обеспечивают сокращение мышц у животных, вместе с сывороткой крови переносят многие химические соединения. Помимо этого, белковые молекулы являются источником незаменимых аминокислот и осуществляют защитную функцию, участвуя в выработке антител и формировании иммунитета.
Строение белков
В пространственном строении белков большое значение имеет характер радикалов (остатков) R— в молекулах аминокислот. Неполярные радикалы аминокислот обычно располагаются внутри макромолекулы белка и обусловливают гидрофобные взаимодействия; полярные радикалы, содержащие ионогенные (образующие ионы) группы, обычно находятся на поверхности макромолекулы белка и характеризуют электростатические (ионные) взаимодействия. Полярные неионогенные радикалы (например, содержащие спиртовые ОН-группы, амидные группы) могут располагаться как на поверхности, так и внутри белковой молекулы. Они участвуют в образовании водородных связей.
В молекулах белка а-аминокислоты связаны между собой пептидными (—СО—NH—) связями:
Биологическое значение белков
Белки — основа биомембран, важнейшей составной части клетки и клеточных компонентов. Они играют ключевую роль в жизни клетки, составляя как бы материальную основу ее химической деятельности.
Исключительное свойство белка — самоорганизация структуры, т. е. его способность самопроизвольно создавать определенную, свойственную только данному белку пространственную структуру. По существу, вся деятельность организма (развитие, движение, выполнение им различных функций и многое другое) связана с белковыми веществами. Без белков невозможно представить себе жизнь.
Белки — важнейшая составная часть пищи человека и животных, поставщик необходимых аминокислот.
Белки
Белки — это высокомолекулярные (молекулярная масса варьируется от 5-10 тыс. до 1 млн и более) природные полимеры, молекулы которых построены из остатков аминокислот, соединенных амидной (пептидной) связью.
Белки также называют протеинами (греч. «протос» — первый, важный). Число остатков аминокислот в молекуле белка очень сильно колеблется и иногда достигает нескольких тысяч. Каждый белок обладает своей присущей ему последовательностью расположения аминокислотных остатков.
Белки выполняют разнообразные биологические функции: каталитические (ферменты), регуляторные (гормоны), структурные (коллаген, фиброин), двигательные (миозин), транспортные (гемоглобин, миоглобин), защитные (иммуноглобулины, интерферон), запасные (казеин, альбумин, глиадин) и другие.
Выполнение белками определенных специфических функций зависит от пространственной конфигурации их молекул, кроме того, клетке энергетически невыгодно держать белки в развернутой форме, в виде цепочки, поэтому полипептидные цепи подвергаются укладке, приобретая определенную трехмерную структуру, или конформацию. Выделяют 4 уровня пространственной организации белков.
Слайд 46ФУНКЦИИ БЕЛКОВКератин – белок, входящий в состав волос волос, ногтей, волос, ногтей, шерсти,
перьев, иглигл, роговигл, рогов, когтейигл, рогов, когтей, копыт животных.Фиброин – белок (ГЛИ+АЛА+ТИР+СЕР), выделяемый паукообразнымивыделяемый паукообразными и некоторыми насекомымивыделяемый паукообразными и некоторыми насекомыми, составляющий основу нитей паутинывыделяемый паукообразными и некоторыми насекомыми, составляющий основу нитей паутины и коконоввыделяемый паукообразными и некоторыми насекомыми, составляющий основу нитей паутины и коконов насекомых, в частности — шелкавыделяемый паукообразными и некоторыми насекомыми, составляющий основу нитей паутины и коконов насекомых, в частности — шелка тутового шелкопряда.Коллаген – белок, составляющий основу соединительной ткани организма, обеспечивающий ее прочность и эластичность.
1.СТРОИТЕЛЬНАЯ ФУНКЦИЯ

Слайд 60СОСТАВЛЕНИЕ СИНКВЕЙНАСинквейн (с фр.) – «пять строк», пятистрочная строфа нерифмованного стихотворения.Работа над
созданием синквейна является одним из эффективных методов развития образной речи, который позволяет быстро получить результат.Синквейн – концентрация знаний, ассоциаций, чувств; сужение оценки явлений и событий, выражение своей позиции, взгляда на событие, предмет.Правила составления синквейна 1. Одно слово, обычно существительное, отражающее главную идею;
2. Два слова, прилагательные, описывающие основную мысль;
3. Три слова, глаголы, описывающие действия в рамках темы;
4. Фраза из нескольких слов, показывающая отношение к теме;
5. Слово или несколько слов, связанные с первым, отражающие сущность темы.Пример синквейна1. АМИНОКИСЛОТЫ2. НЕЗЕМЕНИМЫЕ, АМФОТЕРНЫЕ3. СОЕДИНЯЮТСЯ, РАСТВОРЯЮТСЯ, ПЛАВЯТСЯ4. ПРОЯВЛЯЮТ СВОЙСТВА АМИНОВ И КАРБОНОВЫХ КИСЛОТ5. МОНОМЕРЫ БЕЛКОВ

Лучшее за месяц
- Офтальмология. Учебник для вузов — Сидоренко Е.И. — 2002 год
- Морфофункциональная характеристика В-лимфоцитов и плазматических клеток. Их участие в иммунных реакциях
- Внешние силы, действующие на организм человека, и их краткая характеристика
- Органеллы специального назначения (микроворсинки, реснички, тонофибриллы, миофибриллы), их строение и функции
- Понятие о гемостазе
- Цитоплазма. Общая морфо-функциональная характеристика. Классификация органелл, их структура и функции
- Органеллы немембранного типа. Их строение и функции
- Понятие о системах групп крови
- Гиалоплазма. Её физико-химический состав и основные функции
- Внутренние силы и их краткая характеристика
- Органеллы мембранного типа. Их строение и функции
- Понятие о крови
- Строение и функциональное значение тимуса. Взаимодействие стромальных и гемопоэтичисеких элементов в ходе лимфопоэза. Эндокринная функция тимуса. Понятие о возрастной и акцидентальной инволюции вилочковой железы
- Морфологическая и функциональная классификация нейронов. Структурная организация нейронов
- Функциональная анатомия и топография серого вещества спинного мозга
- Микроциркуляторное русло. Его морфо-функциональная характеристика. Классификация и общий план строения капилляров. Особенности строения капилляров по эндотелию, базальной мембране. Понятие о гистогематическом барьере
- Генетика, молекулярная кибернетика. Личности и проблемы — Ратнер В.А. — 2002 год
- Хрящевые ткани. Общая морфо-функциональная характеристика. Классификация. Развитие и особенности строения различных хрящевых тканей. Надхрящница. Рост хряща, возможности регенерации и возрастные изменения хрящевых тканей
- Рыхлая волокнистая неоформленная соединительная ткань. Морфо-функциональная характеристика. Межклеточное вещество, строение и значение. Клетки фибробластического ряда, их роль в регуляции состава межклеточного вещества
- Функциональная анатомия оболочек и межоболочечных пространств спинного и головного мозга
Определение, состав и строение белка
Белки являются биополимерами, мономерами которых являются остатки альфа-аминокислот, соединенные между собой посредством пептидных связей. Аминокислотная последовательность каждого белка строго определена, в живых организмах она зашифрована посредством генетического кода, на основе считывания которого и происходит биосинтез белковых молекул. В построении белков участвует 20 аминокислот.
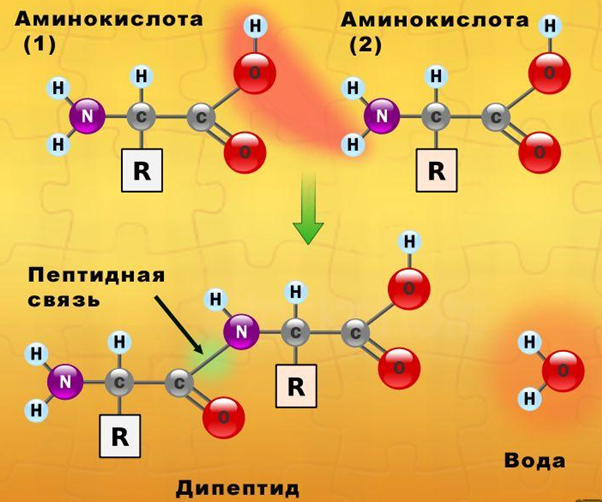
Рис. 1. Схема образования молекулы белка (дипептида).
Различают следующие виды структуры белковых молекул:
- Первичная. Представляет собой аминокислотную последовательность в линейной цепи.
- Вторичная. Это более компактная укладка полипептидных цепей при помощи формирования водородных связей между пептидными группами. Есть два варианта вторичной структуры – альфа-спираль и бета-складчатость.
- Третичная. Представляет собой укладку полипептидной цепочки в глобулу. При этом формируются водородные, дисульфидные связи, также стабилизация молекулы реализуется благодаря гидрофобным и ионным взаимодействиям аминокислотных остатков.
- Четвертичная. Белок состоит из нескольких полипептидных цепей, которые взаимодействуют между собой посредством нековалентных связей.
Таким образом, соединенные в определенной последовательности аминокислоты образуют полипептидную цепь, отдельные части которой сворачиваются в спираль или формируют складки. Такие элементы вторичной структур образуют глобулы, формируя третичную структуру белка. Отдельные глобулы взаимодействуют между собой, образуя сложные белковые комплексы с четвертичной структурой.
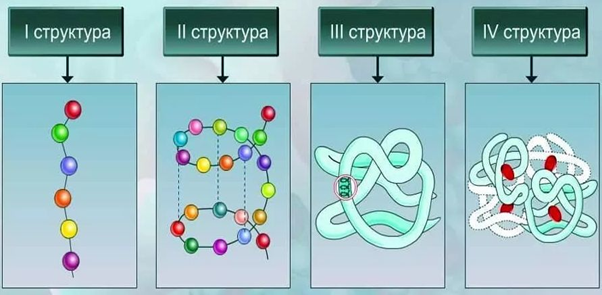
Рис. 2. Структурная организация белков.
Физико-химические свойства белков. Молекулярная масса, размеры и форма, растворимость, ионизация и гидратация
Основные физико-химические свойства белков:1. Различия белков по молекулярной массе: белки явл. высокомолекулярныыми соединениями, но могут сильно отличаться по молекулярной массе, которая колеблется от 6000 до 1 000 000 Д и выше. Молекулярная масса белка зависит от количества АК остатков в ППЦ, а для олигомерных белков – и от количества входящих в него протомеров (или субъединиц).2. Различия белков по форме молекул• Глобулярные – имеют более компактную структуру, в третичной стр-ре имеют шарообразную форму, их гидрофобные радикалы в большинстве своём спрятаны в гидрофобное ядро, и они значительно лучше растворимы в жидкостях организма (гемоглобин, инсулин)• Фибриллярные – имеют нитевидн. стр-ру, нерастворимы (коллаген, кератин)3. Растворимость – это способность белка равномерно располагаться (распространяться) между молекулами растворителя, зависит от аминокислотного состава белка и природы растворителя. • Растворимость белка определяется составом растворителя, т.е. наличием в растворе других растворённых веществ. Например, некоторые белки легче растворяются в слабом солевом растворе, чем в дистиллированной воде.• Увеличение конц. нейтральных солей может способствовать выпадению определённых белков в осадок.• Денатурирующие агенты, присутствующие в растворе, также снижают растворимость белков.4. Гидратация – способность белков прочно связывать значительное количество влаги. На поверхности большинства внутриклет. белков преобладают полярные радикалы, однако соотношение полярных и неполярных групп отлично для разных индивидуальных белков. Протомеры олигомерных белков в области контактов друг с другом часто содержат гидрофобные радикалы. Поверхности белков, функционирующих в составе мембран или прикрепляющиеся к ним в процессе функционирования, также обогащены гидрофобными радикалами. Такие белки лучше растворимы в липидах, чем в воде.5. Кислотно основные свойства – белки обладают кислотными и основными свойствами из-за присутствия -СООН и — NН2 групп.6. Ионизация – заряд белковой молекулы обусловлен реакцией среды и соотношением ионогенных групп в белковой молекуле.• Полярные (неионогенные) группы: — ОН (сер, тре, тир) SН (цис), Амидная (глн, асн), Пептидные группировки • Полярные (ионогенные) группы: СОО-(асп, глу), NН3+ (лиз, арг), N – (гис)Суммарный заряд белковой молекулы зависит от соотношения ионизированных анионных радикалов Глу и Асп и катионных радикалов Лиз, Apг и Гис.Степень ионизации функц-х групп этих радикалов зависит от рН среды. • При рН раствора около 7 все ионогенные группы белка находятся в ионизированном состоянии.• В кислой среде увеличение концентрации протонов (Н+) приводит к подавлению диссоциации карбоксильных групп и уменьшению отрицательного заряда белков: -СОО- + Н+ → -СООН. • В щелочной среде связывание избытка ОН» с протонами, образующимися при диссоциации NH3+с образованием воды, приводит к уменьшению положительного заряда белков:-NH3+ +ОН- → -NH2 + H2O.Изоэлектрическая точка (pI) – значение рН, при котором белок приобретает суммарный нулевой заряд. В pI количество «+» и «-» заряженных групп белка одинаково, т.е. белок находится в изоэлектрическом состоянии.• Так как большинство белков в клетке имеет в своём составе больше анионогенных групп (-СОО-), то pI этих белков лежит в слабокислой среде. • pI белков, в составе которых преобладают катионогенные группы, находится в щелочной среде. Наиболее яркий пример таких внутриклеточных белков, содержащих много аргинина и лизина, — гистоны, входящие в состав хроматина.Одноименно заряженные молекулы белка отталкиваются друг от друга, что предотвращает агрегацию молекул белка и образование осадка.Белки, имеющие суммарный положительный или отрицательный заряд, лучше растворимы, чем белки, находящиеся в pIЗаряженные белки могут двигаться в электрическом поле:• Анионные белки («-» заряд) будут двигаться к «+» заряженному аноду• Катионные белки («+» заряд) будут двигаться к «-» заряженному катоду
Похожие материалы:






























