Исследование генетики бактерий
Генетика позволяет определить свойства наследственности и изменчивости конкретного микроорганизма
Изучение этих свойств очень важно, поскольку дает возможность понять механизм тех мутаций в генном коде, которые позволяют бактериям с такой невероятной скоростью и легкостью приспосабливаться к изменяющимся внешним условиям
Еще одной важной особенностью генетики бактерий является то, что ее принципы справедливы для всего органического мира. Изучив генетику бактерий, можно на молекулярном уровне установить все основные эволюционные законы. Основной предмет изучения генетики бактерий – мутации (скачкообразное изменение наследственного признака)
Основной предмет изучения генетики бактерий – мутации (скачкообразное изменение наследственного признака).
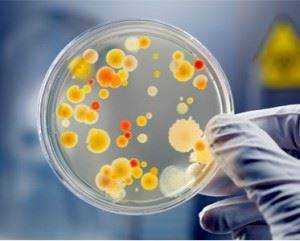
Исследование мутаций происходит с использованием бактериофагов (вирусы бактерий, которые разрушают бактериальную клетку).
Вырабатываемая бактериями в результате мутаций устойчивость к фагам фиксируется разными методами:
- флуктуационный тест;
- перераспределительный тест;
- метод реплик и т.д.
Изменение в генетике исследуемой бактерии фиксируется только тогда, когда приобретенной одной колонией свойство передается по наследству следующим поколениям.
Мутантов среди бактерий выявляют следующими методами:
- прямой отбор (посев на специально подобранную селективную среду);
- непрямое выявление, так называемый метод перепечатывания колоний с одной чашки Петри на другую до обнаружения прогнозированных мутантов;
- пенициллиновый метод позволяет достаточно быстро выявить мутантов, поскольку вводимый исследователем пенициллин угнетает рост немутировавших клеток.
Исследование генетики бактерий производится с использованием новейшего оборудования, которое позволяет не только выявить изменения наследственности, но и на молекулярном уровне определить их природу.
Сегодня такие исследования генетики бактерий находятся в активной фазе. Микробиологи регулярно делятся зафиксированными новинками. О завершении исследований в этой области говорить пока еще очень рано.
Выявление отдельных клеточных структур
Выявление жгутиков позволяет идентифицировать бактериальные клетки по типу подвижности.
Обнаружить клеточную структуру не так просто, как найти саму бактерию. Для этих целей используются разные способы окраски жгутиков.
Способ окраски жгутиков заключается в том, что разные по составу красители оседают на их поверхности. В результате такого оседания жгутики утолщаются. Кроме того, уменьшается прозрачность как всей клетки, так и самого жгутика (бактериальная клетка в обычных условиях практически прозрачная).
Метод окраски жгутиков по Цилю предполагает следующую технологию выполнения:
- Каплю водного раствора с чистой культурой наносят на предметное стекло и высушивают в естественных условиях.
- Бактерий протравливают специальным раствором на основе спирта, сернокислого железа и танина, поскольку пока бактерии живы, окрасить их жгутики невозможно.
- После этого их прокрашивают карболовым фуксином Циля.
- Предметное стекло промывают водой и просушивают.
После всех проведенных процедур жгутики будут видны в микроскоп как тоненькие ниточки.
Белковая диета
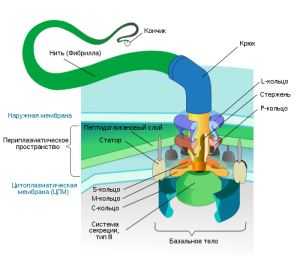
Среди подвижных бактерий больше всего тех, кто для движения использует белковые молекулы. Как они их применяют? Многие бактерии синтезируют специальные белки, из которых собирают подвижную ниточку — жгутик
(рис. 1). Жгутик состоит из трех частей — филамента (собственно нити), крюка и базального тела. Каждая из этих частей сложена из белков. У хорошо изученной бактерии — кишечной палочки — белки, образующие филамент, называют флагеллинами
и обозначают буквами Flg, Fli, Flh (от латинского слова flagellum
— жгутик). Флагеллины складываются в нить, которая с помощью крюка крепится к базальному телу. Базальное тело — это что-то вроде якоря, который прочно закреплен в клеточной оболочке и может свободно вращаться по часовой стрелке или против. У бактерий может быть один или несколько жгутиков.
Какие виды движения обеспечивает жгутик? Если бактерия находится в жидкой среде, то жгутик помогает ей плыть
. Плавание — это самый быстрый способ передвижения. Причем, бактерия может неплохо управлять своим движением, меняя направление вращения базального тела: вращение базального тела по часовой стрелке толкает клетку в направлении от жгутика, а биения против часовой стрелки тянут клетку вслед за жгутиком.
А теперь представьте размахивание жгутиками на твердой поверхности, смоченной жидкостью. Бактерии будут не плыть, а расползаться в одной плоскости. Такое движение называется роением
. Роение чаще бывает у бактерий, живущих в крупных колониях, — подвижные бактерии, находящиеся с краю, пытаются отодвинуться как можно дальше и основать свои собственные колонии.
Бактерии могут также создавать более короткие и просто устроенные нити, чем жгутики, — пили. Клетка может с помощью пили прикрепиться к чему-нибудь твердому, а потом подтянуться к месту крепления, разбирая эту нить, начиная от места крепления пили к клетке (рис. 2). Можно сказать, что клетка перемещается рывками. Подобный способ движения у одной клетки называется твитчинг
(англ. twitch
— дергать, тащить). А если так действует несколько скрепленных друг с другом бактерий, то они дружно скользят
по твердой поверхности.
В оболочках клетки могут быть разнообразные белковые комплексы, например, обхватывающие клетку кольца из белков. Эти кольца крутятся, как гусеницы у гусеничного трактора, и помогают бактерии скользить
по твердой поверхности. Такой способ подвижности есть у бактерии Flavobacterium johnsoniae
.
У других бактерий есть белки, расположенные вдоль всей поверхности клетки. Эти белки создают продольные волны, и бактерия извивается и плывет
в водной толще или скользит
на твердом субстрате.
Очень многие микроорганизмы способны двигаться, но вот конкретный механизм или набор из нескольких механизмов у каждой специфичен. Поэтому, например, и говорят, что такое строение жгутика характерно для кишечной палочки, а у другой бактерии, тоже плывущей с помощью жгутика, все может быть устроено иначе — и ученые исследуют каждую бактерию по отдельности.
Как вы, наверное, заметили, пока что описанные способы движения позволяли бактерии плыть или скользить в зависимости от того, где она находится, — в жидкости или на твердой поверхности. Но скольжение может быть и единственным доступным способом передвижения.
Сахарный след
Многие бактерии выделяют наружу сахара. Смешиваясь с водой, сахара образуют слизь. Слизь облегчает движение клеток по твердой поверхности при использовании жгутиков.
Однако и сама слизь может быть источником движения. Представьте себе, что вы надуваете воздушный шарик. Внезапно шар вырывается из ваших рук и улетает под силой струи воздуха, резко выходящей из шарика. Подобным образом могут толкать себя и бактерии.
Бактерии вида Oscillatoria princeps
(рис. 3, слева
) живут, объединяясь в длинные нити. Хотя каждая клетка представляет собой самостоятельный организм, они соединены вместе внешней прозрачной капсулой, которая тоже производится из сахаров. На клетках возле места их соединения друг с другом есть контактные поры, расположенные под углом к поверхности нити (рис. 3, справа
). Часть из них повернута к одному концу нити, другая половина к другому. Слизь подается в одном направлении и поступает в канал, образованный из белков на поверхности клеток. Канал оборачивается вокруг клеток по спирали, текущая по нему слизь запускает вращение клеток, и вся нить скользит по твердой поверхности, подобно штопору — такой способ движения называется «подвижность с помощью реактивной струи»
.
Выделение сахаров из специальных пор или биение жгутиков — это активные способы передвижения клетки. Бактерия взаимодействует с окружающей средой и активно отталкивается от воды или твердой поверхности. Но существует и пассивная подвижность, когда изменения внутри клетки приводят к ее перемещению благодаря внешним силам, например, току воды.
Взаимодействие бактерий с антибиотиками
Выявление чувствительности бактерий к антибиотикам имеет большое практическое значение для расчета дозировки препаратов при профилактике и лечении инфекционных заболеваний.
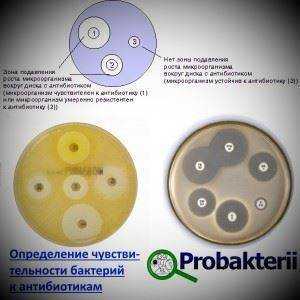
Для выявления чувствительности микробов к различным антибиотикам применяются два основных метода:
- определение чувствительности к антибиотиками при помощи дисков;
- изучение чувствительности микроорганизмов к антибиотикам посредством серийного разведения.
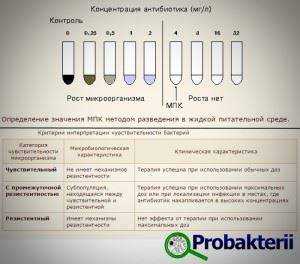
Методика с использованием дисков
Для выявления степени чувствительности к антибиотикам, в питательную культуру засевают изучаемые бактерии. На поверхности размещают диски, содержащие различные антибиотики в известных дозировках.
Пробу выдерживают при оптимальной температуре (37°С) сутки, после чего, сравнивая диаметр кольцевых безмикробных зон вокруг различных дисков, делают вывод о чувствительности бактерий к различным антибиотикам и их концентрациям.
Для получения воспроизводимых результатов следует пользоваться стандартными дисками и питательной средой, а в качестве контроля применять эталонные штаммы. Методика дисков не позволяет получить надежные результаты, а так же очень критична к слабодифундирующим антибиотикам (ристомицин или полимиксин).
Серийное разведение
Чувствительность микробов к антибиотикам методом серийного разведения позволяет выявить минимальную концентрацию лекарственного препарата, оказывающую терапевтический эффект. Чувствительность микроорганизмов определяют, как:
- чувствительные штаммы – жизнедеятельность бактерий подавляется обычной дозировкой антибиотиков в крови;
- умеренно устойчивые штаммы – для ингибирования бактерий необходимо использование максимальных доз антибиотиков;
- устойчивые бактерии – жизнедеятельность бактерий не подавляется даже при максимальной концентрации антибиотика, то есть отсутствие чувствительности.
Роль цитоплазматической мембраны и ее образований
Цитоплазматическая мембрана – важная часть клетки, которая обеспечивает связь между цитоплазмой и клеточной стенкой.
Выявить цитоплазматическую мембрану окрашиванием не представляется возможным. Кроме того, в этом нет никакой практической необходимости, поскольку цитоплазматическая мембрана – обязательная структура каждой бактериальной клетки.
Цитоплазматическая мембрана имеет практически всегда один и тот же биохимический состав. Для изучения структур клетки и ее включений необходимо изучение проводящих функций цитоплазматической мембраны. Эти исследования осуществляются такими бактериологическими методами, как молекулярно-генетический и серологический.
Подвижность как важный фактор идентификации бактерий
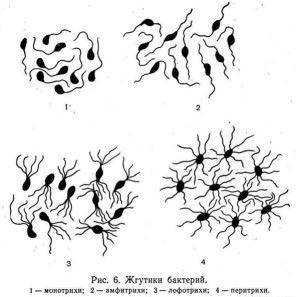
Значимым фактором идентификации бактерий является подвижность, которая обеспечивается жгутиками. Так как количество и расположение жгутиков, обеспечивающих подвижность, может быть различным, все имеющие жгутики микробы подразделяют для удобства идентификации на:
- монотрихи – один жгутик на полюсе;
- лофотрихи – пучок жгутиков, расположенный на одном из полюсов;
- амфитрихи – жгутики или пучки расположены на обоих полюсах;
- перитихи – жгутики расположены по периметру клетки.
Определение подвижности бактерий проводят в культурах не старше суток. У старых культур способность передвигаться утрачивается.
Исследование бактериального состава воды
Анализ воды проводят на наличие следующих групп микроорганизмов:
- колиформные микробы – микроорганизмы группы кишечной палочки, используются как маркеры фекальной контаминации (обсеменения);
- клостридии – микробы, обладающие высокой устойчивостью к обеззараживаннию; реперный показатель (ориентир) – если в пробе нет клостридий, то нет и других патогенных микробов;
- вирусы;
- лямблии.

Колиформные бактерии являются грамотрицательными бактериями группы кишечной палочки, обитающими в кишечнике млекопитающих и птиц. В воду они попадают с фекалиями, способны существовать в ней неделями, но теряют свойство размножения.
Колиформные микробы включают в себя группу термотолерантных колиформных микроорганизмов, обладающих свойством выживать при высоких (45°С) температурах. Термотолерантные колиформные бактерии являются индикатором недавнего фекального заражения, аналитически легко определяются.
Согласно СанПиН, колиформные бактерии не могут присутствовать в системах водоснабжения, а наличие колиформных микроорганизмов указывает либо на некачественную очистку, либо на вторичное фекальное загрязнение. Нормой считается наличие колиформных микробов в количестве не более 5% от общего числа. Критерием эффективности очистки от фекальных стоков являются термотолерантные колиформные бактерии, как легко определяемые.
Определение молочнокислых бактерий
Большое значение в пищевой промышленности уделяется молочнокислым микроорганизмам благодаря их антагонистической и протеолитеческой активности.
К примеру, пластичная консистенция и выраженный вкус различных сортов сыра связаны с протеолитической активностью молочнокислых микробов закваски. Исследованиям активностью молочнокислых бактерий в этой области уделяется большое значение, но, до сих пор не удалось создать критерий определения штаммов молочнокислых бактерий закваски по показателю протеолитеческой активности.
Антагонистическая активность молочнокислых микробов используется не только в пищевой промышленности, но и в медицине, ветеринарии сельском хозяйстве и т.д.
Примеры применения молочнокислых бактерий как антагонистов к определенным микроорганизмам:
- производство сыров – антагонисты к масляным микробам и кишечной палочке;
- хлебопекарное производство – антагонисты к споровой палочке, возбудителю «картофельной болезни» хлеба;
- молочнокислые продукты – антагонисты к бактериям, провоцирующим развитие желудочно-кишечных инфекций.
При необходимости подсчета в закваске количества молочнокислых бактерий используют метод посева микробов на агаре и молоке с добавлением мела. Образующаяся молочная кислота растворяет мел, и вокруг колоний молочнокислых бактерий появляются светлые зоны.
Для подсчета молочнокислых стрептококков используют метод предельного разведения, высевая их в молоко. В зависимости от термофильности молочнокислых бактерий выбирается оптимальный термальный режим посева. Образцы со свернувшимся молоком используют для приготовления микроскопических препаратов. После этого выявляют минимальное разведение, содержащее молочнокислые палочки.
Где и зачем искать?
Проверять пищу человека на содержание в ней разных видов микроорганизмов – общеизвестная задача микробиологических исследований на выявление штаммов бактерий с разной степенью вирулентности.
Однако ввиду стремительного развития биотехнологий, необходимость выявлять определенные виды микроорганизмов может возникать в самых разных отраслях жизнедеятельности человека:
- медицина и ветеринария;
- фармацевтика;
- пищевая промышленность;
- сельское хозяйство и переработка сельскохозяйственных продуктов;
- химическая промышленность.
Кроме того, выявление прокариотов с целью их изучения – одна из самых актуальных задач микробиологов, которые сегодня только начинают знакомиться с огромным разнообразием представителей безъядерной органики.
При работе с тем или иным биологическим материалом в микробиологических лабораториях используются несколько основных методов:
- микроскопия (световая, электронная);
- биологические методы (культивирование и идентификация организмов);
- молекулярно-генетический метод;
- серологический (выявление антигенов).
Эти основные методы позволяют не только обнаружить не видимые невооруженным глазом бактериальные клетки, а и изучить их структурные элементы и фазы жизнедеятельности.
Данные о структуре и жизненных процессах изучаемых бактерий позволяют идентифицировать выделенный биологический материал и соотнести его с теми видами прокариотов, которые уже описаны в микробиологической литературе или же зарегистрировать открытие новых видов безъядерных организмов.
Определение чувствительности бактериофагов
Бактериофаги являются естественными врагами бактерий. Характер взаимодействия бактериофага с бактериями описывается как:
- вирулентное, вызывающее лизис (гибель) микробной клетки;
- умеренное – переход бактерии в неинфекционную форму фага (профаг).
Бактериофаги специфичны к определенным группам микроорганизмов, что отражается в их названии – стрептококковые фаги, стафилококковые фаги и т.д. Способом определения количества бактериофагов в единице объема является метод агаровых слоев. Он прост в исполнении и обладает достаточной точностью.
Таким образом, существует большое количество методов определения микроорганизмов. Выбор оптимального зависит от заданного критерия отбора.
4.2 Метод НВЧ — определение количества колиформных бактерий
4.2.1 Три пробирки с жидкой обогатительной
средой двойной концентрации инокулируют определенным количеством продукта, если
исходный продукт жидкий, или определенным количеством исходной суспензии в
случае другого продукта.
4.2.2 Три пробирки с жидкой обогатительной средой нормальной
концентрации инокулируют определенным количеством продукта и/или разведением
продукта, если исходный продукт жидкий, или определенным количеством исходной
суспензии и/или разведением в случае другого продукта.
4.2.3 Посевы в пробирках, содержащие обогатительную среду
двойной концентрации, инкубируют при температуре 37 °С 24ч. Посевы в пробирках
со средой нормальной концентрации, инкубируют 24 или 48 ч, после этого в этих
пробирках отмечают наличие газа и/или помутнения, мешающего выявлению
образования газа.
4.2.4 Пробирки с подтверждающей средой
инокулируют культурами из пробирок с обогатительной селективной средой двойной
концентрации и культурами из пробирок с обогатительной селективной средой
нормальной концентрации, в которых отмечено образование газа и/или помутнение.
Посевы в пробирках с подтверждающей средой инкубируют при
температуре 37 °С 24 или 48 ч, после этого в пробирках отмечают образование
газа.
4.2.5 Наиболее вероятное число колиформных
бактерий в 1 см3 или 1 г пробы продукта (НВЧ) рассчитывают, исходя
из числа пробирок с подтверждающей средой (),
показавших образование газа. Для определения наиболее вероятного числа
пользуются таблицей ГОСТ
26670.
Процедура метода висячей капли
Подготовка к висячей капле
- Нанесите парафиновое кольцо или кольцо с липкой лентой на чистое предметное стекло, чтобы создать круглую вогнутость. (В этом шаге нет необходимости, если предметное стекло с углублением легкодоступно.)
- Держите чистое покровное стекло за края и зубочисткой нанесите вазелин на его углы.
- Поместите петлю тестируемой свежей бульонной культуры в середину подготовленного покровного стекла. Используйте мягкий инокулят (не явно мутный).
- Переверните подготовленное предметное стекло или предметное стекло с вогнутостью вверх дном (вогнутостью вниз) так, чтобы капля вазелина приклеила покровное стекло к предметному стеклу вокруг вогнутости.
- Переверните предметное стекло так, чтобы покровное стекло оказалось сверху, и подождите одну минуту, пока микроорганизмы не «осядут». Капля может быть видна подвешенной на покровном стекле над вогнутостью.
Процедура метода висячей капли
Микроскопическое наблюдение
Поместите образец в держатель предметного стекла микроскопа и сориентируйте его невооруженным глазом так, чтобы один край капли находился под объективами с малым увеличением.
Установите цель на самое низкое значение с помощью грубая регулировка, затем ЗАКРЫВАНИЕ ДИАФРАГМА.
Используя ручку грубой регулировки, постепенно поднимайте объектив, пока край капли не будет заметен в виде неровной линии, пересекающей поле зрения.
Переместите слайд так, чтобы эта линия (край капли) пересекала центр поля.
Не поднимая и не опуская трубку, установите высокий сухой объектив, повернув его на место (убедитесь, что высокий сухой объектив чистый).
Наблюдайте за слайдом через окуляр и регулируйте точная регулировка пока край капли не станет виден в виде толстой, часто темной линии.
Сосредоточьтесь на краю капли и осмотрите обе стороны этой линии на наличие очень маленьких предметов, содержащих бактерии. С очень маленькими палочками или сферами клетки будут либо темными, либо несколько голубовато-зелеными и будут состоять из крошечных структур
Помните, что увеличение сухого объектива с высокой линзой примерно вдвое меньше, чем у объектива с масляной иммерсией.
Используя рычаг диафрагмы, отрегулируйте свет, чтобы улучшить видимость клеток.
Наблюдайте за клетками, обращая внимание на их форму и группировку, и оцените, можно ли наблюдать подлинное движение.
На предметных стеклах всех организмов должно быть очевидно броуновское движение, но также должны быть признаки подлинной подвижности.
Подготовленное предметное стекло следует выбросить после промывки и замачивания в ведрах с лизолом, либо его необходимо выбросить.
Окраска спор
Определенные сложности связаны с выявлением таких кислотоустойчивых структур бактерий, как споры.
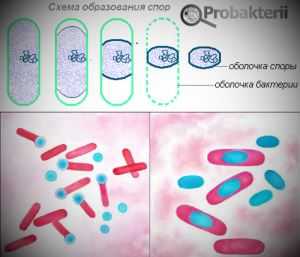
Однако выявление спор является важным моментом, поскольку спороносные бактерии чаще всего обладают высокой патогенностью. Кроме того, ввиду повышенной кислотоустойчивости, тепло- и светоустойчивости, споры очень сложно ликвидировать.
Для выявления спор были разработаны специальные протравы, которые разрыхляют кислотоустойчивую оболочку, что позволяет красителю проникнуть внутрь.
Окрашивание спор по методу Меллера:
- мазок помещают на две минуты в хлороформ;
- обрабатывают 5% водным раствором хромовой кислоты;
- промывают в воде и окрашивают карболовым фуксином.
- споры окрашиваются в красный цвет.
Есть еще несколько методов выявления таких клеточных структур, как споры, и все они предполагают первоначальное воздействие на устойчивую стенку споры.
Метод окраски по Бурри-Гинсу
Метод Бурри-Гинса используется для окраски капсульных бактерий и основан на том, что капсула не воспринимает красители. Капсулу выявляют негативным контрастированием фона по Бурри. Для этого черную тушь смешивают в культурой и высушивают. После этого проводят фиксацию в пламени горелки, окрашивают тела микробных клеток по Гинсу — водным фуксином в течение 1 минуты и промывают водой 5-10 секунд.
NB! В результате на темном фоне хорошо видна бесцветная капсула и красные тела микробов.
Klebsiella pneumonia. Мазок из чистой культуры. Окраска по Бурри-Гинсу.
На середину предметного стекла наносят каплю черной туши и смешивают ее с помощью петли с каплей культуры капсульных бактерий.
Краем другого предметного стекла делают мазок по типу кровяного. Мазок сушат на воздухе и фиксируют в пламени горелки.
Окрашивают 5 мин карболовым фуксином, разведенным водой 1:3.
Осторожно промывают водой, высушивают. Окраска по Гинесу-Бурри
Метод выявления капсулы по Бурри-Гинса. Для обнаружения КАПСУЛ бактерий, плохо воспринимающих красители, используют метод БУРРИ–ГИНСА: в каплю туши, разведенной в 10 раз водой, вносят исследуемые бактерии и равномерно распределяют их петлей по предметному стеклу; мазок высушивают, фиксируют (наносят 2–3 капли спирта и сжигают его на стекле), окрашивают в течение 3–5 мин фуксином Пфейффера, промывают водой, высушивают; на темном фоне препарата капсулы видны в виде светлых ореолов вокруг красных бактерий
Окраска по Гинесу-Бурри. Метод выявления капсулы по Бурри-Гинса. Для обнаружения КАПСУЛ бактерий, плохо воспринимающих красители, используют метод БУРРИ–ГИНСА: в каплю туши, разведенной в 10 раз водой, вносят исследуемые бактерии и равномерно распределяют их петлей по предметному стеклу; мазок высушивают, фиксируют (наносят 2–3 капли спирта и сжигают его на стекле), окрашивают в течение 3–5 мин фуксином Пфейффера, промывают водой, высушивают; на темном фоне препарата капсулы видны в виде светлых ореолов вокруг красных бактерий.
18. Морфология кокков и заболевания, вызываемые ими. Кокки (гр. coccus — ягода, лат. coccus — шаровидный). Кокки бывают сферические, эллипсоидные, бобовидные и ланцетовидные. После деления кокки по-разному располагаются относительно друг друга, что послужило основанием подразделить их на отдельные группы.
Микрококки (гр. micrococcus — малый) — беспорядочно расположенные одиночные или парные клетки. В основном заселяют объекты внешней среды, являются сапрофитами. Заболевания не вызывают, (грам+,грам-)
Диплококки (гр. diplococcus — двойной) — попарно расположенные клетки как результат деления в одной плоскости и сохранение связи между дочерними клетками. К ним относятся возбудитель диплококковой септицемии телят, менингококк.
А) в виде пламени свечи (грам+) пневмококки б) в виде кофейных зерен (грам-) гонорея, менингит Стрептококки (гр. streptococcus — извитой) — клетки, расположенные в виде цепочек различной длины. Результат деления кокков в одной плоскости. Стрептококки вызывают мастит сельскохозяйственных животных, мыт цельнокопытных и др.
А)условнопатогенные , тонзиллит ,гайморит,отит б) патогенные, рожистые воспаления, скарлатинез
Тетракокки (гр. tetracoccus — четыре кокка) — сцепленные по четыре кокка как результат последовательного деления клеток в двух взаимно-перпендикулярных плоскостях. К патологии животныхотношения не имеют., сапрофиты
Сарцины (лат. sarcina — связываю, соединяю) — кокки, расположенные ярусами по 8—16 особей как результат последовательного деления клеток в трех взаимно-перпендикулярных плоскостях. Напоминают тюки, пакеты.заболевания не вызывают.
Стафилококки (гр. staphylococcus — виноградная гроздь). Гроздьевидные скопления кокков как результат деления кокков в различных плоскостях. Некоторые стафилококки причиняют существенный урон животноводству, вызывая септические состояния, поражения молочной железы, желудочно-кишечного тракта, кожного покрова. стафилококкус ауреус-внтрибольничные инфекции, пищ.отравл, забол.жкт
5 Методы определения количества колиформных бактерий — подсчет колоний
Сущность методов
Методы определения количества колиформных бактерий посевом вили на агаризованные селективно-диагностические среды основаны на высеве
определенного количества продукта и/или его разведений в или на
агаризованную селективно-диагностическую среду с лактозой, инкубировании
посевов, подсчете типичных и атипичных колоний, пересеве типичных колоний и
атипичных колоний в жидкую селективную среду с лактозой для определения
газообразования, подтверждения, при необходимости, по биохимическим
признакам принадлежности выделенных колоний к колиформным бактериям.
FAQ
Что такое метод висячей капли? или Что такое испытание на падение в подвешенном состоянии?
Техника висячей капли долгое время была стандартом в микробиологии благодаря ее способности удерживать средние капли на месте с минимальными потерями из-за испарения и без загрязнения близлежащими каплями. В начале 1900-х годов он был впервые произведен и использован для выращивания нервной ткани в лаборатории.Тест на висящую каплю кала проводится для визуализации подвижности или модели движения микроорганизмов в образце стула и идентификации их на основе этих моделей, чтобы помочь в диагностике состояния, вызванного этими микробами. Тест в основном используется для диагностики холеры.
Как классифицировать бактерии методом висячей капли?
Подвижность бактерий можно увидеть с помощью масляной иммерсионной линзы при 100-кратном увеличении, поместив небольшую каплю бактерий на покровное стекло и подвесив ее в полости предметного стекла.
Кто ввел метод висячей капли для исследования подвижности?
Метод микроскопического исследования организмов, взвешенных в капле на специальном вогнутом предметном стекле. Метод был изобретен Робертом Кохом в 1878 году.
В чем разница между мокрым креплением и висячим падением?
Влажный препарат имеет тенденцию быстро высыхать под воздействием тепла света микроскопа; выполнить его проще, чем сухое крепление, но подходит только для краткосрочного наблюдения. Висячая капля — более сложный подход, но он обеспечивает более длительное наблюдение и более надежное наблюдение за моторикой.
Для чего проводится тест на подвешивание кала?
Этот тест проводится на фекалиях для определения диапазона движения бактерий и других организмов. Его проводят для выявления инфекции Pseudomonas и отслеживания терапии инфекции.
Каковы преимущества и недостатки подготовки висячей капли?
Преимущества: Как и в случае влажного препарата, метод висячей капли сохраняет форму и расположение клеток. Запечатанное вазелином углубление также замедляет процесс высыхания, позволяя наблюдать организмы дольше. Недостатки бонуса без депозита: Метод висячей капли также недостаточно безопасен для использования с высокопатогенными микроорганизмами.
Что такое подвесная горка?
Висячее предметное стекло — это микроскопический препарат, используемый для наблюдения за движением бактерий. Каплю бактериальной культуры помещают на покровное стекло во влажном препарате.
Микроигра
Попробуйте расшифровать четыре слова, связанных с микробиологией, прослеживая движение бактерий к еде.
Каждая бактерия начинает двигаться от буквы, на которую указывает исходящая от бактерии стрелка. Затем бактерия меняет направление движения, согласно маленькой черной стрелочке у буквы. Если бактерия приближается к еде (красная точка), то она проплывает три клеточки (по горизонтали, вертикали или диагонали напрямую), снова поворачивает согласно направлению стрелки на этой клеточке и так далее. Если бактерия плывет в противоположную от еды сторону, она сдвигается только на одну клеточку. Если движение скорее нейтрально, то бактерия проплывает две клеточки.
Все ли из найденных слов вам знакомы?
Изучение морфологии и подвижности
Морфологическое исследование в основном направлено на идентификацию бактерий.
Изучение форм и выявление подвижности проводится методом микроскопирования живых бактерий.
Основные структуры микроорганизма анализируются в препаратах раздавленной или висячей капли. Это способ нанесения бульонного раствора с бактериальной культурой на предметное стекло.
Этот метод определения строения бактерии может проводиться путем наблюдений в «темном поле зрения».

Анализ с использованием различных способов окрашивания предполагает, что окрашиваться будут убитые микробные клетки, поскольку они лучше окрашиваются.
Для проведения анализа необходимо осуществить несколько манипуляций:
- Приготовить мазок исследуемого материала. В эту стадию входит работа с исследуемым материалом (кровь, мокрота и т.д.).
- Высушивание и фиксация мазка химическим или физическим способом.
- Выбор вида окрашивания (сложный или простой).
Простым способом бактериальные клетки окрашивают в большинстве случаев только для того, чтобы выявить в исследуемом материале присутствие микроорганизмов. Этот способ представляет собой окрашивание мазка метиленовым синим. Данный краситель окрашивает фон мазка на порядок слабее, чем клетки самих микроорганизмов.
Обнаружение основных структур бактериальной клетки осуществляется с использованием сложного окрашивания:
- метод Грама (определение свойств клеточной стенки);
- окраска на выявление спор;
- окраска по Романовскому-Гимзе окрашивает в разные цвета основные структуры клетки;
- выявление капсул по способу Гинса;
- выявление зерен волютина (внутриплазматические гранулы, состоящие из неорганических полифосфатов), их присутствие указывает на наличие возбудителя дифтерии.

Определение качественного бактериального состава
Определение качественного состава бактерий опирается на несколько факторов.
Изучение биохимических свойств микроорганизмов помогает определению качественного состава бактерий.
Идентификации микроорганизмов способствует знание биохимических процессов. Методы определения количества и качества бактерий опираются на протеолитические и сахаролитические свойства микроорганизмов, а также токсино- и пигментообразование.
Ферменты микробов
Одним из факторов жизнедеятельности бактерий является ферментативная активность: ферментный состав и свойства регламентируются геномом микроорганизма и является стабильным критерием идентификации микробов. Поэтому обнаружение протеолитических, сахаролитических и других ферментов имеет большое значение в идентификации микроорганизмов.
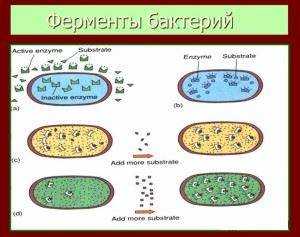
К примеру, критерием протеолитической активности микроорганизмов является способность бактерий расщеплять белок до продуктов глубокого распада (сероводород и индол)
На этом результате ферментативной активности основан метод определения числа микроорганизмов, имеющий важное практическое значение
Свойство пигментообразования
Другим стойким генетическим признаком бактерий является пигментообразование. Данное свойство предназначено для защиты бактериальной клетки от воздействия ультрафиолетовых лучей.
Большая часть патогенных микроорганизмов не обладает подобными защитными свойствами – пигментообразование для них не характерно.
Оборудование микробиологической лаборатории
Возможность применять методы выявления клеток бактерий может присутствовать только в рамках организации бактериологической лаборатории. Это специально оборудованные комплексы, которые функционируют:
- при поликлиниках и диспансерах;
- при санитарно-эпидемиологических станциях или их подразделениях;
- при научно-исследовательских центрах;
- при предприятиях по выпуску биопрепаратов.
Практически все перечисленные лаборатории работают с прокариотами низкой и средней степени вирулентности (опасности для человека). Опасные бактерии можно исследовать только в специализированных лабораториях.
Основу лаборатории составляют:
- термостат для регулировки и поддержания стабильных температурных режимов;
- микроанаэростат для поддержания анаэробной среды;
- холодильник для хранения сред, проб и микроорганизмов;
- центрифуги для осаждения исследуемого материала со стенок пробирок;
- печь Пастера для воздушной стерилизации лабораторных приборов;
- автоклав для стерилизации под давлением.

Кроме перечисленных аппаратов, лаборатория также оснащена микроскопами, планшетами, дозирующими приборами, наконечниками и бактериологическими анализаторами в зависимости от специфики лаборатории.
Изображения методом висячей капли
Первичные овечьи гепатоциты культивировали в висячих каплях при 200-кратном увеличении. Первичные гепатоциты овцы образовывали сфероиды в висящих каплях с Hepatozyme-SFM (HDH) и средой William’s E (HDW) на пятый день, и эти сфероиды сохранялись до десятого дня. | Источник изображения: https://www.nature.com/articles/s41598-017-01355-6/figures/1Первичные гепатоциты буйвола, культивированные в висячих каплях при 200-кратном увеличении. Первичные гепатоциты буйвола образовывали сфероиды в висящих каплях с Hepatozyme-SFM (HDH) и средой William’s E (HDW) на третий день, и они сохранялись до шестого дня. | https://www.nature.com/articles/s41598-017-01355-6/figures/2






























