Генетические карты хромосом
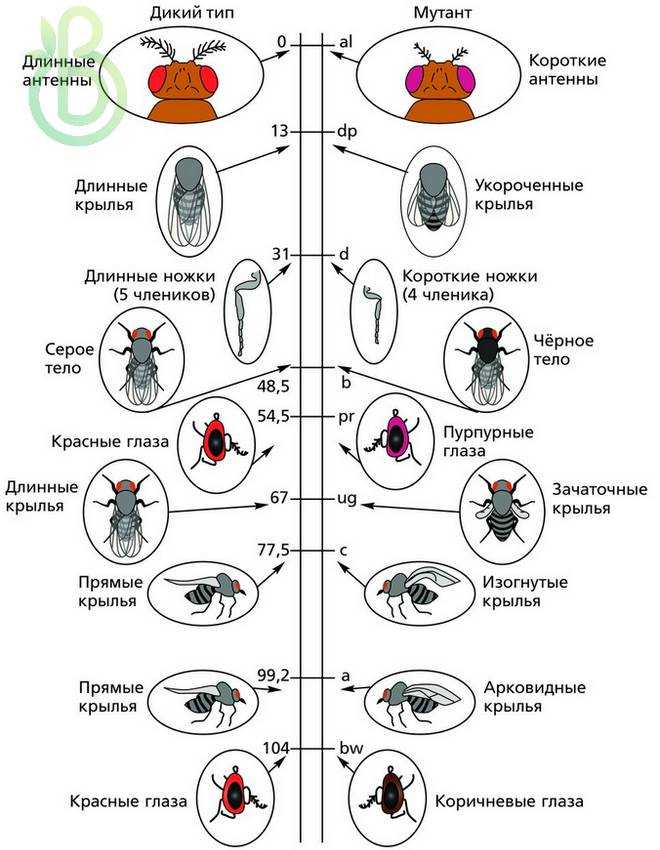
Генетические карты хромосом дрозофилы. Цифры указывают расстояние между генами и одним из концов хромосомы (в единицах перекреста)
Знание частоты рекомбинаций дает возможность составлять карты относительного расположения генов в хромосомах. На генетических картах гены расположены линейно один за другим на определенном расстоянии, которое определяется в процентах кроссинговера (частота рекомбинаций) или в морганидах (1 % кроссинговера равен одной морганиде). Чтобы построить генетическую карту растений или животных, проводят анализирующее скрещивание, где достаточно подсчитать процент особей, которые образовались вследствие кроссинговера. Необходимо также определить число групп сцепления и принадлежность генов к ним.
Например, частота рекомбинаций между генами равна: А и В – 8%, В и С – 6%. Этих данных недостаточно для составления карты, так как возможны варианты.
Необходимо знать расстояние между генами А и С.
Для человека невозможно применение метода скрещивания (гибридологического), поэтому его заменили методом анализа родословных.
Генетическая карта хромосом – это схема относительного размещения генов в одной хромосоме, которые принадлежат к одной группе сцепления.
Первые генетические карты были составлены для дрозофил, а потом и для других объектов.
Генетические карты составляют для каждой пары гомологичных хромосом. Каждая группа сцепления имеет свой порядковый номер (римскими цифрами) в зависимости от порядка открытия. Кроме номера в каждой группе сцепления указывается полное или сокращенное название генов, расстояние каждого гена в единицах кроссинговера от одного из концов хромосомы, место нахождения центромеры.
В 1930 году был разработан новый способ картирования хромосом, основанный на наличии в слюнных железах насекомых больших хромосом – политенных, имеющих хроматин в виде чередования темных и светлых дисков при окраске, которые видно даже при небольшом увеличении микроскопа. При выявлении дефектов в темных хроматиновых дисках сравнивали их с изменениями соответственно локализованных генов. Такие карты стали называть хромосомными (цитологическими). Генетические карты сравнивают с цитологическими. Цитологические карты хромосом определяют хромосому как физическое тело. Порядок генов в этих картах идентичен генетическим. Таким образом, генетические карты указывают на реальный порядок генов в хромосоме. Расстояние между генами на генетической карте приблизительно, так как нет соответствия возле центромеры – на генетической карте гены расположены плотнее, чем на хромосомной. Это связано со сниженной частотой кроссинговера возле центромеры. В других участках хромосомы наблюдается соответствие.
При картировании генов человека, кроме анализа родословных, используют другие методы. Одним из них является метод гибридизации соматических клеток грызунов и человека в культуре ткани. В гибридных клетках при размножении теряются одна или несколько хромосом изучаемого вида. После анализа большого количества клонов клеток отбирают 20-30, которые отличаются по набору хромосом. Если у всех клонов отсутствует хромосома и отсутствует изучаемый белок, а у других клонов есть белок и хромосома, делают вывод: синтез этого белка связан с этой хромосомой. Использование этого метода позволило за короткий срок составить генетические карты человека и животных.
Благодаря успехам в молекулярной генетике используют еще один метод картирования генов. ДНК гена выделяют с применением методов генной инженерии. Наносят раствор этих генов с меченной (радиоактивной или флуоресцентной) последовательностью ДНК на митотические хромосомы. Эти участки ДНК включаются в хромосомах на «свое» место, которое можно определить.
В 2003 году была выполнена программа «Геном человека» (запланированная ООН): расшифрован геном человека, изучены все 24 группы сцепления.
Для составления генетических карт прокариот используют другие методы, которые связаны с особенностями их строения. Прокариоты – гаплоидные организмы. Составление генетических карт прокариот строится на существовании особого процесса у бактерий – конъюгации.
Важность составления генетических карт заключается в использовании их в селекции растений, животных и микроорганизмов. Генетические карты человека могут быть полезными в развитии медицины и здравоохранения для диагностики, предотвращения и лечения трудных наследственных заболеваний
Метод
Существует несколько теорий о том, как происходит митотический кроссовер. В модели простого кроссовера две гомологичные хромосомы перекрываются на общем или близком к нему участке. Хромосомный хрупкий сайт (CFS). Это приводит к двухниточный разрыв, который затем ремонтируется с помощью одной из двух нитей. Это может привести к смене местами двух хроматид. В другой модели два перекрывающихся сестринские хроматиды образуют двойное соединение Холлидея на общем месте повтора, а затем срезаются таким образом, что меняются местами. В любой модели не гарантируется, что хромосомы обмениваются равномерно или даже воссоединяются на противоположных сторонах, поэтому большинство моделей расщепления не приводят к какому-либо событию кроссовера. Неравномерная торговля приводит ко многим пагубным последствиям митотического кроссовера.
Альтернативно, кроссовер может происходить во время репарации ДНК. если из-за обширного повреждения гомологичная хромосома выбрана в качестве матрицы над сестринской хроматидой. Это ведет к синтез генов поскольку одна копия аллеля копируется поперек гомологичной хромосомы и затем синтезируется в брешь на поврежденной хромосоме. Чистый эффект от этого будет один гетерозиготный хромосома и один гомозиготный хромосома.
Негомологичный кроссовер
Кроссоверы обычно происходят между гомологичными областями совпадающих хромосом , но сходство в последовательности и других факторах может привести к несовпадающим выравниваниям. Большая часть ДНК состоит из последовательностей пар оснований , повторяющихся очень большое количество раз. Эти повторяющиеся сегменты, часто называемые спутниками, довольно однородны среди видов. Во время репликации ДНК каждая цепь ДНК используется в качестве матрицы для создания новых цепей с использованием частично консервативного механизма; В результате правильного функционирования этого процесса образуются две идентичные парные хромосомы, часто называемые сестрами. События кроссовера сестринских хроматид, как известно, происходят со скоростью нескольких событий кроссовера на клетку на деление у эукариот. Большинство этих событий включают обмен равными объемами генетической информации, но могут происходить неравные обмены из-за несоответствия последовательностей. Они упоминаются под разными названиями, включая негомологичный кроссовер, неравный кроссовер и несбалансированную рекомбинацию, и приводят к вставке или удалению генетической информации в хромосоме. Хотя эти мутации редки по сравнению с случаями гомологичного кроссовера, они радикальны, затрагивая множество локусов одновременно. Они считаются основной движущей силой генерации дупликаций генов и являются основным источником мутаций в геноме .
Конкретные причины негомологичных кроссоверов неизвестны, но известно несколько влияющих факторов, увеличивающих вероятность неравного кроссовера. Одним из распространенных векторов, ведущих к несбалансированной рекомбинации, является репарация двухцепочечных разрывов (DSB). DSB часто восстанавливают с использованием гомологически направленной репарации, процесса, который включает в себя вторжение цепи-шаблона цепью DSB (см. Рисунок ниже). Соседние гомологичные области матричной цепи часто используются для репарации, что может привести к вставкам или делециям в геноме, если используется негомологичная, но комплементарная часть матричной цепи. Сходство последовательностей играет важную роль в кроссовере — события кроссовера с большей вероятностью происходят в длинных областях близкой идентичности гена. Это означает, что любой участок генома с длинными участками повторяющейся ДНК подвержен событиям кроссовера.
Наличие сменных элементов — еще один важный элемент негомологичного кроссовера. Повторяющиеся участки кода характеризуют сменные элементы; комплементарные, но негомологичные регионы повсеместно встречаются в транспозонах. Поскольку хромосомные области, состоящие из транспозонов, имеют большое количество идентичного повторяющегося кода в конденсированном пространстве, считается, что области транспозонов, подвергающиеся перекрестному событию, более склонны к ошибочному дополнительному совпадению; то есть участок хромосомы, содержащий множество идентичных последовательностей, если он подвергнется перекрестному событию, менее уверен в совпадении с идеально гомологичным участком дополнительного кода и более склонен к связыванию с участком кода на немного другая часть хромосомы. Это приводит к несбалансированной рекомбинации, поскольку генетическая информация может быть вставлена или удалена в новую хромосому, в зависимости от того, где произошла рекомбинация.
Хотя мотивирующие факторы, лежащие в основе неравной рекомбинации, остаются неясными, элементы физического механизма были выяснены. Белки репарации ошибочного спаривания (MMR), например, представляют собой хорошо известное регуляторное семейство белков, отвечающее за регулирование несовпадающих последовательностей ДНК во время репликации и регуляции ускользания. Оперативная цель MMR — восстановление родительского генотипа. В частности, один класс MMR, MutSβ, как известно, инициирует коррекцию несовпадений вставок-делеций длиной до 16 нуклеотидов. Мало что известно о процессе вырезания у эукариот, но при удалении E. coli происходит расщепление разрыва на 5 ‘или 3’ цепи, после чего ДНК-геликаза и ДНК-полимераза III связываются и образуют одноцепочечные белки, которые перевариваются. с помощью экзонуклеазы и прикрепляется к цепи с помощью лигазы . Множественные пути MMR вовлечены в поддержание стабильности сложного генома организма, и любая из многих возможных неисправностей в пути MMR приводит к ошибкам редактирования и исправления ДНК. Следовательно, хотя точно не известно, какие механизмы приводят к ошибкам негомологичного кроссовера, весьма вероятно, что задействован путь MMR.
Митохондриальный геном
|
митохондриальный геном Кольцевая двунитевая молекула ДНК, входящая в состав митохондрий (размер мтДНК у животных обычно около 16 тыс. пар оснований, а в различных группах растений и микроорганизмов эта величина существенно больше и высокоизменчива); М.г. включает гены тРНК и рРНК, некоторых ферментов (субъединицы АТФазы, цитохромоксидазы и др.), в нем имеются некоторые отклонения от универсального триплетного кода (например, триплет УГА, являющийся стоп-кодоном в ядерном геноме, в М.г. животных кодирует триптофан); как правило, М.г. наследуется по материнскому типу; анализ структуры мтДНК с использованием рестриктаз endonucleases широко применяется в популяционно-генетических исследованиях. |
Определение генетической рекомбинации
Генетическая рекомбинация происходит, когда генетический материал обменивается между двумя разными хромосомами или между разными областями в пределах одного и того же хромосома, Мы можем наблюдать это как у эукариот (таких как животные и растения), так и у прокариот (таких как археи и бактерии ). Имейте в виду, что в большинстве случаев для того, чтобы произошел обмен, последовательности, содержащие измененные области, должны быть гомологичны или аналогичные, в некоторой степени.
Процесс происходит естественным путем и может также проводиться в лаборатории. Рекомбинация увеличивает генетическое разнообразие в сексуально размножающихся организмах и может позволить организм функционировать по-новому.
Типы генетической рекомбинации
Ученые наблюдали следующие виды рекомбинации в природе:
Митотическая рекомбинация: это на самом деле не происходит во время митоза, но во время интерфаза, который является фазой покоя между митотическими отделами. Процесс аналогичен таковому при мейотической рекомбинации и имеет свои возможные преимущества, но обычно он вреден и может привести к опухолям. Этот тип рекомбинации усиливается, когда клетки подвергаются облучению.
Прокариотические клетки могут подвергаться рекомбинации через один из этих трех процессов:
Трансдукция – это перенос гена, опосредованный вирусами. Вирусы, называемые бактериофагами, атакуют бактерии и переносят гены от одной бактерии к другой.
- Ген – последовательность нуклеотидов на хромосоме. Гены передаются от родителей к потомству и являются определяющими факторами организма.
- геном – Полный набор генов, который принадлежит организму или клетке. Каждая клетка человека, содержащая ядро, имеет копию всего генома человека.
- гомология – Сходство структуры, происхождения или положения двух или более структур независимо от их функций.
- Мейоз – процесс деления клеток, который приводит к дочерние клетки содержащий половину количества хромосом, которые содержались в родительских клетках.
Объекты исследования и условия проведения опытов
Объектом исследований послужила Drosophila melanogaster — известный издавна объект генетики. Изученность генетических и цитологических карт хромосом дрозофилы, генетического контроля большинства процессов развития, реакций клеток и организма на воздействия средовых факторов, малые размеры, позволяющие осуществлять тотальное облучение, короткий цикл развития, плодовитость, возможность базироваться на больших объемах репрезентативных выборок, относительная легкость в содержании в лабораторных условиях, удобство проведения экспериментов позволяют назвать данный объект перспективным для радиобиологических исследований современного этапа развития науки.
В ходе исследований использовали пять чистых линий D.melanogaster гомозиготных по рецессивным генам yf, yet, f, waf и Дз2. Домодедовская 32 — низкомута-бильная линия «дикого» типа (норма), фенотипически отличающаяся серой окраской тела, красного цвета глазами, нормальными по форме крыльями. Остальные линии представляют собой гетеро- или дигетерозиготы по мутантным генам специально выведенные в лаборатории с целью маркировки различных участков X -хромосомы и возможности последующей идентификации районов образования хиазм.
В ходе изучения влияния ИК НИЛИ на различные признаки Dr. melanogaster формировали экспериментальные группы из 2-х — 3-х суточных самок и самцов, полученных по (Мыльников СВ., 1991). Трех суточные самки способны откладывать максимальное количество яиц (Ватта К.В., Тихомиров М.М., 1979). Проводили массовые скрещивания 5 самок : 5 самцов с использованием особей различных генетических конфигураций с целью создания генетической гетерогенности в тканях, что в случае прохождения соматической рекомбинации позволит установить частоту кроссинговера по визуально наблюдаемым одиночным и двойным пятнам на теле дрозофилы с проявлением определенных генов или их групп в гомозиготе. Предварительно либо самок, либо самцов, либо обоих родителей подвергали лазерному воздействию. Варьирование пола облучаемых особей позволяет оценить не только лазерочувствительность половых клеток разной природы, но и роль цитоплазмы в передаче и усилении первоначального сигнала воздействия.
Скрещивания проводили в двух направлениях: самок определенной чистой линии скрещивали с самцами, несущими данные гены в доминантной форме, а несколько других в рецессивной (табл.1). В дальнейшем использовали реципрокные скрещивания с теми же маркерами. Во всех типах скрещивания оставляли контрольную группу, которая не подвергалась лазерным воздействиям. Все группы формировались из пяти повторностей. Продолжительность размножения родительских форм составляла 12 суток. Через четверо суток (в дальнейшем обозначено как I этап исследований), родительских особей пересаживали на свежую питательную среду еще на четверо суток (II этап) и по истечении следующих четверо суток (III этап исследований) устраняли из эксперимента.
Для получения массовых кратковременных яйцекладок в ходе эксперимента нами выполнялся ряд условий:
1. замена питательной среды в ходе кладки, что является стимулирующим фактором (Ватта К.В., Тихомиров М.М., 1979);
2. использовалась среда с хорошо проросшими дрожжами, то — есть спустя 1 — 2 суток после приготовления (Медведев Н.Н., 1968);
3. поверхность среды была достаточно влажной, что обеспечивало высокую насыщенность воздуха и стимулировало откладку яиц;
4. чтобы яйца распределялись равномерно по поверхности, и была гарантия хорошей интенсивности яйцекладки, поверхность среды делали шероховатой (при помощи кисточки);
5. при пересадке самок на новую питательную среду не допускались всякого рода сотрясения, толчки или вибрации пробирок, в которых находились D.melanogaster, так как потревоженные самки задерживают откладку уже оплодотворенных яиц и начальные этапы эмбриогенеза проходят внутриутробно, кладка десинхронизируется (Проблемы генетики в исследованиях на дрозофиле, 1977).
В случае облучения личинок, для синхронизации материала использовали кратковременные (4 часа) яйцекладки. Через 96 часов после завершения откладки яиц личинок подвергала облучению.
Индивидуальное развитие особей, включенных в скрещивания, проходило на стандартной питательной среде (Медведев Н.Н., 1968) с использованием следующих мер продуктов: вода дистиллированная — 500 мл, изюм — 20 г, манная крупа -22,5 г, агар — агар (вымороженный) — 4,5 г, дрожжи (сырая масса) — 40 г, пропионо-вая кислота — 2 мл. Показатель рН среды соответствовал 6,50±0,55, а ее влажность 75%. При помощи 5 мл шприца питательная среда ровным слоем помешалась на дно стеклянных пробирок слоем 1,5-2 см.
Мишурная токопроводящая жила
|
мишурная токопроводящая жила токопроводящая жила, состоящая из одного или нескольких элементов, скрученных вместе, каждый элемент состоит из одной или нескольких тонких металлических лент, наложенных по спирали и поддерживаемых текстильной нитью EN tinsel conductor conductor comprising one or more elements stranded together, each element consisting of one or more thin metal tapes helically wound on, and supported by a textile thread FR fil rosette âme formée d’un ou plusieurs éléments câblés ensemble, chaque élément étant constitué d’un ou de plusieurs rubans métalliques minces enroulés en hélice sur un fil textile qui le supporte |
Примечания
- ↑ Hartel, Daniel L. and Maryellen Ruvolo. Genetics: Analysis of Genetics and Genomes (англ.). — Burlington: Jones & Bartlett (англ.) (рус., 2012.
- ↑ Tischfield, Jay A. Loss of Heterozygosity, or: How I learned to Stop Worrying and Love Mitotic Recombination (англ.) // American Journal of Human Genetics (англ.) (рус. : journal. — 1997. — November (vol. 61, no. 5). — P. 995—999.
- Stern, Curt. Somatic Crossing Over and Segregation in Drosophila Melanogaster (англ.) // Genetics : journal. — 1936. — Vol. 21, no. 6. — P. 625—730.
- Инге-Вечтомов С.Г. Генетика с основами селекции: учебник для студентов высших учебных заведений / С. Г. Инге-Вечтомов. — СПб.: Изд-во Н-Л, 2010. — С. 193—194. — 720 с. — ISBN 978-5-94869-105-3.
- Esposito, Michael S. Evidence that Spontaneous Mitotic Recombination Occurs at the Two-Strand Stage (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1978. — September (vol. 75, no. 9). — P. 4436—4440.
- ↑
- Helleday, Thomas. Pathways for Mitotic Homologous Recombination in Mammalian Cells (англ.) // Mutation Research (англ.) (рус. : journal. — Elsevier, 2003. — Vol. 532, no. 1—2. — P. 103—115.
- Pâques, Frédéric; James E. Haber. Multiple Pathways of Recombination Induced by Double-Strand Breaks in Saccharomyces cerevisiae (англ.) // Microbiology and Molecular Biology Reviews (англ.) (рус. : journal. — American Society for Microbiology (англ.) (рус., 1999. — Vol. 63, no. 2. — P. 349—404.
- Helleday, T. . Animation. MIT. Дата обращения: 1 марта 2013.
- Luo, Guangbin; et al. Cancer predisposition caused by elevated mitotic recombination in Bloom mice (англ.) // Nature Genetics : journal. — 2000. — Vol. 26. — P. 424—429.
- Xu, T; GM Rubin. Analysis of genetic mosaics in developing and adult Drosophila tissues (англ.) // Development : journal. — 1993. — April (vol. 117, no. 4). — P. 1223—12237.
Химия
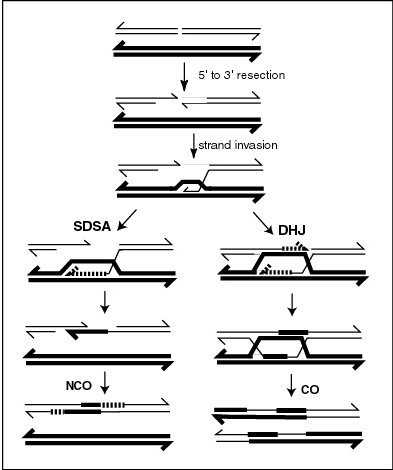
Современная модель мейотической рекомбинации, инициированной двухцепочечным разрывом или разрывом, с последующим спариванием с гомологичной хромосомой и инвазией цепи, чтобы инициировать процесс рекомбинационной репарации. Ремонт разрыва может привести к кроссоверу (CO) или непересечению (NCO) фланкирующих областей. Предполагается, что рекомбинация CO происходит в рамках модели двойного холлидейского соединения (DHJ), показанной справа выше. Считается, что рекомбинанты NCO возникают в основном в рамках модели отжига зависимых цепей от синтеза (SDSA), показанной слева выше. Большинство событий рекомбинации относятся к типу SDSA.
Мейотическая рекомбинация может быть инициирована двухцепочечными разрывами, которые вводятся в ДНК при воздействии повреждающих агентов ДНК или белка Spo11 . Затем одна или несколько экзонуклеаз переваривают 5′-концы, образованные двухцепочечными разрывами, с образованием 3′-концевых одноцепочечных ДНК (см. Диаграмму). Специфическая для мейоза рекомбиназа Dmc1 и общая рекомбиназа Rad51 покрывают одноцепочечную ДНК с образованием нуклеопротеиновых филаментов. Рекомбиназы катализируют вторжение противоположной хроматиды однонитевой ДНК с одного конца разрыва. Затем 3′-конец вторгающейся ДНК инициирует синтез ДНК, вызывая смещение комплементарной цепи, которая впоследствии отжигается с одноцепочечной ДНК, генерируемой на другом конце исходного двухцепочечного разрыва. Возникающая в результате структура представляет собой обмен поперечными цепями , также известный как соединение Холлидея . Контакт между двумя хроматидами, который вскоре подвергнется кроссинговеру, известен как хиазма . Соединение Холлидея представляет собой тетраэдрическую структуру, которую могут «тянуть» другие рекомбиназы, перемещая ее по четырехцепочечной структуре.
MSH4 и MSH5
Белки MSH4 и MSH5 образуют гетероолигомерную структуру ( гетеродимер ) у дрожжей и человека. В дрожжах Saccharomyces cerevisiae MSH4 и MSH5 действуют специфически, способствуя кроссоверам между гомологичными хромосомами во время мейоза . Комплекс MSH4 / MSH5 связывает и стабилизирует двойные соединения Холлидея и способствует их разделению в продукты кроссовера. (частично функциональный) мутант S. cerevisiae MSH4 показал 30% -ное снижение числа кроссоверов по всему геному и большое количество мейозов с необменными хромосомами. Тем не менее, этот мутант привел к паттернам жизнеспособности спор, предполагающим, что сегрегация необменных хромосом происходит эффективно. Таким образом, у S. cerevisiae собственно сегрегация, по-видимому, не полностью зависит от кроссоверов между гомологичными парами.
Хиазма
Кузнечик Melanoplus femur-rubrum подвергался воздействию острой дозы рентгеновских лучей на каждой отдельной стадии мейоза , и измерялась частота хиазм . Облучение в течение leptotene — стадий мейоза (то есть, до периода , в котором происходит кроссовер рекомбинация) было обнаружено увеличение частоты последующего хиазма. Точно так же у кузнечика Chorthippus brunneus воздействие рентгеновского излучения на стадии зиготена-ранняя пахитена вызывало значительное увеличение средней частоты клеточных хиазм. Частоту хиазм оценивали на более поздних стадиях мейоза. Эти результаты предполагают, что рентгеновские лучи вызывают повреждения ДНК, которые восстанавливаются перекрестным путем, ведущим к образованию хиазмы.
Модификация частоты митотической рекомбинации при воздействии НИЛИ на имаго различных генотипов
Одним из параметров исследуемых в данной работе была частота митотической рекомбинации между гомологичными районами X — хромосом, которая могла произойти либо в дробящихся ядрах эмбриона D.melanogaster, либо в ходе более поздних митозов, направленных на формирование различных органов imago.
Основная трудность в рассмотрении данного вопроса заключалась в том, что механизмы митотической рекомбинации на данный момент времени еще мало изучены и основные серии доступных для рассмотрения работ приходились на 1965-, 1980 годы (Тупицына Б.М., 1965; Абелева Э.А., Мяснянкина Е.Н., 1971, 1976). В связи с этим требовалось более детальное рассмотрение полученных экспериментальных данных. Результаты митотической рекомбинации выявлялись опосредованным визуальным способом. Величина клона рекомбинантных клеток определялась по зонам расположения механосенсорных органов — макрохет, являющихся систематическим признаком. Всего у D.melanogaster имеется 25 пар макрохет, из которых 9 пар располагаются на голове и 16 пар — на груди мухи (Фриц-Ниггли X., 1961; Медведев Н.Н., 1966). Среди макрохет различают: верхние и нижние гуморальные, передние и задние нотоплевральные, презутуральные, передние и задние супраалярные, передние и задние посталярные и, наконец, передние и задние дор-зоцентральные (Медведев Н.Н.,1966). На щитке (скутеллюме) располагаются четыре макрохеты: две передние и две задние скутеллярные (рис.1).
В ходе анализа полученных данных основное внимание уделялось зависимости величины и направленности биоэффектов НИЛИ ИК спектра от дозы излучения и частоты следования импульсов, как немаловажных параметров лазерного излучения. В силу того, что достаточно остро стоит вопрос мутабильности соматических клеток различных полов, облучению подвергались отличные по половой принадлежности особи
Тем более что в данных литературы однозначного ответа на данный вопрос не найдено. Дукельская А.В. и др., (1979) указывает на зависимость чувствительности полов от уровня регуляции: клеточного или имагинального диска — органа. Михеев B.C., Павлов Ю.И., (1977) исследуя имагинальный диск глаза Drosophila melanogaster, установили одинаковую частоту митотической рекомбинации в соме самцов и самок. Приведенные выводы не соответствовали данным К. Штерна (Stern С, 1936) о большей частоте соматического кроссинговера у самок и не совпадали с данными (Gatti М. et al., 1974; Абелева Э.А., Мяснянкина Е.Н., 1976) о большей чувствительности сомы самцов. Радиочувствительность генетического материала клеток сомы у обоих полов одинакова (Дукельская А.В. и др., 1979). Однако у самок интенсивно протекают процессы репарации.
В наших исследованиях облучение трех суточных самок yf//y+ff выявило большую достоверно значимую биоэффективность чей 300 Гц и 1500 Гц (табл.2) в отношении перекрестов в клетках сомы (рис.1). Среди рекомбинантов выявились как самки, так и самцы (таблица 1, приложение). Доза 65,7 мДж/см2 (1500 Гц; 4,1 Вт; 890 нм; 120 с) способствовала появлению четырех самок (частота рекомбинации 0,574±0,234 % в опыте и 0,114±0,114 % в контроле) с мозаичными клонами по гену forked, захватывающими в двух случаях правую и левую скутеллярные макрохеты (рис. 1а, приложение), в двух случаях — левую заднюю дорзоцентральную (рис. lb, приложение) и правую заднюю супраалярную макрохеты скутума D. melanogaster (рис.1). В данном случае кроссинговер наблюдался между генами yellow — forked и forked — центромера (рис. 18а, приложение). Одна самка была фенотипической yf и оказалась стерильной. Возможно, путь ее появления связан с рекомбинацией между геном forked — центромера облученной материнской и интактной X — хромосомы самца в первом делении дробления (рис.18Ь, приложение). Прошедший обмен видимо повлиял на жизнеспособность второго кроссоверного ядра у+Ґ7/у+Ґ», которое элиминировав не оставило следов данного генотипа.
Один рекомбинантный самец yf// имел мозаичный клон с нормальной формы макрохетами (0,107±0,107 в опыте, 0,110±0,110 в контроле), который захватывал переднюю и заднюю дорзоцентральные мактохеты с правой стороны торакса (табл.1, приложение).
В ходе повторного эксперимента (при использовании той же дозы) выявлены три самки с вильчатыми левой (правой) скутеллярными макрохетами (рис. 1а, приложение) и передней и задней скутеллярными bristles (одновременно), но на правой стороне тела (0,366±0,211 и 0,171±0,171 в контроле, рис.3).






























